新型节能高效植物组培专用LED光源的研制与试验
郭威威,毕 超,王 兵
(南京农业大学 农学院,江苏 南京 210095)
光作为植物生长必需的环境因素,其光谱能量分布(光质与光量)对植物组培苗的生长发育、形态建成及生理代谢等具有很大影响[1-3]。国内外学者采用荧光灯或滤光片获得光质,研究了其对康乃馨、小苍兰和仙客来[4-6]等组培苗生长的影响,但由此获得的光质无法精确定量并调制光谱能量分布,光量低且不一致,影响到结论的可靠性和可比性[7],因此研制出光谱能量分布可调的专用光源很有必要。
随着光学技术的发展,新型人工光源代替传统光源已成为趋势。发光二极管(light emitting diode,LED)作为光源已应用于植物的组织培养。LED为新型半导体光源,具有光质纯、光效高、波长类型丰富、光谱能量调制便捷、低发热、小体积、长寿命等突出优势,便于集中植物所需波长实施均衡近距离照射,可实现高效能、低热负荷和紧凑空间的集约化植物生产,将是替代传统荧光灯用于植物组织培养和工厂化快繁育苗的新一代节能环保型光源[8]。
植物对光的颜色,尤其是对红、远红和蓝3种光极其敏感。植物生长所需的光合有效辐射(PAR)在波长400~700 nm之间,其中在蓝光区(约450 nm)和红光区(约650 nm)的光合效率最高。红光与蓝光组合的光谱能量分布与叶绿素吸收光谱一致,因此可以通过增加净光合速率促进植物的生长和发育[9]。LED能发射窄单色红光光谱和蓝光光谱,与叶绿素a、b的吸收波长是相匹配的,而且LED光源可区分出不同的光质[10]。唐凤鸾等用LED光源对植物进行补充光照[11],但采用LED辐射产生的不同光质进行不同配比组合成光影响组培苗生长发育和生理指标的报道尚未见。
本研究中采用 LED调制光质和光量,红光、远红光和蓝光不同配比组合光作为光源,采用园艺生产及植物工厂广泛应用的组培材料非洲菊和菊花作为研究对象,研究不同光谱能量分布对非洲菊和菊花组培苗的光生物学效应,为其离体快繁光环境的改善和组培专用 LED光源的研发提供理论依据。
1 材料与方法
1.1 试验材料
实验于2010年4-7月在南京农业大学组培室进行。非洲菊和菊花为南京农业大学花卉研究所提供的无菌试管苗。生根培养基为1/2MS +0.2 mg·L-1NAA+25 g·L-1蔗糖 +6 g·L-1琼脂,pH调至5.8。每个容积为350 mL的玻璃瓶内接种3叶1心的高约1.5 cm的外植体4株。培养室相对湿度75% ±5%,温度(25±2)℃。
1.2 LED光源研制与光谱能量分布
LED光源由本校农学院采用厦门华联电子公司生产的红光[(658±20)nm]、远红光[(715±20)nm]和蓝光[(460±20)nm]半导体灯自主制成。如表1所示,共制作6个处理的LED组合光源并进行稳定性测试。
以华电公司制造的电工牌管状荧光灯作为白光对照,光谱能量分布如表1所示,共计7个处理。接种好的材料预培养3 d后,随机放置在不同光质配比光的光照系统及对照荧光灯之下,每种材料每处理12瓶,每处理下摆放均匀使材料受光均匀。调节电流、占空比以及光源与植株的距离,光照强度均调为 50 μmol·m-2·s-1左右,光照时间为 16 h·d-1,30 d 培养周期。
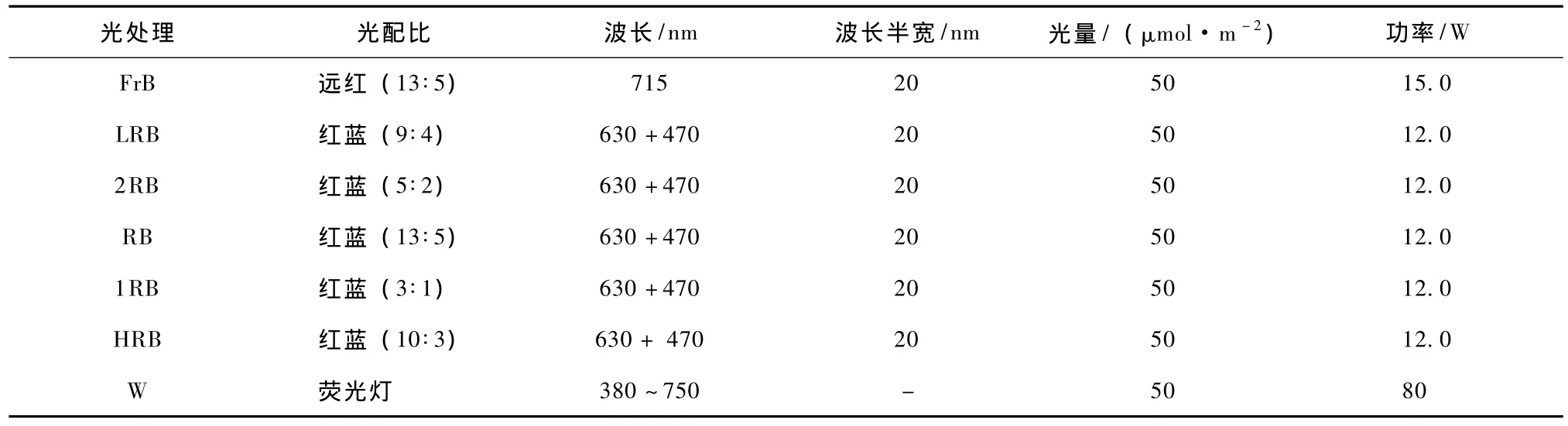
表1 LED辐射不同光质配比的主要技术参数
1.3 测定指标与数据处理
培养结束后,测量试管苗基部到顶芽的距离作为株高,根基到根尖的距离为地下部长,根基到顶芽的距离为地上部高以及植株基部茎粗,并分别称量植株的地上与地下部鲜重,放入105℃烘箱中杀青15 min,烘干至恒重,称干重,能效=干样重/耗电量。用打孔器取直径0.5 cm的叶片圆片20片,称鲜样质量,无水乙醇丙酮提取法测定上鲜样中叶绿素和类胡萝卜素含量。以上实验均重复3次,Excel进行数据整理,SPSS进行方差分析,采用Duncan进行多重比较,P<0.05。
2 结果与分析
2.1 不同光质配比光对组培苗生长的影响
2.1.1 对非洲菊的影响
由表2可看出,FrB处理非洲菊的茎粗最细,且显著低于 LRB,2RB,1RB和 HRB处理,其地上部高也较大,说明远红光与蓝光组合易使植株徒长;同理对照组的茎粗也较细,地上部显著高于其他处理,易形成细长的植株形态;而1RB与LRB茎粗较大,地上部短,较易形成壮苗;各个处理间在根长上没有显著差异;随着R/B值的增加,在茎粗上呈现先减小后上升的趋势,几乎与地上部高的结果相反。结合表3,各处理在植株的鲜重与干重上没有显著差异,但各处理的能效值显著高于对照,大约是对照的 6.1~9.3倍。总之,1RB与LRB可促进非洲菊形成矮壮苗,FrB处理可形成较细长的植株。

表2 不同光质配比对非洲菊组培苗形态指标的影响(cm)
2.1.2 对菊花的影响
对于菊花的形态指标,从表4可看出,FrB和1RB处理的茎粗显著高于 LRB,HRB及对照组,且FrB植株地上部较高,易形成高壮植株,而1RB的植株地上部较短易形成矮壮的植株;对照组的地上部高显著高于其他处理,说明这些LED光质组合在一定程度上能降低菊花苗的徒长。表5显示,FrB处理在植株的鲜重与干重上都优于其他处理且与对照组有显著差异,且其能效值也较高;其他处理组合在地上(下)部鲜重(干重)上与对照没有显著差异,但1RB在地上与地下部干重上与对照有显著差异,且其能效很高;表5反映了FrB与1RB有助于有机物的积累,使FrB植株形成高壮植株,1RB的植株形成矮壮植株,照应了表5的结果。
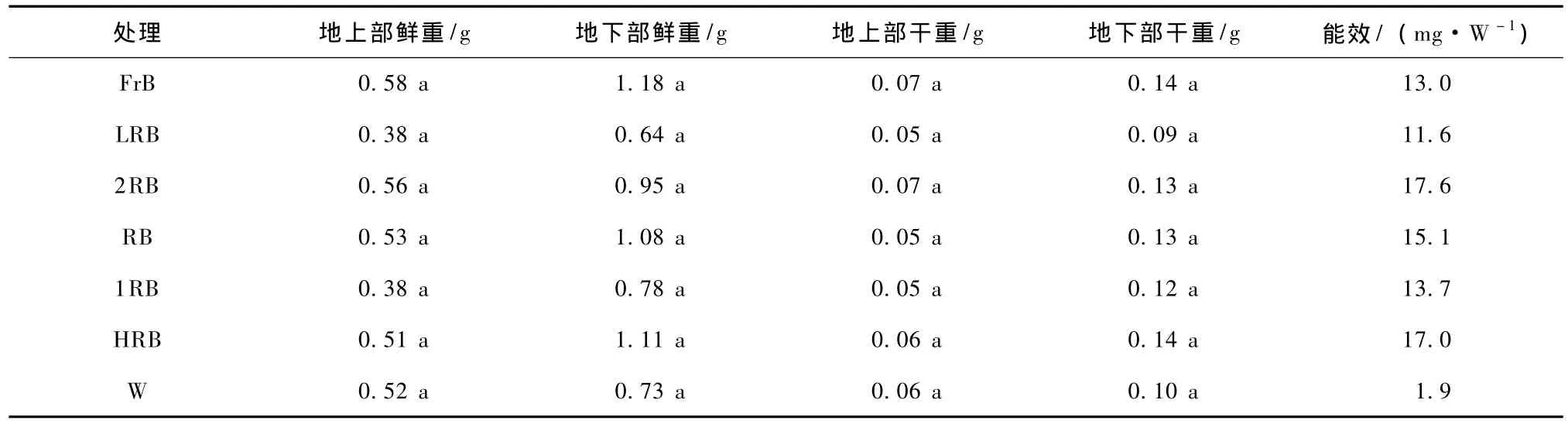
表3 不同光质配比对非洲菊有机物积累的影响

表4 不同光质配比对菊花组培苗形态指标的影响
2.2 不同光质配比光对组培苗叶中色素含量的影响
2.2.1 对非洲菊色素含量的影响
各处理在叶绿素a和b及类胡萝卜素含量上没有显著差异(表6),在总叶绿素含量上处理2RB和1RB显著低于FrB和LRB,FrB处理光合色素含量高,LRB在形成矮壮苗的同时,也能促进叶绿素的积累,综合长势较好。

表5 不同光质配比对菊花有机物积累的影响
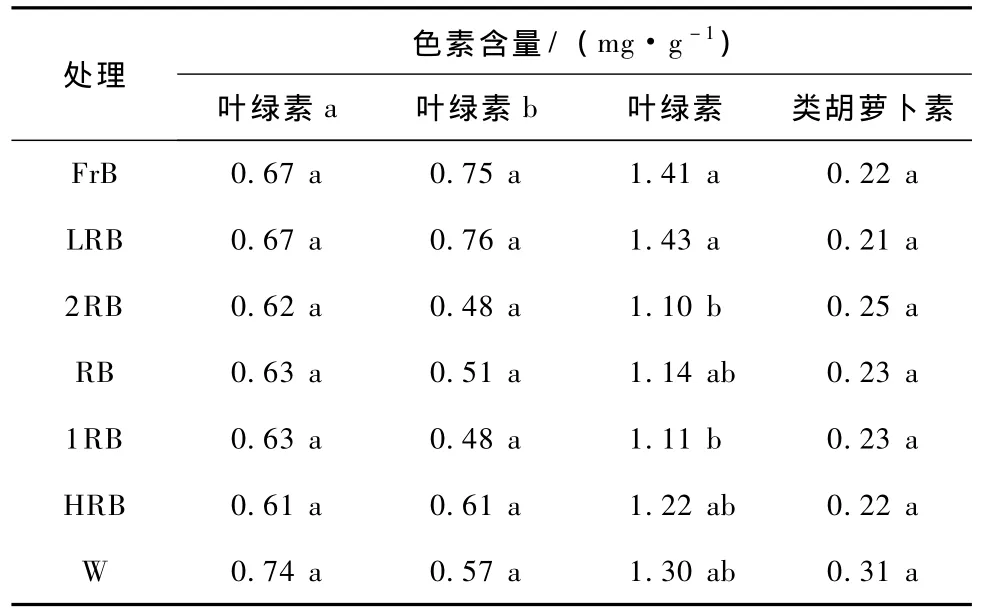
表6 不同光质配比对非洲菊色素含量的影响
2.2.2 对菊花色素含量的影响
表7显示了不同光质组合对菊花色素含量的影响,各处理在叶绿素b含量上无显著差异。处理RB结果最好,叶绿素a,叶绿素及类胡萝卜素含量最高,且显著高于处理1RB和2RB,说明1RB和2RB不利于色素的积累,这与非洲菊色素含量的结果一样。
3 小结和讨论
LRB处理使非洲菊形成矮壮苗的同时,也能促进叶绿素的积累。FrB处理使菊花形成高壮植株,1RB处理使菊花形成矮壮植株,RB处理利于菊花光合色素的形成。1RB和2RB处理均不利于非洲菊和菊花光合色素的积累。各处理的能效值均远远大于对照,为节能提供了可能。

表7 不同光质配比对菊花色素含量的影响
在以上的结果中也存在一些矛盾的地方:对于菊花,FrB和1RB处理都能使植株形成壮苗,但它们的根不是很发达,根长显著低于一些组合,因为根是植物吸收养分的主要组织,而不是很发达的根可形成壮苗,这其中的原因还需要我们去研究。
试验对非洲菊和菊花进行了研究,试验结果表明不同材料、不同生长及生理指标所需最优的光质组合不同,本试验为研制专用的植物组培光源提供了参考。传统的荧光灯其光谱能量分布不符合植株生长需求,发热量大,引起电能损耗和浪费[12]。光谱能量分布可调的LED光源其能效明显高于荧光灯,突显了LED用于植物组培和工厂化快繁育苗产业的高能效特征,是替代荧光灯的理想光源。
[1]车生泉,盛月英,秦文英.光质对小苍兰茎尖试管培养的影响[J].园艺学报,1997,24(3):269-273.
[2]倪德祥,张丕方,陈刚.光质对康乃馨试管苗生长发育的影响[J].园艺学报,1985,12(3):197-202.
[3]庞基良,林波,梁海曼.激素、光照对仙客来叶片愈伤组织诱导、分化及试管苗生长的影响[J].园艺学报,1994,21(1):103-104.
[4]唐凤鸾,黄宁珍,黄志民,等.自然光照下补照不同光质光对马蹄莲光合速率及生长的影响[J].植物生理学通讯,2007,43(5):879-881.
[5]童哲.光质纯度对幼苗光形态建成的影响[J].植物生理学通讯,1989,(2):28-31.
[6]吴沿友,刘健,胡永光,等.发光二极管作为组培光源的特性分析与应用[J].江苏大学学报,2007,28(2):93-96.
[7]Bach A,Krol A.Effect of light quality on somatic embryogenesis in Hyacinthus orientalis L.‘Delft's blue’[J].Biological Bulletin of Poznan,2001,38(1):103-107.
[8]Goins G D,Yorio N C,Sanwo M M,et al.Photomorphogenesis,photosynthesis,and seed yield of wheat plants grown under red light-emitting diodes(LEDs)with and without supplemental blue lighting[J].J Exp Bot,1997,48:1407-1413.
[9]Kim H H,Goins G D,Wheeler R M,et al.Green-light supplementation for enhanced lettuce growth under red-and blue-light-emitting diodes[J].Hort Science,2004,39(7):1617-1622.
[10]Kodym A,Zapata-Arias F J.Natural light as an alternative light source for the in vitro culture of banana(Musa acuminata cv.‘Grande Naine’)[J].Plant Cell,Tissue and Organ Culture,1999,55(2):141-145.
[11]Onofrio C D,Morini S,Bellocchi L G.Effect of light quality on somatic embry ogenesis of quince leaves[J].Plant Cell,Tissue and Organ Culture,1998,53(2):91-98.
[12]Ouyang J,Wang X D,Zhao B,et al.Light intensity and spectral quality in fluencing the callus growth of Cistanche deserticola and biosynthesis of phenylethanoid glycosides[J].Plant Science,2003,165:657-661.

