植物AGAMOUS基因调控机制研究进展
徐雷,王利琳
(1.江苏新天地生物肥料工程中心有限公司,江苏无锡214200;2.杭州师范大学生命与环境科学学院,浙江杭州310036)
20世纪90年代,Coen和Meyerowitz对拟南芥和金鱼草花器官突变体(主要是MADS-box转录因子的代表性突变体)进行遗传分析,提出了花器官形态建成的粗糙的“ABC模型”,后来经过众多学者的修改和补充,该模型发展为“ABCDE”模型。其中,C功能基因AGAMOUS(AG)在花器官发育中扮演着重要的角色,对果实和种子的形成也至关重要。花发育调控基因的上下游基因及其功能是目前植物发育遗传学的研究热点之一,AG基因是最早被克隆的花发育调控基因,其上下游基因及其功能研究更是其中的热点,明确其作用分子机制对于农艺、园艺和基因控制技术具有重要的价值。
1990年,Yanofsky等在拟南芥中首次克隆了花同源异型基因AG。在拟南芥中,AG与APETALA1(AP1)基因、APETALA2(AP2)基因相互拮抗,同时AG还与WUSCHEL(WUS)相拮抗,终止WUS的花分生组织指定,它还是第4轮花器官发育的指定基因。在胚珠的发育中,AG也发挥着重要的调控作用。在其他一些物种中,AG同源基因相对保守,但是部分发生了复制,而且彼此功能冗余。虽然目前对AG基因已进行了较多的研究,但是对于在花发育调控网络中,AG的上下游基因及其作用的分子机制,目前还没有文章进行综述。
1 AG序列分析及特征
AG早在裸子植物和被子植物分化之前就已经出现,并且在随后3亿年的进化过程中功能保守[1]。目前已有20多种植物(包括裸子植物和被子植物)的AG同源基因被克隆。序列分析和基因表达研究也表明,尽管这些基因在序列上有差异,但功能相近[2]。
AG基因序列分为5个区域,从5’端开始依次命名为N末端、M区(编码约57个氨基酸的MADS-box区)、I区(Intervening region)、K区和C末端。M区高度保守,I区和K区相对保守,C末端特异性较强。其编码285个氨基酸的转录因子,含有9个外显子,8个内含子。
AG亚家族的C类基因(通过进化树分析,所有AGAMOUS-LIKE基因分为3类:C类、D类(基于该进化枝含有矮牵牛FBP7和FBP11)、裸子植物类),在C末端具有2个相对保守的区域,被称为AGⅠ区和AGⅡ区[3]。本研究通过对最近发布的豆目植物AG序列豌豆AG同源基因PsAG[4]、百脉根LjAGa和LjAGb[1]进行软件预测氨基酸序列比对,也发现这2个相对保守区的存在(图1)。结合高志红等[2]的判断,可以验证此为AG同源基因的特征之一。

图1 PsAG、LjAGa、LjAGb、AG蛋白预测氨基酸序列比对
2 拟南芥AG分子作用机制
自从1990年在拟南芥中克隆到AG之后,至今,对花发育及控制花形态建成的分子遗传机制的研究取得了很多的进展,主要都是建立在对拟南芥研究的基础之上。拟南芥花自外向内,第1轮为萼片,第2轮为花瓣,第3轮为雄蕊,第4轮为心皮。
2.1 拟南芥AG时空表达模式
在拟南芥野生型花中,AG mRNA和蛋白在花发育第3阶段,花的第3、4轮检测到[5]。AG表达的时空性保证了花器官属性,花器官数量和模式的正确[6]。
2.2 拟南芥AG功能
目前公认AG至少具有4个功能:抑制A功能基因;终止花分生组织;指定雄蕊和心皮属性;调控胚珠的发育。AG的正确表达需要第2个内含子,它有3 kb大小,含有2个CArG-box[7],是调控蛋白的目标序列[7-8],如正调控蛋白LFY、WUS,负调控蛋白LUG、SEU、BLR、AP2等。
2.3 拟南芥AG与上下游基因分子作用机制
在花发育调控网络中,AG与众多基因相互作用。在不同的途径中,其位置处于相对的上游或下游,这是复杂的调控网络所导致的。在此,每个作用途径中,我们分别加以阐述(图2)。
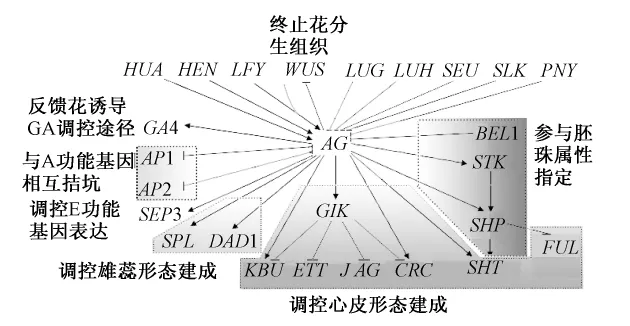
图2 AG上下游作用基因及其功能(箭头为正调控,短线为负调控)
AP1和AP2抑制AG在第1、2轮的表达,而AG也抑制它们在第3、4轮的表达。对于AP1,是由SEUSS(SEU)或SEUSS-like
(SLK)蛋白作为衔接蛋白把LEUNIG(LUG)蛋白与AP1蛋白和SEP3蛋白结合,构成复合体,直接结合AG第2个内含子,抑制AG在第1、2轮的表达。LEUNIG-HOMOGOG(LUH)是LUG的旁系同源基因,LUH蛋白也是与SEU蛋白组成复合体,抑制AG的表达。在负调控AG时,LUG比LUH更重要[7,9-10]。在环境胁迫条件下,LUG和LUH功能有所不同[10]。
LFY蛋白是AG表达的直接激活子[11],但其本身还不足以诱导AG,需要其他的因子辅助,可能是WUS[11]。酵母实验显示,LFY和WUS分别独立地结合AG第2个内含子的不同区域[12],但是AG的转录只有在WUS和LFY同时存在时,才被激活[13]。WUS和LFY之间作用部分冗余,因为WUS的过表达能够减少AG激活时对LFY的需求,而且wus和lfy突变体显示出累加的表型[12]。至于WUS和LFY两者之间如何相互作用,还不清楚。WUS是终止花分生组织的关键且明确的调节开关[11]。WUS激活AG,而AG表达后以非直接的方式抑制WUS[13],这样产生一个负反馈环,以调节细胞增生与花分生组织的分化[12]。AG虽然没有影响WUS表达区域,但是在约第7阶段,心皮原基形成时,AG达到足够的水平,关闭了WUS的表达[11,14],以终止花分生组织。除了AG,WUS也受到CLV途径的负调控。AG和CLV途径主要是独立发挥功能,因为ag和clv1突变体在分生组织决定上的效果是累加的[12-13]。
BELLRINGER(BLR即PENNYW ISE(PNY))编码一个BELL同源结构域蛋白,BLR蛋白直接结合到AG的第2内含子,抑制AG表达。blr突变体老的茎终端花中萼片转变为心皮[8]。
HUA和HEN基因可能在AG RNA加工中发挥功能,在花发育后期维持AG的表达。HUA1蛋白类似CCCH锌指蛋白,能结合单链RNA和DNA;HUA2蛋白含有核定位信号,有转录激活活性。HUA ENHANCER 1(HEN1)蛋白是个核蛋白,是microRNA积聚所需要的;HEN2蛋白类似DexH-box RNA解旋酶,有核定位信号,可能是核酸外切酶的一个成分,它还参与了AG mRNA前体的加工[15]。HEN4蛋白含有KH结构域,是RNA结合蛋白,与HUA1蛋白定位相同并且相互作用,在营养器官发育中也发挥作用[15]。HEN4,HUA1和HUA2可能阻止了发生在AG第2个内含子内的转录提前终止,通过利于AG mRNA前体的加工来发挥在花生殖器官属性和花分生组织终止指定中的作用[15]。另外,HUA1,HUA2,HEN1功能冗余地维持B类功能基因的表达,它们也在营养器官发育中发挥作用[16]。
上述基因主要作为相对的AG上游基因发挥作用,调控AG的时空表达模式或调控其表达量,以此为基础,AG再发挥相应的功能。LFY和WUS促进AG表达,AP1和AP2调控其限于心皮和雄蕊中表达,HUA和HEN则负责调控AG的正确转录和加工。在花发育后期,BLR调控茎终端花中AG的表达部位;而HUA和HEN维持其表达。
AG调控着下游约1 000个基因的表达[17]。其中已确定AG蛋白直接与AG、AP3、CRC、SEP3、DAD1和GA4启动子CArG-box结合,促进其表达[18-19]。其中,AG通过调控GA4的表达,促进GA的生物合成[18],以对GA开花诱导途径提供反馈。
AG主要通过调控SPL和DAD1,调控雄蕊的形态建成。
AG调控SPL的表达,诱导小孢子产生,形成花粉。在花发育第5~6阶段,AG足以激活SPL发挥功能[17],但是并不参与维持其表达[20]。另外,还有其他的轮特异因子参与小孢子发生的诱导[20]。
在花发育后期阶段,AG是花药形成和分裂以及花丝的建成和延长所必需的[17]。DEFECTIVE IN ANTHER DEHISCENCE1(DAD1)编码茉莉酸生物合成起始步骤的催化酶,在花发育后期,AG蛋白结合到DAD15’编码区中10 bp的CArG区,上调DAD1在雄蕊中的表达[17],而茉莉酸控制着雄蕊的成熟,这样,AG通过控制茉莉酸的合成起始,从而协调雄蕊的成熟。DAD1还受到AUXIN RESPONSE FACTOR 6(ARF6)和AUXIN RESPONSE FACTOR 8(ARF8)的正调控,通过茉莉酸途径,控制着内三轮花器官的长度,影响花的开放[21]。
AG通过调控SPT、CRC、GIK、KNU等基因,调控心皮的形态建成。
SPATULA(SPT)编码螺旋—环—螺旋转录因子,控制着心皮边缘和传导管(the transmitting tract)的细胞增殖[18]。它的表达可能同时受到AG和SHP的冗余调控[22]。
CRABSCLAW(CRC)表达于心皮的远轴部位,参与到心皮原基远轴组织(如外部表皮组织)的发育[18],也涉及雌蕊和蜜腺的指定[19]。CRC可以在AG不存在的情况下,指导心皮发育,但是AG可以强化其表达。CRC也可以激活AG[18]。
AG直接结合到GIK下游732bp的CArG box,上调它的表达。GIANT KILLER(GIK)编码一个AT-hook类型的DNA结合蛋白,AT-hook基序结合目标DNA序列核基质附着区(Matrix attachment regions,MARs)的DNA双螺旋的小沟,不同于通常的转录因子主要结合大沟。植物中,对AT-hook基序蛋白在发育中的作用了解还很少[19]。GIK蛋白持续结合到ETT的MARs,负调控ETT的表达,而且这种抑制与ETT启动子中H3K9的二甲基化的动态变化密切相连。在体外,GIK直接结合到CRC、JAG和KNU的MARs,抑制它们的转录,在体内,gik突变体中,JAG和KNU的mRNA水平相对较高,CRC轻微增加[19]。ETTIN(ETT,AUXIN RESPONSE FACTOR3)与AUXIN RESPONSE FACTOR 4(ARF4)作用冗余,参与花分生组织和生殖器官的近远轴模式,以及雌蕊的顶基轴模式建成[19]。JAGGED(JAD)、KNUCKLES(KNU)和NUBBIN(NUB)编码C2H2锌指转录因子,作用冗余地促进雄蕊和心皮原基的增生[19]。KNU涉及花分生组织的决定和配子体的指定,它在分生组织的表达直接受到AG的调控[19]。AG参与胚珠的发育,此结论最初来自于ap2单突变与ap2 ag双突变的比较。在ap2单突变体中,花瓣大部分缺失,萼片转变成心皮结构,在上面有胚珠形成,其中一些转变成心皮化的结构。而ap2 ag双突变体中,萼片也表现心皮属性,但是胚珠转变成心皮结构,数目显著增加,这暗示着AG也参与胚珠的指定[23]。其作用的分子机制可能是由于SHP1,SHP2,STK同时受到AG的调控,而它们控制胚珠的发育。在心皮中,AG蛋白和SEP蛋白可能与STK或SHP蛋白之一组成稳定的复合体促进胚珠发育,同时这些复合体中任何一个可能都足够促进心皮发育[24]。
在拟南芥中,胚珠作为新的分生组织从心皮组织中形成。WUS在珠心中表达,类似在茎顶端和花分生组织中的作用方式,以非细胞自主的形式,控制胚珠原基中细胞增生[23]。随后,增生细胞命运由胚珠属性因子所指定,如同源异形因子BELL1(BEL1)和MADS-box家族成员SEEDSTICK(STK)、SHATTERPROOF1(SHP1)、SHP2及AG[23],而WUS的表达再次受到AG和SEP3蛋白的抑制[5],BEL1可能在蛋白质水平负调控AG并且维持WUS的抑制状态[23]。对于胚珠中,WUS短暂的表达起始,其调节机制现在还不了解。
通过酵母三杂交和遗传分析,Brambilla等[23]发现SHP1、SHP2、STK和AG分别与SEP蛋白形成二聚体后和BEL1相互作用,控制珠被的属性和形成。
FRUITFULL(FUL)也与心皮发育有关,参与调控受精后心皮瓣(valve)细胞分化和增大,可能与SHP相互拮抗[25]。
SEP蛋白在AG发挥功能时,也具有重要的作用。SEP蛋白能够建立促进心皮和胚珠发育的蛋白间的相互作用,没有足够的SEP活性,胚珠发育中的主要基因无法发挥功能[24]。其中,在促进心皮发育时,SEP3比SEP1、SEP2更有效,而AG直接促进SEP3的表达[24],这也有利于自身功能的发挥。
AG在不同的时期发挥不同的功能(图3)。目前对A调控花药和花丝形态建成时的目标基因还不明确,对AG调控胚珠发育的作用时期也不明确,这些还有待进一步的深入研究。

图3 AG主要作用时间
3 其他植物中AG基因
目前已经克隆了20多种植物的AG同源基因,其中部分出现了复制,如百脉根中,它们的表达模式也发生了变化,其功能还有待进一步的研究。而同样的豆目植物豌豆中,我们通过豌豆早褐病毒对PsAG的保守序列进行沉默,发现在豌豆中也出现了复制,但是功能相对保守[26]。
在其他植物中,AG花器官属性指定和花分生组织决定功能,通常不是由单个的AG同源基因来发挥的。在玉米中,这些功能由不同的AG旁系同源基因来执行。在拟南芥中,这2个功能也是可分的,如在拟南芥反义RNA或弱突变(如ag-4,它产生一个内部缺失的AG蛋白)造成的部分AG缺失的植株中就会出现分生组织不终止,但是器官属性正常,即花内生花的现象。如此表明器官属性功能并不明显地与分生组织终止功能重叠。我们通过豌豆早褐病毒,在豌豆中,对PsAG保守序列进行沉默时,也发现了这样的现象。
在裸子植物中,AG同源物与孢子叶球的发育的联系,表明AG在生殖器官属性指定中的角色是古老的,但是同时它也提示这些孢子叶球是决定的,即其分生组织是终止的。
ag突变体中外围花器官数目增加,但是在玫瑰中,花瓣和雄蕊的增加和最终的花分生组织的终止也可以由花分生组织的定点增大而引起,就像在sup和ult突变体中所见[13]。所以现在对这一结果,还不能肯定的归为AG的一个功能。
4 展望
AG基因在植物花器官的发育中占有重要位置,与植物的繁殖息息相关,在植物的进化过程中,其功能相对保守,没有发生较大的变化。
目前确定的4个AG功能,彼此关联,共同起到调控花正常发育的作用。但是对这些功能发挥的途径,了解还不多,其下游基因开发较少,还有许多基因有待确定,比如雄蕊形态建成的启动基因还不清楚。随着更多下游基因的确定,才能更清晰地认识植物花器官的发育调控网络,对于植物花器官改造具有重要意义,具有重要的园艺价值。
利用AG的功能来控制外来物种入侵具有重要意义。目前对AG功能的研究已经成功拓展应用到基因控制技术中,Liu等[27]把AG第2个内含子与白喉毒素A片段(Diphtheria toxin A,DT-A)的基因相融合,发现超过89%转基因拟南芥雄蕊和心皮消除,完全不育。
由于AG基因位于调控植物果实和种子发育的基因上游,明确其不同的调控途径,无疑对于作物的育种或果树的挂果研究具有参考价值。
[1]Dong Z C,Zhao Z,Liu C W,et al.Floral Patterning in Lotus japonicus[J].Plant Physiol,2005,137:1272-282.
[2]高志红,张玉明,王珊,等.植物花发育调控基因AGAMOUS的研究进展[J].西北植物学报,2008,28:638-644.
[3]Kramer E M,Jaramillo M A,Di Stilio V S.Patterns of gene duplication and functional evolution during the diversification of the agamous subfamily of MADS box genes in angiosperms[J].Genetics,2004,166:1011-1023.
[4]Hecht V,Foucher F,Ferrandiz C,et al.Conservation of Arabidopsis flowering genes in model legumes[J].Plant Physiol,2005,137:1420-1434.
[5]Urbanus S L,de Folter S,Shchennikova A V,et al.In planta localization patterns of MADS domain proteins during floral development in Arabidopsis thaliana[J].BMC Plant Biol,2009,9:1-16.
[6]Liu Z.Transcription co-repressors in flower development[J].Chin Bull Bot,2003,20:385-394
[7]Gregis V,Sessa A,Colombo L,et al.AGL24,SHORT VEGETATIVE PHASE,and APETALA 1 redundantly control AGAMOUS during early stages of flower development in Arabidopsis[J].Plant Cell,2006,18:1373-1382.
[8]Bao X,Franks R G,Levin J Z,et al.Repression of AGAMOUS by BELLRINGER in floral and inflorescence meristems[J].Plant Cell,2004,16:1478-1489.
[9]Sridhar V V,Surendrarao A,Liu Z.APETALA1 and SEPALLATA 3 interact with SEUSS to mediate transcription repression during flower development[J].Development,2006,133:3159-3166
[10]Sitaraman J,Bui M,Liu Z.LEUNIG-HOMOLOG and LEUNIG perform partially redundant functions during Arabidopsis embryo and floral development[J].Plant Physiol,2008,147:672-681.
[11]Lenhard M,Bohnert A,Jürgens G,et al.Termination of stem cellmaintenance in Arabidopsis floral meristems by interactions between WUSCHEL and AGAMOUS[J].Cell,2001,105:805-814.
[12]Lohmann JU,Hong R L,Hobe M,et al.A molecular link between stem cell regulation and floral patterning in Arabidopsis[J].Cell,2001,105:793-803.
[13]Sablowski R.Flowering and determinacy in Arabidopsis[J].J Exp Bot,2007,58:899-907.
[14]Zhao L,Kim Y J,Dinh T T,et al.miR172 regulates stem cell fate and defines the inner boundary of APETALA 3 and PISTILATA expression domain in Arabidopsis floral meristems[J].Plant J,2007,51:840-849.
[15]Cheng Y,Kato N,Wang W,et al.Two RNA binding proteins,HEN4 and HUA1,act in the processing of AGAMOUS pre-mRNA in Arabidopsis thaliana[J].Dev Cell,2003,4:453-466.
[16]Jack T.New members of the floral organ identity AGAMOUS pathway[J].Trends Plant Sci,2002,7:286-287
[17]Ito T,Ng K H,Lim T S,et al.The homeotic protein agamous controls late stamen development by regulating a jasmonate biosynthetic gene in Arabidopsis[J].Plant Cell,2007,19:3516-3529.
[18]Gómez-Mena C,Folter S,Rosta M M,et al.Transcriptional program controlled by the floral homeotic gene AGAMOUS during early organogenesis[J].Development,2004,132:429-438.
[19]Ng K H,Yu H,Ito T.AGAMOUS controls GIANT KILLER,a multifunctional chromatin modifier in reproductive organ patterning and differentiation[J].PLoS Biol,2009,7(11):1000251.
[20]Ito T,Wellmer F,Yu H,et al.The homeotic protein AGAMOUS controls microsporogenesis by regulation of SPOROCYTELESS[J].Nature,2004,430:356-360.
[21]Tabata R,Ikezaki M,Fujibe T,et al.Arabidopsis auxin response facror 6 and 8 regulate jasmonic acid biosynthesis and floral organ development via repression of Class 1 KNOX genes[J].Plant Cell Physiol,2010,51:164-175.
[22]Pinyopich A,Ditta G S,Savidge B,et al.Assessing the redundancy of MADS-box genes during carpel and ovule development[J].Nature,2003,424:85-88.
[23]Brambilla V,Battaglia R,Colombo M,et al.Genetic and molecular interactions between BELL1 and MADS Box factors support ovule development in Arabidopsis[J].Plant Cell,2007,19:2544-2556.
[24]Favaro R,Pinyopich A,Battaglia R,et al.MADS-box protein complexes control carpel and ovule development in Arabidopsis[J].Plant Cell,2003,15:2603-2611.
[25]Liljegren S J,Ditta G S,Eshed Y,et al.SHATTERPROOF MADS-box genes control seed dispersal in Arabidopsis[J].Nature,2000,404:766-770.
[26]徐雷,宋伟杰,王利琳.豌豆AGAMOUS同源基因功能的初步研究[J].科学通报,2009,54:3207-3212.
[27]Liu Z R,Liu Z C.The second intron of agamous drives carpeland stamen-specific expression sufficient to induce comp lete sterility in Arabidopsis[J].Plant Cell Rep,2008,27:855-863.

