国产和进口盐酸氨溴索片的人体生物等效性研究
王国才,张 丹,杨 漫,韩 静,郑天雷,王振龙,王 涛,刘会臣
(航天中心医院临床药理室,北京 100049)
氨溴索(ambroxol)又叫溴环乙胺醇,是溴己胺的体内活性代谢产物,是一种黏痰溶解剂及肺表面活性物质合成促进剂,主要用于急、慢性呼吸道疾病引起的痰液黏稠、咳痰困难等。本试验采用液相色谱-串联质谱联用法(LC-MS/MS)测定人血浆中的氨溴索浓度,研究盐酸氨溴索片人体相对生物利用度并评价其生物等效性。
1 仪器与试药
API 3200型三重四极杆串联质谱仪,配电喷雾离子化源(ESI)和Analyst 1.4.2数据处理软件;Prominence 20A型液相色谱仪,包括LC-20AD型二元泵,DGU-20A3型脱气机,SIL-20A型自动进样器,CTO-20A型柱温箱,CBM-20A系统控制器;QB-600型高速振荡混合器(海门市其林贝尔仪器);Sigma 3-18K台式高速离心机(德国Sartorius Stedim Biotech)。盐酸氨溴索片(受试制剂,北京京丰制药有限公司,规格为30 mg/片,批号为100401;参比制剂,上海勃林格殷格翰药业有限公司,规格为30 mg/片,批号为984220);盐酸氨溴索对照品(中国药品生物制品检定所,批号为100599-200502);盐酸苯海拉明对照品(中国药品生物制品检定所,批号为0066-9705);甲醇(色谱纯,Fisher公司,批号为094345);超纯水。
2 方法与结果
2.1 受试者选择
选择 20 名受试者,平均年龄(24±2)岁,体重(61.3 ±5.2)kg,身高(1.71±0.06)m。试验前体格检查、实验室检查(血常规、尿常规、肝功能、肾功能、血糖、乙型病毒性肝炎表面抗原、梅毒、艾滋病抗体)、心电图检查、胸片检查均合格。受试者无过敏体质、药物过敏史、晕针史,试验前两周内未用任何的药物。试验前均签署知情同意书。
2.2 给药方案与血样采集
根据国内外已上市氨溴索片的药品说明书,本试验采用临床常用剂量30 mg。采用随机双周期自身交叉对照试验设计,每名受试者分2周期口服受试制剂和参比制剂各1次,间隔时间为1周。受试者于试验前1天下午入住药物临床试验病房,吃清淡晚餐,餐后禁食不禁水;第2天早上8:00点,由医护人员发放受试制剂或参比制剂,受试者空腹给药,用200 mL温开水送服。用药后保持上身直立状态2 h,其后可自由饮水,4 h后统一进食标准餐。试验过程中,禁用其他药物或含咖啡因的饮料,禁止吸烟、饮酒,按时休息,避免剧烈活动。受试者于用药前和用药后 0.25,0.5,1,1.5,2,2.5,3,4,6,8,12,24,36 h 时从肘静脉取血约 3 mL,3000 r/min离心10 min,取血浆,立即置-80℃冰箱中保存备测。
2.3 血药浓度测定
2.3.1 色谱条件及质谱条件
预柱:Phenomenex C18柱(4.0 mm ×3.0 mm,5 μm);色谱柱:Zorbax SB -C18Narrow Bore 柱 (150 mm ×2.1 mm,5 μm);流 动相:甲醇-含0.1%甲酸的10 mmol/L乙酸铵(65∶35);流速:0.3 mL/min;柱温:30 ℃;进样量:5 μL。
离子源:离子喷雾离子化源;离子喷射电压:4500 V;温度:450 ℃;源内气体 1(GS1,N2)压力:45 psi;气体 2(GS2,N2)压力:35 psi;气帘气体(N2)压力:20 psi;正离子方式监测;扫描方式为多重反应监测(MRM);用于定量分析的离子反应分别为 m/z 379.1→m/z 264.1(氨溴索)和 m/z 256.2 → m/z 167.3(苯海拉明),解簇电压(DP)分别为 45,15 V,碰撞能量(CE)分别为 29,20 eV;碰撞气(CAD,N2)压力:3 psi;Q1分辨率:UNIT;Q3分辨率:LOW。
2.3.2 溶液制备
精密称取盐酸氨溴索对照品10.96 mg(相当于10.00 mg氨溴索),置10 mL容量瓶中,加甲醇溶解并定容至刻度,配制成1.00 g/L的氨溴索母液。精确吸取氨溴索母液300 μL,置10 mL容量瓶中,用乙腈定容至刻度,配制成质量浓度为30.0 μg/mL的氨溴索对照品贮备液。取适量氨溴索对照品贮备液,用乙腈稀释成质量浓度分别为30.0,300,2400 ng/mL的质控溶液。分别取适量氨溴索对照品贮备液,用空白血浆稀释成质量浓度分别为1.00,3.00,10.0,30.0,100,300 ng/mL 的标准曲线样本。分别取适量氨溴索对照品贮备液,用空白血浆稀释成质量浓度分别为3.00,30.0,240 ng/mL的质控样本。精确称取盐酸苯海拉明 5.40 mg(相当于苯海拉明4.8 mg),溶于6 mL甲醇-水(1∶1)的混合溶液中,配制成0.800 g/L的母液;精确取10 μL苯海拉明母液,置990 μL乙腈中,配制成相当于苯海拉明8.00 μg/mL的贮备液;精确取312.5 μL苯海拉明贮备液,置50 mL容量瓶中,用乙腈定容至刻度,配制成质量浓度为50.0 ng/mL的苯海拉明内标溶液,于4℃冰箱中保存。
2.3.3 血浆样本处理
取血浆 100 μL,分别加入内标溶液 10 μL,乙睛 290 μL,涡流1min,10000 r/min离心 10 min,取 150 μL上清液于进样瓶中进行分析。
2.3.4 方法学考察
质谱分析:用蠕动泵分别将氨溴索的乙腈溶液(500 ng/mL)和内标苯海拉明的乙腈溶液(1.00 μg/mL)以5 μL/min的恒定流速泵入MS/MS系统,相应的二级全扫描质谱图见图1。
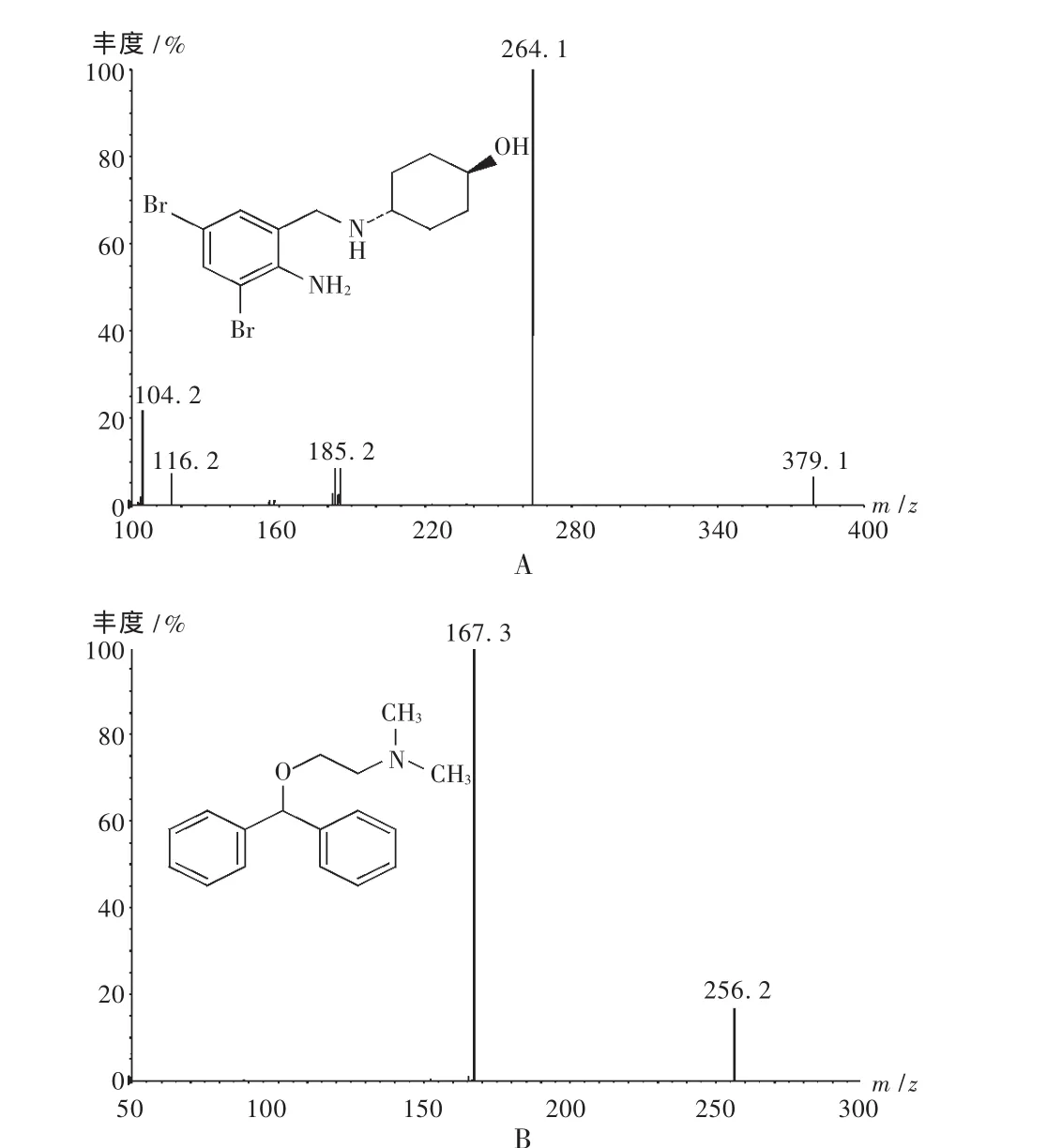
图1 二级全扫描质谱图
专属性考察:在拟订的色谱条件下,空白血浆中的内源性物质不干扰氨溴索和苯海拉明的测定。测定低、中、高3个质量浓度血浆样本中氨溴索的基质效应分别为(112.2±2.9)% ,(110.3±3.1)%,(114.4 ±2.9)%,平均基质效应为(112.3 ± 3.3)%;苯海拉明的基质效应为(103.2±3.5)%。相关色谱图见图2。
标准曲线绘制和定量下限确定:取标准曲线样本100 μL,按2.3.3项下操作,以血浆中待测物质量浓度为横坐标、待测物与内标的峰面积比值为纵坐标,用加权(W=1/x2)最小二乘法进行回归运算,求得回归方程 Y=0.0163 X -0.00152(r=0.9992)。最低定量质量浓度为1.00 ng/mL,氨溴索质量浓度的线性范围为1.00 ~300 ng/mL。
准确度与精密度试验:按2.3.3项下操作,氨溴索低、中、高3个质量浓度的质控样本,每质量浓度6样本,连续测定3个分析批次,以同1分析批的工作曲线计算质控样本的质量浓度,根据测定结果计算方法的准确度与精密度。结果见表1,RE均在±15%以内,批内、批间 RSD均小于15%。
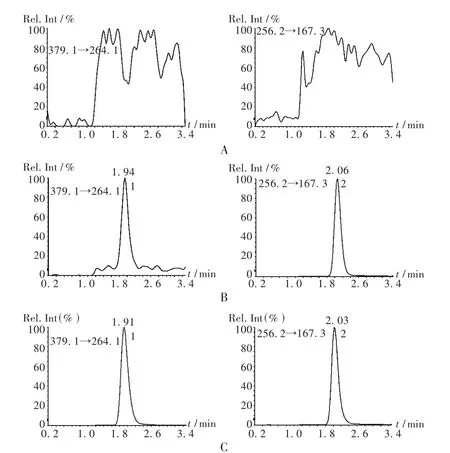
图2 高效液相色谱图
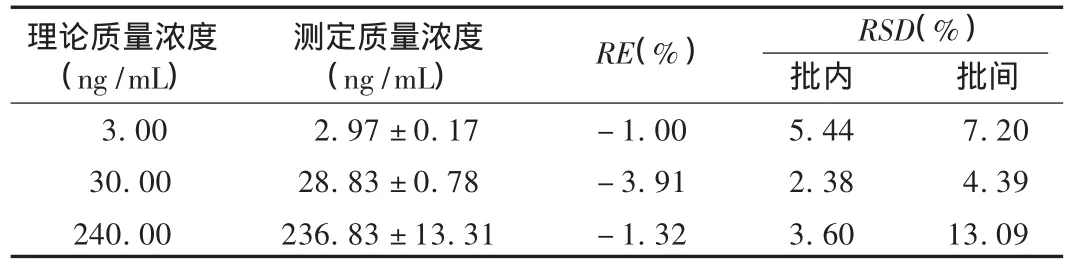
表1 准确度与精密度试验结果(n=18)
提取回收率试验:按2.3.3项下操作,处理氨溴索低、中、高3个质量浓度的质控样本,由标准曲线求出各样品的质量浓度,计算提取回收率。低、中、高3个质量浓度血浆样品中氨溴索的提取回收率分别为(83.4 ±2.5)% ,(91.0 ±1.2)% ,(92.4 ±4.1)%,平均提取回收率为(88.9±4.9)%;血浆样品中苯海拉明的提取回收率为(90.0±2.2)%。
2.4 生物等效性评价
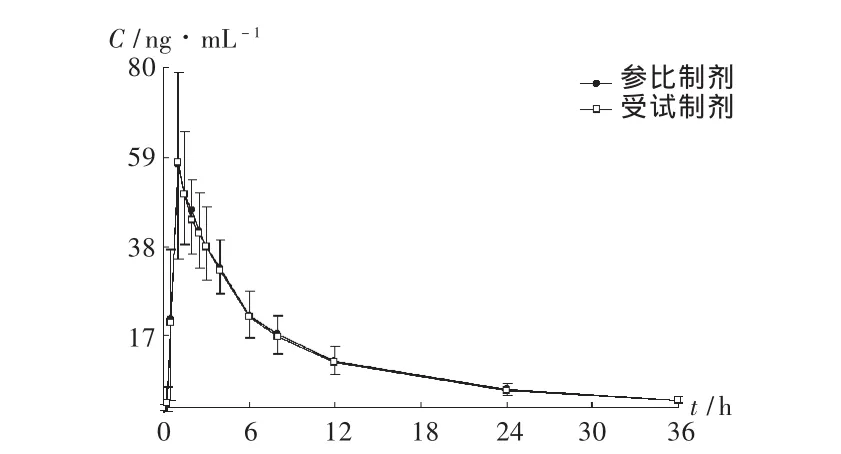
图3 平均血药浓度-时间曲线

表2 两种盐酸氨溴索片在人体内的药代动力学参数
20名志愿者口服氨溴索片受试制剂和参比制剂后,平均血药浓度-时间曲线见图3,主要药代动力学参数见表2。盐酸氨溴索片受试制剂的平均相对生物利用度为(99.3±14.8)%(以 AUC0-t计)和(98.5 ±14.2)%(以 AUC0-∞计)。主要药代动力学参数血药峰浓度(Cmax)、药时曲线下面积(AUC0-t,AUC0-∞)经对数转换后进行方差分析、双向单侧 t检验和90%置信区间计算,达峰时间(tmax)采用配对Wilcoxon法检验,结果表明2种制剂具有生物等效性。
3 讨论
国内外测定氨溴索血药浓度的方法主要是高效液相色谱法[1-5]和液质联用法[6-11],但普遍存在着血浆用量大[2-5]、检测时间长[10]、样本处理过程复杂[8-9]等问题。徐红蓉等[6]研究盐酸氨溴索分散片的药代动力学和生物等效性时,检测时间为4.5 min,但内标需要避光,增加了样本处理的难度。本试验采用液相色谱-串联质谱法测定氨溴索的血药浓度,选用苯海拉明为内标(无需避光),沉淀蛋白处理样品,血浆用量仅100 μL,检测时间为3.5 min。试验方法选择性好、灵敏度高、检测时间短,能够满足氨溴索片的人体药代动力学研究及生物等效性研究的需要。本试验获得了盐酸氨溴索片受试制剂与参比制剂的主要药代动力学参数,生物等效性评价显示两种制剂生物利用度相当,结果表明国产和进口盐酸氨溴索片在体内的吸收、分布、消除过程一致,统计学分析证明两种盐酸氨溴索片生物等效。
[1]李 珍,徐学君,沈意翔,等.国产盐酸氨溴索片在健康人体内的生物等效性评价[J].中国药学杂志,1999,34(8):541-543.
[2]戈升荣,安富荣,袁 静,等.国产与进口盐酸氨溴索片的人体生物等效性研究[J].上海第二医科大学学报,2002,22(1):26-28.
[3]吕宗杰,郑 永.盐酸氨溴索缓释片人体生物等效性研究[J].重庆医科大学学报,2009,34(11):1552-1555.
[4]陶宜富,莫 陵,肖大伟,等.盐酸氨溴索口腔崩解片人体生物等效性研究[J].临床药学,2008,19(5):341 -343.
[5]刘书铭,周远大.盐酸氨溴索口腔崩解片人体生物等效性研究[J].中国药房,2006,17(12):923 -925.
[6]徐红蓉,汪 红,陈伟力,等.氨溴索分散片在健康志愿者的药代动力学和生物等效性[J].中国临床药理学杂志,2002,22(3):180-183.
[7]薛洪源,杨汉煜,贺文涛,等.盐酸氨溴索口腔崩解片的生物等效性研究[J].医药导报,2010,29(1):27 -30.
[8]陈 琳,高 署,李俊杰,等.LC-MS/MS法测定人血浆中盐酸氨溴索颗粒浓度及生物等效性研究[J].江西医学院学报,2006,46(6):43-50.
[9]温预关,廖日房,尹惠标,等.盐酸氨溴索口崩片与普通片人体生物等效性比较[J].中国医院药学杂志,2007,27(3):293-296.
[10]HangTJ,ZhangM,SongM,etal.Simultaneousdetermination and pharmacokinetic study of roxithromycin and ambroxol hydrochloride in human plasma by LC-MS/MS[J].Clin Chim Acta,2007,382(1-2):20-24.
[11]Lee HJ,Joung SK,Kim YG,et al.Bioequivalence assessment of ambroxol tablet after a single oral dose administration to healthy male volunteers[J].Pharmacol Res,2004,49(1):93-98.

