急性呼吸窘迫综合征患者血乳酸定量分层的临床价值
饶惠清,莫北溪,黄道永
广东省阳江市人民医院ICU,广东阳江 529500
乳酸(LAC)是体内葡萄糖代谢产物之一,在正常状态下其产量不多,但当急性呼吸窘迫综合征(ARDS)患者存在组织缺氧时,造成机体无氧代谢产生大量的乳酸,导致乳酸性酸中毒。在病情得到有效控制、低氧状态等获得迅速纠正后,体内的乳酸可很快降低。因此通过乳酸定量分层可有效评估急性呼吸窘迫综合征患者的病情控制和预后。
1 资料与方法
1.1 一般资料
选择2008年7月~2010年1月入住我院中央ICU初步诊断为ARDS的104例患者 [除外其他乳酸产生过多疾病(如严重组织灌注不足、中毒)及乳酸清除不足疾病(如严重肝病、严重肾病、糖尿病等)]。ARDS的诊断根据中华医学会呼吸病学分会1999年制定的标准[1]。其中,男64例,女40例;平均年龄(46.05±26.24)岁;基础疾病:脓毒症31例,脑外伤 22例,肺炎17例,其他外伤10例,胸腹部外伤8例,胰腺炎7例,溺水6例,电解质紊乱3例。
1.2 方法
入室即抽血气分析。以后每6小时抽取1 ml动脉血做血气分析,根据48 h内乳酸值求和后取平均值定量分为四组:对照组[LAC(3.2±1.7)mmol/L];观察组 A[(7.1±2.1)mmol/L];观察组 B[(11.5±2.3)mmol/L];观察组 C[(15.8±2.0)mmol/L]。登记相应时间肺泡-动脉氧分压差[P(A-a)DO2]、氧合指数(PaO2/FiO2)。抽取动脉血时进行1次急性生理学和慢性健康状况评分系统Ⅱ(APACHEⅡ评分)。每12小时监测病情变化,并对1周内对照组与观察组各指标及病死率进行比较。血乳酸浓度的测定使用德国GEM Premier 3000自动分析仪。
1.3 统计学方法
采用SPSS 10.0统计软件进行分析,计量资料数据用均数±标准差()表示,对测定值采用单因素方差分析和Pearson相关性分析,计算相关系数r值,P<0.05为差异有统计学意义。
2 结果
2.1 乳酸定量与APACHEⅡ评分相关性
所有诊断为ARDS患者乳酸定量均较正常值不同程度增高,且乳酸定量与APACHEⅡ呈显著正相关(r=0.79,P<0.05)。 见图 1。

图1 乳酸定量与APACHEⅡ评分关系
2.2 乳酸定量与氧合指数的关系
乳酸定量与氧合指数呈显著负相关,乳酸定量值越高,氧合指数(PaO2/FiO2)下降幅度越大(r=-0.76,P<0.05)。 见图2。

图2 乳酸定量与氧合指数关系
2.3 乳酸定量与病死率的关系
乳酸定量与病死率呈正相关(r=0.78,P<0.05)。见表1。
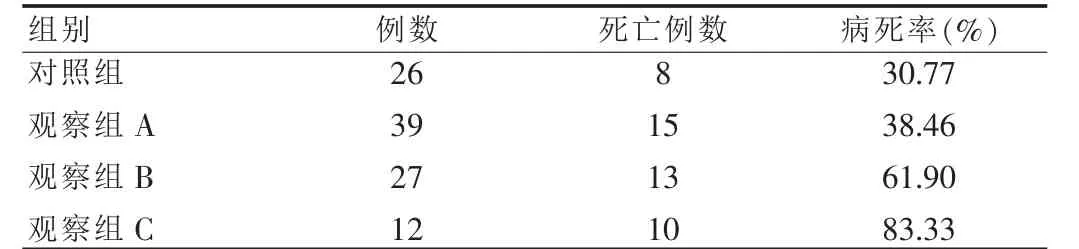
表1 四组患者1周内病死率比较(例)
3 讨论
ARDS的病因各异,治疗棘手,因肺组织换气功能严重受损,造成顽固性低氧,在机体严重缺氧时,全身各组织大量产生乳酸,造成酸中毒,导致体内代谢严重紊乱,危及生命。乳酸是体内葡萄糖代谢的产物之一,有氧的情况下,丙酮酸在一系列酶的作用下生成乙酰辅酶A进入三羧酸循环,一小部分丙酮酸转化为乳酸,其过程也是可逆的;当组织细胞缺氧时,糖的有氧化过程受限,三羧酸循环受阻,而无氧酵解的产能途径被激活,乳酸被大量生成,造成乳酸堆积。在ARDS的乳酸释放量可大于60 mmol/h,远超过正常状态下的释放量,且乳酸释放量与肺损伤程度呈显著正相关,其机制可能是炎症细胞和细胞因子促进糖酵解的过程[2]。在危重病得到有效控制、低氧状态等获得迅速纠正后,乳酸的清除率加快,体内的乳酸可很快降低。因此,测定体内的乳酸可准确提示危重病的控制情况,并对其预后作出有效评估。但是单次初始的乳酸并不一定能准确反映病情及预后,必须通过连续监测,取平均值,较单一时刻的对比有代表意义,当乳酸平均值高时,提示患者这段时间血乳酸处于较高水平,也就是乳酸清除率低。王东浩[3]分析了247例重度脓毒症患者的初始血乳酸浓度和入ICU 12 h后血乳酸清除率与最终转归关系,发现存活组与死亡组的初始乳酸浓度比较,差异无统计学意义 (P>0.05),但存活组的乳酸清除率明显高于死亡组,而高乳酸的持续时间明显短于死亡组。乳酸代谢受基础疾病、年龄、组织灌注等多方面影响,为避开这些影响因素,本研究所选病例已排除其他乳酸产生过多疾病(如严重组织灌注不足、中毒)及乳酸清除不足疾病(如严重肝病、严重肾病、糖尿病等),样本就有代表性。正常人血乳酸值为(1.0±0.5)mmol/L[4],当血乳酸值为 2.0~5.0 mmol/L时,则为高乳酸血症,>5.0 mmol/L时诊断为乳酸中毒。ARDS患者常有乳酸代谢紊乱,产生高乳酸血症,其发生机制为:①全身组织低灌注,组织细胞灌注不良必然导致细胞缺氧[5],这是乳酸增高的最主要的原因;②应激致高儿茶酚胺血症[6-7]。乳酸值反映了细胞水平能量代谢和各脏器功能状态相关,高乳酸血症是发展为多脏器功能障碍综合征(MODS)的危险因素。但单纯监测某一时刻的血乳酸不能准确反映机体的状况与疾病严重性,而动态监测血乳酸浓度可较准确地反映组织器官的缺血缺氧是否被有效纠正,可作为一个重要的评估预后的指标[8-9]。血乳酸浓度不仅反映机体缺氧严重程度,造成细胞生化代谢障碍,更为重要的是反映各个脏器功能失常的严重程度。研究表明,血乳酸水平持续升高与APACHEⅡ密切相关[10-12],机体乳酸值增高,APACHE II评分也相应增高,氧合指数下降,病死率相应增加。本文结果表明,对ARDS患者早期血乳酸水平的监测相当重要,对判断预后及指导治疗很有价值。高乳酸结合其他监测指标及临床情况进行综合判断,是一个简便、快速、有效的临床生化代谢指标,能够提醒临床医生对那些有着潜在危险的患者给予高度关注,及时处理病情变化。根据研究结果可以认为,血乳酸浓度与ARDS严重程度相关,是评估ARDS病情严重程度及病情转归的重要指标。
[1]陆再英,钟南山.内科学[M].7版.北京:人民卫生出版社,2008:153.
[2]姜利,席修明,骆辛,等.急性呼吸窘迫综合征患者肺乳酸释放的研究[J].中华结核和呼吸杂志,2004,27(1):64-65.
[3]王东浩.乳酸清除率评估重度脓毒症患者预后的临床分析[J].中国急救医学,2007,27(1):15-17.
[4]Fenrranti VS,Gauvreau K,Hickey PR,et al.Intra-operative hyperglycemia during infant cardiac surgery is not associated with adverse neurodevelopmental outcomes at l,4,and 8 years[J].Anesthesiology,2004,100(6):1345-1352.
[5]Foraythe SM,Schmidt CA.Soldium bicabonate for the treatment of lactic acidosis[J].Chest,2000,117(1):260-267.
[6]Bundgaard H,Kjeldsen K,Suarez K,et al.Endotoxemia stimulates skeletal muscle Na+-K+-ATPase and raises blood lacdate under aerobic conditions in humans[J].Am J Physiol Heart Circ Physiol,2003,284(3):1028-1034.
[7]Ensinger H,Lindner KH,Dirks B.Adrenaline:relationship between infusion rate,plasma concentration,metabolic and hemodynamic effects in volunteers[J].Eur J Anaesthesiol,1992,9(6):435-446.
[8]林爱华,郭凤梅.血管活性药物对感染性休克患者动脉血乳酸的影响[J].齐齐哈尔医学院学报,2005,26(8):888-889.
[9]张昆,李政霖,张芝晶.血乳酸和D-二聚体的测定对感染性休克的预后评估[J].中国当代医药,2010,17(30):66-67.
[10]李春胜.乳酸与危重病[J].急诊医学,1998,8(2):127-129.
[11]Bakker J,Gris P,Coffemils M,et al.Serial blood lactate levels can predict the development of multiple organ failure following sepsis shock[J].Am J Surg,1996,171(2):221-226.
[12]Cusack RJ,Rholdes A,Lochhead P,et al.The strong ion gap does not have prognostic value in critically ill patients in B mixed medical/surgical adult ICU[J].Intensive Care Med,2002,28(7):864-869.

