粘红酵母ATP:柠檬酸裂解酶基因的克隆表达和酶学性质
赵 检,王旭颖,王茂淋,郑世学,喻子牛,张吉斌
(华中农业大学 农业微生物学国家重点实验室 微生物农药国家工程研究中心,湖北 武汉 430070)
ATP:柠檬酸裂解酶(ATP:Citrate lyase,ACL,EC 2.3.3.8)广泛存在于藻类、植物和动物中,在少量的原核生物或古细菌中也会存在[1]。ATP:柠檬酸裂解酶是脂肪酸合成途径外的一个关键酶,能催化柠檬酸裂解生成乙酰辅酶A和草酰乙酸,从而完成脂肪酸辅酶A的合成。研究表明,当微生物油脂积累量超过其生物量的20%时都会具有ACL活性,但尚未发现不同酵母和真菌中油脂积累的程度和ACL的活性具有明确的定量关系[2]。
通过对真菌基因组序列的分析表明,大部分的真菌都存在acl基因,但是在酵母菌亚门[解脂耶氏酵母(Yarrowialipolytica)除外]中却明显地缺失了。在一些酵母和霉菌中ACL是由两个基因编码的,这两个基因是分开存在的,有的存在于两个不同的染色体上,有的存在于同一染色体上不同的位置,并且它们编码的方向也会存在差异,而在另外一些真菌和哺乳动物体内ACL却是由一个基因编码的[3]。不同菌种的ACL蛋白的结构也不尽相同,Shashi等[4]从瘦弱红酵母(Rhodotorulagracilis)中提取纯化了ACL蛋白,研究表明该酶分子量为520 kDa,由4个120 kDa大小的亚基组成。Adams等[5]从构巢曲霉(Aspergillusnidulans)中纯化了ACL蛋白,该酶是一种六聚体结构,由3个70 kDa和3个55 kDa的亚基蛋白组成。
有关acl基因的克隆研究最早始于1990年,Elshourbagy等[6]首次克隆了动物体内的acl基因。为了了解原核生物ACL分子水平的作用机制,Kanao等[7]对细菌的ACL作用机制进行了酶动力学研究,确定了磷酸化作用位点、活性抑制剂等因素。所有原核、真菌、哺乳动物和植物等的acl基因序列都包含几个高度的保守区,这些保守区都是ACL起催化作用的位点,如ATP-、CoA-、草酰乙酸盐结合位点以及柠檬酸合成酶作用位点等。Kim等[8]从绿硫菌(Chlorobiumtepidum)中克隆得到了编码ACL两个亚基的基因,并且将其分别在大肠杆菌E.coliBL21 (DE3)中进行了表达和酶活分析,结果表明两个亚基对全酶的催化活性都起着重要的作用。目前还没有克隆表达产油微生物acl基因的报道,因此,筛选分离出产油微生物的acl基因,利用基因工程实现对其表达量的调控,提高酶活性,进而提高微生物甚至是油料作物的产油能力,成为了新的研究热点。
作者从高产油粘红酵母中克隆ATP:柠檬酸裂解酶基因的两个亚基基因acl1和acl2,在毕赤酵母中进行诱导表达和酶活验证,以获取更高的ACL酶活力,并对其酶学特性进行了研究,为提高油料作物油脂含量提供了新的转基因材料。
1 实验
1.1 材料与试剂
粘红酵母 (Rhodotorulaglutinis)31596,中国农业科学院油料作物研究所;PichiapastorisGS115,自行保藏;pPICZαA表达载体由国家海洋局第三海洋研究所惠赠;pMD18-T,Takara公司。
E.Z.N.A.TMYeast RNA Kit,Omega公司;AxyPrepTMDNA Gel Extraction Kit、AxyPrepTMPCR Cleanup Kit,Axygen公司;RevertAidTMFirst Strand cDNA Synthesis Kit,Fermentas公司;T4 DNA连接酶及限制性内切酶(EcoRⅠ、XbaⅠ、KpnⅠ和PmeⅠ)、 Ex TaqTMPolymerase、RNase A,Takara公司。
1.2 方法
1.2.1 RNA的提取
首先将甘油管内保存的粘红酵母划线至YPD平板上长出二代单菌落,然后挑取单菌落接种到YPD液体培养基中28 ℃培养过夜,待菌体长到一定浓度(OD600≈1.2)后,离心收集菌体,采用E.Z.N.A.TMYeast RNA Kit试剂盒提取总RNA,具体操作见试剂盒说明书。将提取好的RNA进行0.8%的琼脂糖凝胶电泳检测,然后于-80 ℃保存。
1.2.2acl1和acl2基因的扩增
根据在NCBI中查找的和粘红酵母亲缘关系最近且同为油脂酵母的模式菌解脂耶氏酵母 (Yarrowialipolytica)CLIB122的acl基因的两个亚基acl1 (CR382131.1)和acl2 (CR382130.1) 的序列(分析表明均无内含子),分别设计带有酶切位点的特异性引物:ACL1-F/ACL1-R和ACL2-F/ACL2-R,引物序列见表1,引物由上海英骏公司合成。

表1 实验所需引物
以提取的粘红酵母RNA为模板进行反转录PCR,按照试剂盒说明书进行操作,第二轮PCR体系为:94 ℃变性5 min;94 ℃变性45 s,55 ℃退火45 s,72 ℃延伸90 s,30个循环;72 ℃保温10 min。将扩增得到的目的基因片段送上海英骏公司进行测序验证。
1.2.3 重组质粒pPICZαA-acl1和pPICZαA-acl2的构建
将扩增得到的acl1基因片段和pPICZαA载体分别用EcoRⅠ和XbaⅠ双酶切,acl2基因片段和pPICZαA载体分别用EcoRⅠ和KpnⅠ双酶切,然后回收目的片段分别进行连接,得到重组质粒pPICZαA-acl1和pPICZαA-acl2。
1.2.4 电转化毕赤酵母GS115
将构建好的重组载体pPICZαA-acl1和pPICZαA-acl2分别用PmeI线性化,然后将10~20 μL线性化质粒分别加入到80 μL毕赤酵母GS115感受态细胞中,混匀后冰上静置5 min,放入0.2 cm电转杯电转(电转参数:2.0 kV)约5 ms,然后立即加入1 mL冰浴的山梨醇,30 ℃静置1 h,最后取100 μL转化液,涂布YPDS (300 μg·mL-1Zeocin)平板,将YPDS板置于30 ℃培养箱中培养2~3 d,直至长出菌落。挑取单菌落,进行菌落PCR验证,琼脂糖凝胶电泳分析结果。
1.2.5 目的蛋白的诱导表达和纯化
筛选出阳性克隆子后,先对其进行小量甲醇诱导表达,SDS-PAGE检测表达情况,具体操作步骤如下:挑取YPDS平板上的阳性单克隆接种于50 mL BMGY培养基中,30 ℃、摇床培养2~3 d;收集培养液,4 ℃、8000 r·min-1离心15 min,取沉淀(尽量将上清除尽),向其中加入40 mL含有0.5%甲醇的BMMY培养基,重新在30 ℃诱导培养;为补偿甲醇的挥发损失,每24 h补加甲醇,使菌液中的甲醇浓度保持在0.5%;每隔24 h取样,4 ℃、8000 r·min-1离心15 min,收集菌体,SDS-PAGE检测蛋白;诱导4~5 d后,4℃、8000 r·min-1离心15 min,收集菌体,SDS-PAGE检测蛋白。然后大量表达目的蛋白,表达产物用金属(Ni2+)螯合琼脂糖凝胶柱进行纯化,收集的纯化产物分别以紫外分光光度法和SDS-PAGE测定蛋白浓度和纯度。
1.2.6 酶活分析
ACL活性的测定采用传统方法:苹果酸脱氢酶偶联法[9]。通过实时测定NADH在340 nm处吸光度的减少,确定ACL相对酶活性。
2 结果和讨论
2.1 全长基因的克隆及序列分析
以粘红酵母RNA为模板通过RT-PCR扩增得到acl基因的两个亚基,经0.8%的琼脂糖凝胶电泳检测,所得产物大小分别约为2.0 kb (acl1) 和1.5 kb (acl2)(图1)。扩增得到的产物测序,将序列结果提交NCBI通过Blast分析比对,所扩增的acl1基因片段与GenBank中登录的YarrowialipolyticaCLIB122 (CR382131.1)、AspergillusnigerCBS (001394018.2)、Penicilliumchrysogenum(AM920436.1)的DNA序列中的acl1基因序列同源性分别为100%、92%、73%,acl2基因片段与GenBank中登录的YarrowialipolyticaCLIB122 (CR382130.1)、AspergillusnigerCBS(XM 001394020.2)、Magnaportheoryzae(XM 370223.1)的DNA序列中的acl2基因序列同源性分别为100%、76%、69%,表明已成功扩增获得粘红酵母的acl1和acl2基因序列。通过软件分析表明,acl1基因序列长1953 bp,不含内含子,理论蛋白分子量为71 kDa,等电点为8.0;acl2基因序列长1494 bp,不含内含子,理论蛋白分子量为54 kDa,等电点为5.6。
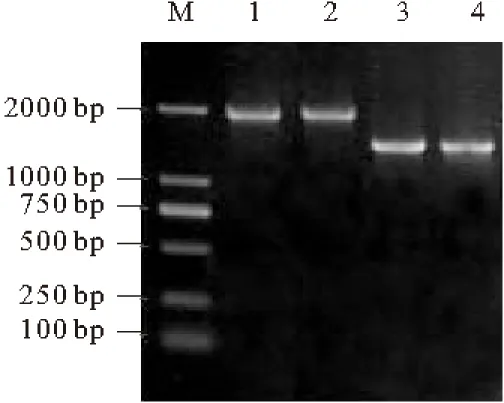
M. DNA Marker 1,2.粘红酵母acl1 3,4.粘红酵母acl2
2.2 重组载体pPICZαA-acl1和pPICZαA-acl2的构建和鉴定
重组载体的构建如图2所示。将重组载体pPICZαA-acl1用EcoRⅠ和XbaⅠ双酶切、pPICZαA-acl2用EcoRⅠ和KpnⅠ双酶切,0.8%琼脂糖凝胶电泳分析结果如图3所示。

图2 重组载体pPICZαA-acl1和pPICZαA-acl2的构建
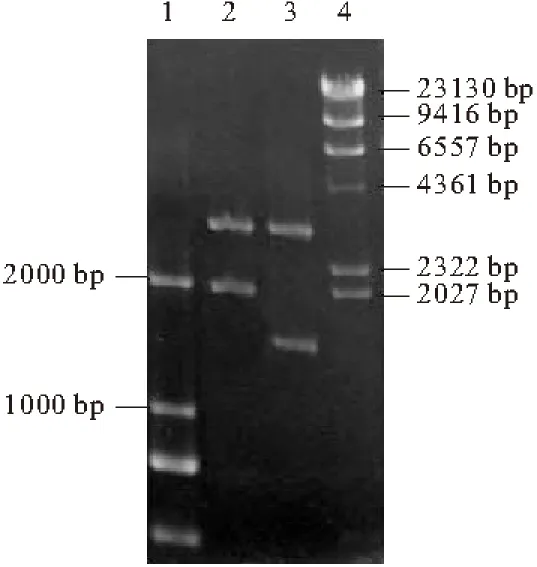
1,4. DNA Marker 2. Eco RⅠ和XbaⅠ双酶切pPICZαA-acl1
由图3可知,pPICZαA-acl1经双酶切产生约2.0 kb和3.5 kb的条带,pPICZαA-acl2经双酶切产生约1.5 kb和3.5 kb的条带,与预期相符。对重组子的目的片段进行测序验证,读码框完全正确,不存在突变位点。
2.3 重组蛋白的纯化
对纯化产物进行SDS-PAGE分析,结果见图4。
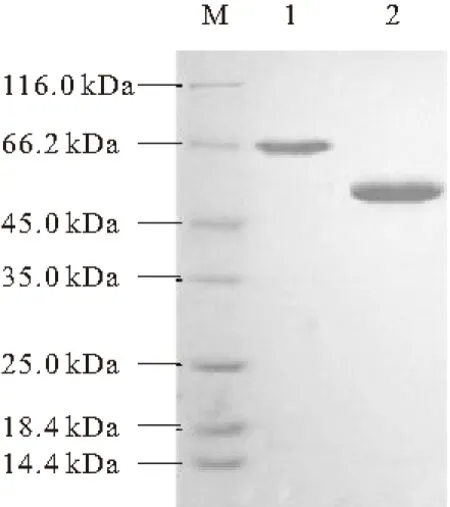
M.蛋白 Marker 1.纯化的ACL1蛋白 2.纯化的ACL2蛋白
由图4可知,两个亚基蛋白ACL1和ACL2的分子量分别约为66 kDa和55 kDa。纯化后的ACL1和ACL2亚基蛋白的浓度分别达到1.34 mg·mL-1和1.6 mg·mL-1,可用于后续实验操作。
2.4 酶活检测及最佳酶反应条件的确定
分别对粘红酵母的单个亚基的酶比活力进行了测定,结果见图5。
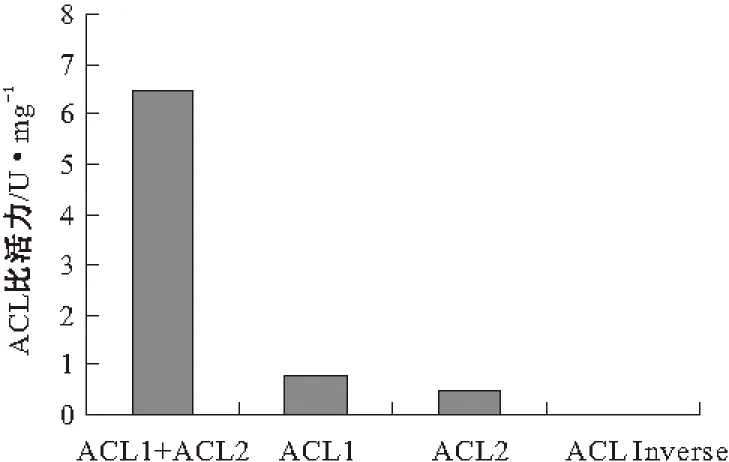
图5 ACL全酶和各亚基的酶比活力
由图5可知,单个亚基进行酶活测定时的酶比活力不到1.0 U·mg-1,说明全酶要发挥最大作用,就必须将其两个亚基所含有的所有催化作用位点都聚齐,缺失一个都会严重影响其酶活力。
粘红酵母的ACL1和ACL2不同质量比混合对酶比活力的影响见图6。

m(ACL1)∶m(ACL2)
由图6可知,ACL1和ACL2质量比在1∶1混合时全酶的比活力达到最大,为6.5 U·mg-1,比原始酵母提高了近10%。
将两种亚基按照最佳质量比混合,保证一定浓度,分别考察酶反应的pH值、反应温度和反应时间对全酶酶比活力的影响,结果见图7。

图7 反应条件对全酶酶比活力的影响
由图7可知,全酶的最佳反应pH值为8.5(图7a),偏酸或者偏碱都会影响酶活力;最佳反应温度约为37 ℃(图7b),过高的温度会降低酶活力,说明该酶不耐高温,保存的时候需要超低温保存且时间不宜过长;最佳反应时间约为10 min(图7c),适当延长反应时间对酶活力的影响很小。
2.5 讨论
多数报道选用细菌来源的基因,表达后的ACL蛋白酶活力都比较低,如Kanao等[10]从泥生绿菌(Chlorobiumlimicola)中克隆得到aclBA进行大肠杆菌表达,表达后蛋白的酶比活力为3.5 U·mg-1。Langlade等[11]从植物白羽扇豆(Lupinusalbus)中克隆得到aclA和aclB,并分别进行了酵母表达,表达后蛋白的酶比活力为5.3 U·mg-1。目前还没有克隆表达产油微生物acl基因的报道。本研究采用粘红酵母作为基因克隆材料,成功克隆出acl基因,在毕赤酵母(本身不存在acl基因[12])中进行诱导表达后,ACL蛋白的酶比活力最高达6.5 U·mg-1,比在粘红酵母本身(比活力为5.88 U·mg-1[4])提高了近10%。结果还表明,表达后的粘红酵母ACL酶反应的最佳条件不同于酵母的正常生长环境,且全酶要发挥最大的酶活力,其两个亚基蛋白缺一不可。
总之,可以利用基因工程来对粘红酵母这类油脂酵母的acl基因表达量进行调控,并提高ACL酶活力。ACL活性的提高可能增加油菜菜籽中的油酸含量[13],因此,油脂酵母可提供新的基因资源,并应用于后续的转基因植物,从而提高油料作物的油脂含量。
3 结论
从粘红酵母(Rhodotorulaglutinis)中克隆得到ATP:柠檬酸裂解酶基因两个亚基acl1和acl2,转化毕赤酵母(Pichiapastoris) GS115进行诱导表达,通过Ni柱纯化目的蛋白,以实时波长扫描对重组蛋白的酶学性质进行测定分析。SDS-PAGE分析表明,两个亚基ACL1和ACL2的分子量分别为66 kDa和55 kDa。重组蛋白的酶学测定表明:经毕赤酵母表达后,单个亚基酶活性不到1.0 U·mg-1,双亚基混合后具有较高的酶活性,当混合质量比为1∶1时全酶的酶比活力达到最大,为6.5 U·mg-1,酶反应的最佳条件为:pH值8.5、37 ℃反应10 min。为提高油料作物油脂含量提供了新的转基因材料。
[1] Hynes M J,Murray S L. ATP-Citrate lyase is required for the production of cytosolic acetyl-CoA and development inAspergillusnidulans[J]. Eukaryotic Cell,2010,9(7):1039-1048.
[2] 刘波,孙艳,刘永红,等.产油微生物油脂生物合成与代谢调控研究进展[J].微生物学报,2005,45(1):153-156.
[3] Nowrousian M,Kück U,Loser K,et al. The fungalacl1 andacl2 genes encode two polypeptides with homology to the N- and C-terminal parts of the animal ATP-citrate lyase polypeptide[J]. Current Genetics,2000,37(3):189-193.
[4] Shashi K,Bachhawat A K,Joseph R. ATP:Citrate lyase ofRhodotorulagracilis:Purification and properties[J]. Biochimica et Biophysica Acta,1990,1033(1):23-30.
[5] Adams I P,Dack S,Dickinson F M,et al. The distinctiveness of ATP:citrate lyase fromAspergillusnidulans[J]. Biochimica et Biophysica Acta,2002,1597(1):36-41.
[6] Elshourbagy N A,Near J C,Kmetz P J,et al. Cloning and expression of a human ATP-Citrate lyase cDNA[J]. European Journal of Biochemistry,1992,204(2):491-499.
[7] Kanao T,Fukui T,Atomi H,et al. Kinetic and biochemical analyses on the reaction mechanism of a bacterial ATP-Citrate lyase[J]. European Journal of Biochemistry,2002,269(14):3409-3416.
[8] Kim W,Tabita F R. Both subunits of ATP-citrate lyase fromChlorobiumtepidumcontribute to catalytic activity[J]. Journal of Bacterioligy,2006,188(18):6544-6552.
[9] Takeda Y,Suzuki F,Inoue H. ATP citrate lyase (citrate-cleavage enzyme)[J]. Methods in Enzymology,2003,1969(13):153-160.
[10] Kanao T,Fukui T,Atomi H,et al. ATP-citrate lyase from the green sulfur bacteriumChlorobiumlimicolais a heteromeric enzyme composed of two distinct gene products[J]. European Journal of Biochemistry,2001,268(6):1670-1678.
[11] Langlade N B,Messerli G,Weisskopf L,et al. ATP-Citrate lyase:Cloning,heterologous expression and possible implication in root organic acid metabolism and excretion[J]. Plant,Cell and Environment,2002,25(11):1561-1569.
[12] Chāvez-Cabrera C,Flores-Bustamante Z R,Marsch R,et al. ATP-Citrate lyase activity and carotenoid production in batch cultures ofPhaffiarhodozymaunder nitrogen-limited and nonlimited conditions[J]. Applied Microbiology and Biotechnology,2010,85:1953-1960.
[13] 王树源,陈健美,戚维聪,等.双低油菜品系含油量与 ACL酶活性的相关性分析[J].中国油料作物学报,2009,31(3):279-284.

