基因芯片法监测粤东地区妇女人乳头瘤病毒①
方裕森, 肖亮生, 翁雪芬, 林美珊
(1.汕头大学医学院附属肿瘤医院检验科, 广东 汕头 515031 2.广东省汕头市中心医院检验科, 广东 汕头 515031 3.汕头大学医学院第二附属医院检验科, 广东 汕头 515041)
宫颈癌与人乳头瘤病毒HPV(Human papiloma virus)感染密切相关,从宫颈上皮不典型增生到浸润癌是一个持续发生、发展过程,大约需10年时间。HPV感染是一种广泛流行性性传播疾病,具有很强的地域性,同时也因为检测方法及受检人群不同而显示不同感染率及感染类型。本研究采用HPV-DNA芯片技术,对粤东地区妇女HPV感染率及其亚型的分布的调查,较准确反映本地区感染率及其型别的分布,有利于建立和完善粤东地区妇女的HPV监测体系;能及早发现高危人群,制定定期筛查时间;有利于早期诊断,以便对癌前病变积极处理 ,阻断病程进展,预防子宫颈癌(特别是浸润癌)的发生。宫颈癌发生的必要条件是高危型HPV的持续感染,至今已经分离鉴定出超过200种HPV病毒的亚型,其中有20多种可感染生殖道上皮。文献报道HPV病毒感染与70%的浸润性宫颈癌有关,以HPV16型和HPV18型最常见。现代医学通过研究已经确认,HPV阴性者几乎不会发生宫颈癌;99.8%的宫颈癌患者中可以检测到不同型别的HPV-DNA。子宫颈癌是目前所有癌症中,唯一病因明确、能有效预防、早期及时发现、并且能早期治疗的癌症。本文旨在通过用基因芯片了解粤东地区妇女HPV感染率及亚型分布情况,有利于建立和完善粤东地区妇女的HPV监测体系也为宫颈癌疫苗的研发提供数据。
1 资料与方法
1.1 研究对象:2009年4月至2010年5月,年龄16-80周岁,在广东省汕头市中心医院就诊的2122例妇女;在广东省汕头大学医学院附属第二医院就诊的1182例妇女(包括汕头大学医学院附属肿瘤医院28例),剔除二次复查的数据。
1.2 样本采集:分别用广东凯普生物科技有限公司及亚能生物公司提供的专用HPV取样器,插入子宫颈外口,顺时针或逆时针转动5圈,慢慢取出取样器放入含有保存液的小瓶中,粘贴患者条码,随后送实验室保存于4℃冰箱中,一周内完成检测。
1.3 检测方法
1.3.1 凯普试剂:采用凯普人乳头状瘤病毒核酸扩增分型检测试剂盒进行HPV-DNA分型检测,以导流杂交技术(HybriMax)平台,一次可以检测共21种HPV基因型;包括 14种高危型:HPV16、HPV18、HPV31、HPV33、HPV35、HPV39、HPV45、HPV51、HPV52、HPV56、HPV58、HPV59、HPV66、HPV68 等;7种低危型:HPV6、HPV11、HPV42、HPV43、HPV44、HPV 53和HPVcp8304等。实验操作与结果判断严格按试剂盒要求进行:①样本DNA分离提取:吸取细胞悬液样本500-800μL,离心1 min(14000 rpm)吸弃上清,然后按照DNA提取试剂盒的步骤提取DNA。②PCR扩增:采用PE 9600进行PCR扩增。反应条件为预处理:20℃10min;DNA变性:95℃ 9 min;扩增40个循环:95℃20 s→55℃30s→72℃30 s;延伸 5min :72℃。③核酸分子快速导流杂交:取PCR产物加入检测孔内(95℃变性9 min→冰浴2 min);导流杂交(10min);封闭(封阻液);酶标显色。④结果判断:肉眼观察,按芯片上HPV亚型分布相应着色点位判断结果,阳性点呈蓝紫色圆点,有两个及两个以上圆点阳性属多重感染。⑤质控:每次实验必须具备反应质控点、杂交显色质控点、阳性对照点和阴性对照点同时在控;每张芯片设有反应质控点和杂交显色质控点各一个。
1.3.2 亚能试剂
1.3.2.1 检验方法:①提取 HPV -DNA:充分洗脱宫颈刷,并在管壁上挤干。把1mL洗脱液全部转移到1.5mL离心管中,离心10min(13000rpm),弃去上清液,保留管底的细胞沉淀。加入裂解液(50uL)悬浮沉淀,沸水浴加热10min,离心10min(13000rpm),保留上清液待用。②PCR扩增:在PCR反应管盖上做好标记,低速离心数秒,分别加入已提取的待测样本DNA 5uL,反应总体系为25uL,最后加入1滴矿物油,低速离心数秒。每次实验可设置一个阴性质控和一个阳性质控,作为产品使用的质量控制。③杂交:取15mL塑料离心管,放入标有样本编号的膜条,加入A液(5-6mL)及所有(25uL)的PCR产物;为避免加热时管盖爆开,应将管盖拧紧,再将管盖稍拧松;将离心管放入沸水浴中加热10min,取出,拧紧管盖,放入杂交箱51℃ 杂交至少1.5h。取50mL塑料离心管,加入B液(50mL),于杂交箱或水浴箱中预热至51℃。阴性质控品和阳性质控品同步处理。④洗膜:取出膜条,移至装有预热B液的50mL离心管中,于51℃ 轻摇洗涤5min。⑤显色:按A液:POD=2000:1配制孵育液,室温轻摇孵育液30min,弃去孵育液。用A液室温轻摇洗两次,每次5min。用C液室温洗膜1-2min,用时配置显色液。将膜条浸泡于显色液中避光显色至少30min后,移至去离子水中浸泡即可观察结果。
1.3.2.2 结果判定:实验结果有效的前提:实验每张膜条在PC位点必须出现蓝色显色信号;阴性质控品除PC位点出现显色信号外其余位点均不出现显色信号;阳性质控品除PC位点出现显色信号外,必须在相应HPV基因型位点出现显色信号。
2 结果
2.1 在中心医院2122例筛查样本中,阳性样本523例,总阳性率为24.7%;前十种分型检出率见表1。
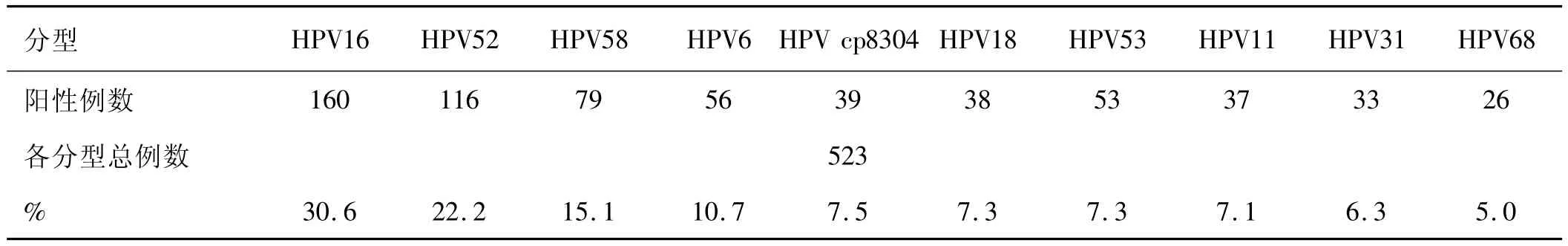
表1 中心医院523例阳性样本中各分型比例
2.2 在附二院1182例筛查样本中,阳性样本351例,总阳性率为29.7%;前十种分型检出率见表2。
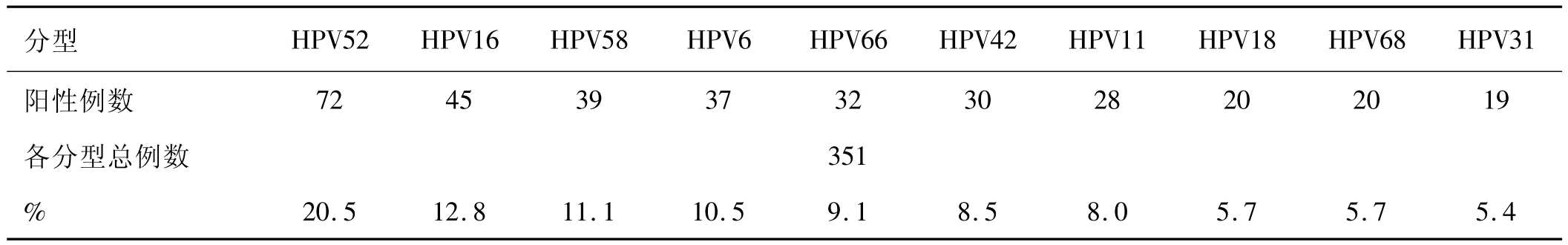
表2 附二院351例阳性样本中各分型比例
2.3 联合统计前三种分型检出率依次分别为:HPV16(205/874)、HPV 52(188/874)、HPV 58(118/874);分别占阳性样本的比例为:23.5%、21.5%、13.5%。
3 讨论
HPV是一种小的双链DNA病毒,在不同国家、地区HPV感染率及其型别存在差异,与尖锐湿疣、宫颈癌相关的型别也不尽相同。HPV感染率及其型别检测可提高子宫颈癌前病变筛查的敏感性。有研究表明宫颈癌是仅次于乳腺癌的第二位妇女常见恶性肿瘤,高危型HPV的持续感染是诱发宫颈癌的主要病因,宫颈HPV感染若不及时治疗,约30%患者可发展为宫颈上皮内瘤样病变(CIN),CIN作为癌前病变,有20%可发展为宫颈癌。
肖亮生等对粤东地区妇女人乳头瘤病毒的筛查与分析,总阳性率为 24.7%[1]。
本文筛查结果显示,粤东地区妇女人乳头瘤病毒的主要高危亚型HPV是HPV16、HPV52、HPV58,感染率分别为 23.5%、21.5%、13.5%,这与国内有些地区报道以HPV16型最常见,其次为18型等有所不同,提示HPV的地域感染的差异性。
在宫颈癌患者中,Ferrera A[2]等的国内外报道主要感染亚型是HPV16和HPV18亚型。
人乳头瘤病毒是一种嗜上皮性病毒,性接触是其传播的主要途经;HPV感染多为短暂性感染,大多数在2年内消失,自然清除时间约为7 -12个月[3]。
目前现已上市的 HPV预防疫苗具有“型特异性”,仅对预防HPV-16和18型2种高危型的HPV感染有效。而不同HPV亚型对不同种族人群致癌性的强弱也明显不同。而HPV型别分布存在明显的地区差异,国内外的研究指出,宫颈癌发病率和HPV感染率存在着地区差异,在同一国家内地区的分布也有所不同[4]。我国目前尚缺乏系统的、全面的、科学的HPV型别地区分布情况数据,HPV型别检测可为我国的HPV疫苗研究提供数据资料,对我国预防性宫颈癌疫苗的研发有指导作用[5]。
明确一个地区HPV流行的主要型别,对于评估患者预后,指导临床制定合理的治疗方案也具有重要意义。本文筛查结果对建立和完善粤东地区妇女的HPV监测体系有重要意义。随着各种普查的开展,高危型HPV型别检测率的提高,以及HPV疫苗的问世,对宫颈癌的防治有重要意义。
[1]肖亮生,陈乐川,郑映玉,等.粤东地区妇女人乳头瘤病毒的筛查与分析[J].广东医学,2010,31(14):1848-1849.
[2]Ferrera A ,Velema J P,Figueroa M ,et al.Human papillomavirus infection,cervical dysplasia and invasive cervical cancer in Honduras:a case - control study[J].Int Cancer,1999,82(6) :7991.
[3]刘筑玉,李建梅,范燕红,等.432例HPV检测结果和宫颈病变的关系分析[J].中国妇幼保健,2009,24(14),1919-1920.
[4]钱建华,谢幸,叶大风.子宫颈HPV感染的流行病学特征[J].中华妇产科杂志,2003,38(11) :712.
[5]王晓静,刘玉玲.HPV分型检测在宫颈癌前病变筛查中的应用价值[J].医药论坛杂志,2008,29(7):29 -30.

