La-CdS/TiO2光催化剂的制备及表征*
高洪涛,刘园园
(1.济宁学院化学与化工系,山东 曲阜 273155;2.青岛科技大学生态化工教育部重点实验室,山东 青岛 266042)
对TiO2进行改性以拓宽其光响应范围、提高其光催化效率已经成为近年来光催化领域的研究热点[1-2]。TiO2的改性技术主要有掺杂、贵金属沉积、染料敏化、半导体复合等[3-8]。单一改性技术对TiO2的光催化活性提高有限,如果同时使用两种及以上改性技术对TiO2进行改性,既可减少载流子复合,又能扩展光谱响应范围,而关于这类研究鲜见报道。
禁带宽度为2.4 eV,激发波长低于495 nm的CdS在吸收太阳光方面具有明显的优势,采用CdS对TiO2进行复合修饰,不仅能够充分利用TiO2的稳定性好与CdS禁带宽度窄的优势,而且可以有效克服TiO2可见光响应率低和CdS稳定性差的缺点;稀土元素掺杂可在TiO2半导体中形成浅势捕获阱,有效地降低光生载流子的复合率,提高了TiO2的光催化活性[9-10]。因此,研究La掺杂、CdS复合改性提高TiO2的光催化活性,对光催化材料的设计和制备具有重要意义,可为TiO2光催化材料的工业化应用提供实验和理论依据。
本文采用水热法制备了La掺杂CdS复合TiO2光催化剂,利用扫描电镜(SEM)、X射线衍射(XRD)、紫外漫反射光谱(UV-vis DRS)对产物进行了表征,并以甲基橙为目标降解物考察其光催化性能。
1 实验部分
1.1 乙基黄原酸镉的制备
取0.02 mol(3.206 g)的乙基黄原酸钾溶于40 mL去离子水中,搅拌中缓缓滴加0.10 mol/L乙酸镉100 mL,有白色沉淀生成,充分搅拌30 min,过滤,滤渣转移至烧杯中。加入乙醇与去离子水(体积比为1∶3)的溶液搅拌30 min,再过滤,重复3次,既得较为纯净的乙基黄原酸镉。
1.2 催化剂的制备
钛酸丁酯和异丙醇按一定比例加入250 mL圆底烧瓶中,缓慢加入二次水200 mL (乙酸调至pH=2.0),搅拌至溶液澄清透明得溶液A;将A溶液分成4份,其中的3份按一定比例分别加入硝酸镧、乙基黄原酸镉、硝酸镧和乙基黄原酸镉,另一份不加任何掺杂剂,搅拌12 h后,分别装入反应釜中,120 ℃下恒温24 h。
将在釜中得到的沉淀用乙醇洗至pH=7,在70 ℃的真空干燥箱中烘干、研细;然后,放入箱式电阻炉中,在空气中450 ℃灼烧2 h;将煅烧所得样品用研钵研磨,即得La-TiO2、CdS/TiO2、La-CdS/TiO2和纯TiO2光催化剂。
1.3 催化剂的表征
采用SEM对样品的晶体形貌进行表征;采用D/max-rA型X射线衍射仪(RIGAKU, JAPAN)对产品进行结构和物相分析;采用紫外-可见漫反射光谱(UV-Vis DRS)测试样品在不同波长下的光吸收性能;采用紫外-可见分光光度计(Cary50,VARIAN)测定甲基橙溶液的吸光度。
1.4 光催化性能的测定
分别取0.500 g制备的TiO2光催化剂,加入装有500 mL浓度为20 mg/L的甲基橙溶液,在SGY-I型多功能光化学反应仪中,避光搅拌30 min,使催化剂颗粒悬浮并分散均匀,并使甲基橙在催化剂表面预吸附完全。开启300 W高压汞灯,每隔一定时间取样5 mL,离心后用0.45 μm针头式过滤器除去TiO2颗粒,选择最大吸收波长465 nm测定滤液的吸光度。
2 结果与讨论
2.1 样品形貌
样品的SEM如图1所示。由图可知,纯TiO2呈颗粒状,粒径分布极不均匀且团聚较严重;样品b,CdS/TiO2颗粒呈球形,颗粒大小比较均匀,但略有团聚;样品c,La-TiO2颗粒呈棒状,且分散较蓬松,但大小分布不均;样品d为La-CdS/TiO2,从图中可看出,样品颗粒也呈棒状,分散蓬松且大小均匀,有利于吸附底物甲基橙,增大二者之间的接触面积,进而提高光催化反应的效率。

图1 TiO2光催化剂的SEM图
2.2 XRD表征
在450 ℃时煅烧得到的各样品的XRD谱图见图2。由图2可知,样品都在2θ=25.4°、37.8°和48.1°等附近出现锐钛矿相的特征峰,说明它们的晶型均为锐钛矿型。与未掺杂TiO2相比,掺杂后样品的峰高都明显降低,这说明掺杂剂的加入严重影响了TiO2的结晶度。其中,La-TiO2的影响最大,这可能是由于La3+半径(0.115 nm)与Ti4+半径(0.068 nm)相差较大,难以进入TiO2晶格中,形成的La的氧化物高度分散于TiO2中,阻碍了TiO2晶型生长。而这些弥散在TiO2表面的La2O3能形成空间电荷层,有效地阻止电子和空穴的复合,延长光生载流子的寿命,从而提高了TiO2的光催化活性。但由于La掺杂量太少并且晶型不完整,所以在样品La-TiO2和La-CdS/TiO2中均未观察到La2O3的衍射峰。而在La-CdS/TiO2XRD谱图中,不仅未出现明显的CdS特征衍射峰,且其中的TiO2衍射峰强度也比较低,峰形略有宽化,说明CdS的复合有效阻碍了TiO2纳米颗粒的团聚。但由于复合量比较少,且制备过程的温度较低,复合体中的CdS主要呈无定形态。
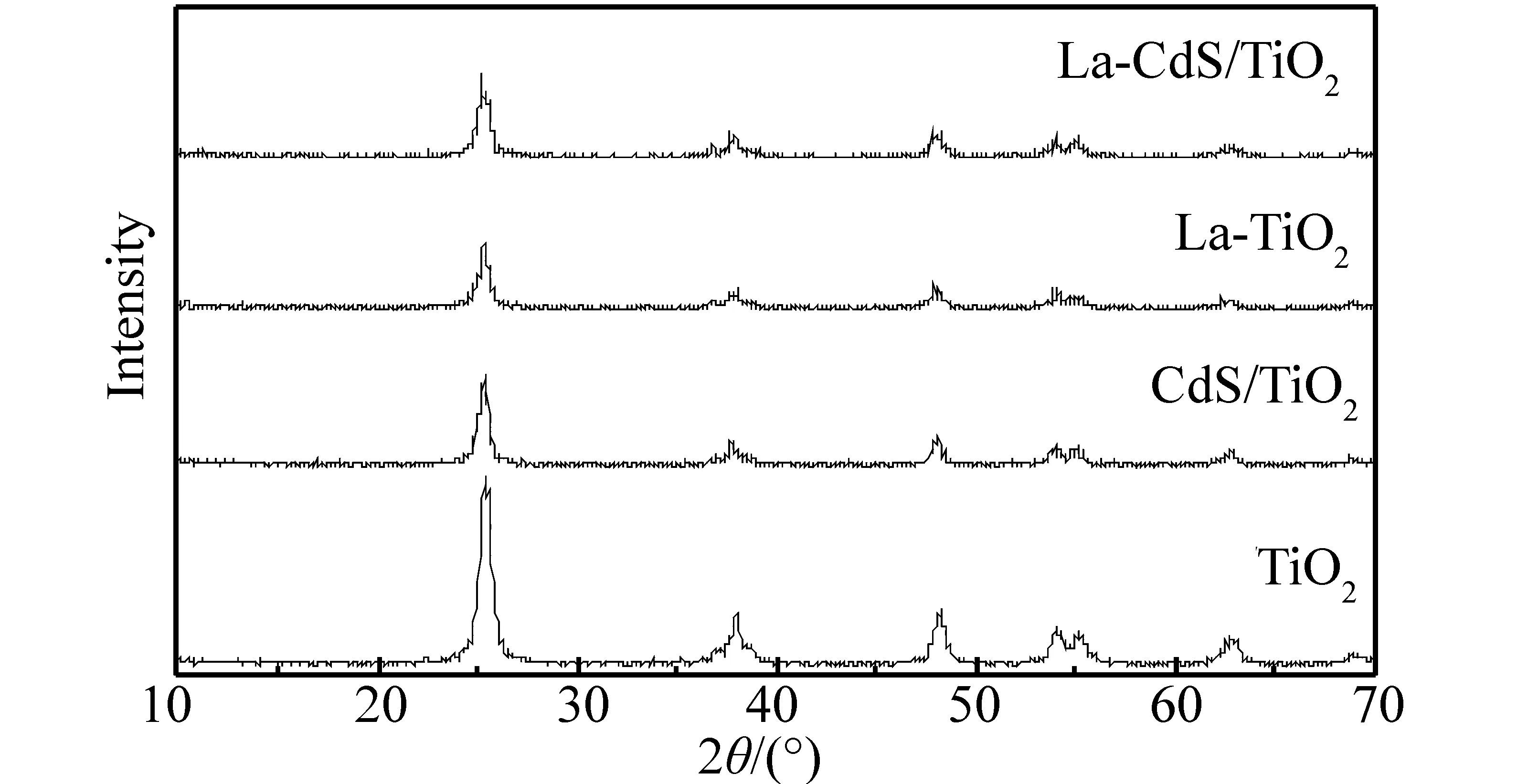
图2 450 ℃煅烧得到的光催化剂的XRD图
2.3 DRS表征
各样品的紫外-可见漫反射光谱见图3。与纯TiO2相比,La-TiO2、CdS/TiO2和La-CdS/TiO2的光响应强度显著增强,而且吸收边带表现出不同程度红移,光响应范围向可见光区拓展。其吸收边波长及禁带宽度列于表2。由表可知,与纯TiO2相比,La-TiO2、CdS/TiO2和La-CdS/TiO2禁带宽度分别减小了0.1、0.21和0.33 eV,对应红移量分别为15、30和49 nm,其中La-CdS/TiO2的红移量最大。其原因可能是禁带宽度较窄的CdS与稳定性好的TiO2复合后,两种半导体的导带、价带、禁带宽度不一致而使二者发生交迭;同时,加上具有f闭壳层的La在高温高压下对TiO2具有不同的作用,导致在TiO2的价带与导带之间形成杂质能带,进而减小了TiO2禁带宽度,使得其吸收边带向可见光区移动,提高了催化剂光催化活性。因此,在保证光催化材料稳定性的前提下,La-CdS/TiO2在较低能量光的激发下可产生更多的光生电子-空穴对,具有更高的光催化活性。
2.4 光催化活性表征
450 ℃煅烧所得产物对甲基橙的降解率曲线如图4所示。由图可见,不加任何光催化剂时,光照50 min后甲基橙的降解率仅为19%,说明光对甲基橙的分解能力很小。加入光催化剂后,其降解率大大提高。纯TiO2、La-TiO2、CdS/TiO2和La-CdS/TiO2光降解率依次增大,光照10 min后,未掺杂TiO2、La-TiO2和CdS/TiO2对MO的降解率分别为68%、75%和85%,而La-CdS/TiO2对MO的降解率可达93%;光照15 min后,La-CdS/TiO2对MO的降解已达99%。以上结果表明,掺杂TiO2的催化效果要好于未掺杂TiO2,La-CdS/TiO2的光降解催化效果比单一改性La-TiO2和CdS/TiO2的要好。
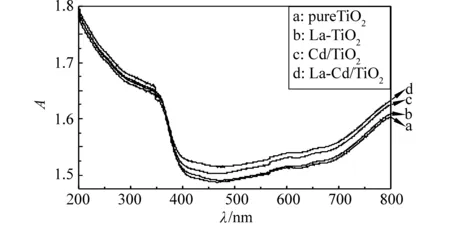
图3 不同组分掺杂的光催化剂的紫外可见漫反射吸收光谱图
表2 光催化剂的吸收边波长和禁带宽度
Table 2 Optical absorption edges and band gaps of photocatalysts

项目纯TiO2La-TiO2CdS/TiO2La-CdS/TiO2Eg/eV3.072.972.862.74λ/nm403418433452
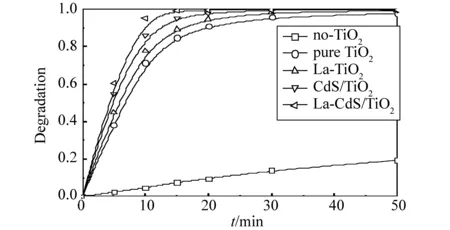
图4 450 ℃下不同掺杂TiO2的降解率
其原因主要有以下几点:①经过La掺杂及CdS复合改性后,La-CdS/TiO2形状规则且排列松散,表面积增大,使得催化剂与底物MO的接触面积增大,从而显著提高了TiO2光催化活性;②当掺杂适量稀土离子La3+时,La3+就会成为光生载流子的捕获中心,从而有效地抑制了光生载流子的复合,有效提高了光催化活性;③由于杂质能级的形成导致TiO2吸收较低波长的光子使电子发生跃迁,提高了光的利用率,进而提高了TiO2光催化活性;④ La3+掺杂与CdS复合改性的协同作用有助于TiO2光催化活性的大幅提高。
3 结 论
1) 采用水热法制备了La-CdS/TiO2,其颗粒均匀,排列规则、蓬松,光催化剂与底物的接触面积增大,有利于提高La-CdS/TiO2光催化活性。
2) La-TiO2、CdS/TiO2和La-CdS/TiO2在可见光区有较强的吸收,其禁带宽度减小,吸收边分别向可见光区移动了15、30和49 nm。
3) 与纯TiO2相比,La-TiO2、CdS/TiO2和La-CdS/TiO2的光催化活性都有所提高,其中La-CdS/TiO2提高最大,光照15 min后其对MO的降解率达99%。
参考文献:
[1] XU T L, CAI Y, KEVINE O S. Adsorption and photocatalyzed oxidation of methylated arsenic species in TiO2suspensions [J]. Environ Sci Technol, 2007, 41(15): 5471-5477.
[2] WU J M. Photodegradation of rhodamine B in water assisted by titania nanorod thin films subjected to various thermal treatments [J]. Environ Sci Technol, 2007, 41(5): 1723-1728.
[3] 湛社霞, 范山湖, 林作梅, 等. 钼搀杂TiO2光催化活性的研究[J]. 中山大学学报:自然科学版, 2001, 40(2): 125-127.
[4] GAO H T, ZHOU J, DAI D M, et al. Photocatalytic activities and electronic structure analysis of N-doped anatase TiO2:a combined experimental and theoretical study[J]. Chem Eng Technol, 2009, 32(6): 867-872.
[5] BORGARELLO E, SERPONE N, GRATZEL M, et a1. Hydrogen production through microhetero geneous photocatalysis of hydrogen sulfide cleavage: the thiosulfate cycle [J]. Int J Hydrogen Energy, 1985, 10(11): 737-741.
[6] RAMARKRISHNA G, HIRENDRA N G. Emission from the charge transfer state of xanthene dye-sensitized TiO2nanoparticles: a new approach to determining back electron transfer rate and verifying the marcus ilnverted regime [J]. J Phys Chem B, 2001, 105: 7000-7008.
[7] XING C J, ZHANG Y J, GUO L J, et a1. Band structure controlled solid solution of Cd1-xZnxphotocatalyst for hydrogen production by water splitting[J]. Int J Hydrogen Energy, 2006, 31(14): 2018-2024.
[8] JANG J S, LI W, SE H O, et a1. Fabrication of CdS/TiO2nano-bulk composite photocatalysts for hydrogen production from aqueous H2S solution under visible light [J]. Chem Phys Lett, 2006, 425(4/5/6): 278-282.
[9] 王添辉, 李越湘, 彭绍琴,等. 铂修饰的稀土掺杂TiO2的光催化制氢活性[J]. 化学学报,2005,63:797-801.
[10] JING L Q, SUN X J, XIN B F, et al. The preparation and characterization of La doped TiO2nanoparticles and their photocatalytic activity [J]. Sol Sta Chem, 2004, 177(10): 3375-3382.

