重组人胰岛素样生长因子-1对db/db小鼠应激性血糖升高的保护作用*
孔繁强 周树民 赵荣兰 孙 蓓 梁东春
机体在遭受感染、创伤等应激作用时会出现糖代谢改变,若糖的生成率超过清除率则会出现应激性高血糖。持续的高血糖可导致高渗血症、代谢性酸中毒和组织细胞损伤。应激期间血糖控制的好坏是评价糖尿病预后的一个重要指标[1]。对于应激性高血糖,临床上常采用强化胰岛素治疗的方案,效果较好[2]。但对于伴有胰岛素抵抗(insulin resis⁃tance,IR)的糖尿病患者,强化胰岛素治疗却收效甚微。研究表明,胰岛素样生长因子(insulin-like growth factor,IGF)-1对糖尿病特别是IR糖尿病患者具有较好的治疗作用[3]。本文旨在研究重组人IGF(rhIGF)-1对2型糖尿病(T2DM)伴IR小鼠应激性血糖升高的治疗作用。
1 材料与方法
1.1 材料 瘦素受体基因缺陷的db/db小鼠(n=30)及同品系的正常小鼠(n=15)均购自南京大学动物中心;rhIGF-1为本实验室自行制备[4];SYBR green Real-time PCR试剂盒和TaqDNA聚合酶为大连宝生物公司产品;兔抗小鼠葡萄糖转运酶(GLUT)4多克隆抗体及HRP标记的上样抗兔IgG购自北京中杉生物技术有限公司;小鼠胰岛素测定试剂盒购自瑞典Mercodia公司;小鼠IGF-1测定试剂盒购自美国Antigenix公司。
1.2 方法
1.2.1 db/db小鼠血糖及血胰岛素水平的监测 自6周龄后,每隔3 d随机抽取db/db小鼠及正常对照小鼠各6只,内眦静脉取血,EDTA抗凝,葡萄糖氧化酶法测定血糖,酶联免疫吸附法(ELISA)测定血浆胰岛素及血浆IGF-1水平。当抽检的db/db小鼠表现出明显的高血糖及高胰岛素血症后,测定全部小鼠的血糖、血浆胰岛素及IGF-1水平,筛选出血糖升高显著、胰岛素抵抗明显的db/db小鼠18只用于此后的应激实验。
1.2.2 应激性高血糖的诱发 选取入选实验的db/db小鼠及正常小鼠各6只,放入22 cm×20 cm×20 cm的笼内,笼底由细铜栅构成,通过铜栅给予小鼠足底电脉冲刺激。脉冲频率及强度由电脑控制,每2~10 s间随机发生1次,电压50 V,每次持续50 ms,共刺激5 min。刺激前及刺激后每30 min尾静脉放血,以美国Therasense公司微型血糖仪及血糖试纸测定血糖1次,观察应激性高血糖的发生及持续时间。同时测定未经电脉冲刺激的db/db小鼠(n=6)及正常小鼠(n=6)的血糖作为对照。4组小鼠分别命名为正常对照小鼠(NC),电刺激的正常小鼠(NS),db/db对照小鼠(DC),电刺激的db/db小鼠(DS)。
1.2.3 应激性高血糖的干预 (1)实验动物分组:将上述18只入选实验的db/db小鼠测量血糖后,随机分为3组。A组(db/db对照组,n=6),颈背部皮下注射等体积溶媒(盐酸酸化生理盐水,pH 5.2);B组(胰岛素治疗组,n=6),颈背部皮下注射胰岛素0.45 IU/kg;C组(rhIGF-1治疗组,n=6),颈背部皮下注射rhIGF-1 600 μg/kg。D组(正常对照组,n=6),同品系的正常小鼠,颈背部皮下注射等体积溶媒。(2)干预方式:尾静脉取血测定每只小鼠应激前血糖,随即进行电脉冲刺激,刺激结束后立即进行上述不同方式的干预,此后每30 min测定血糖1次,共测定3 h。
1.2.4 Real time-PCR检测骨骼细胞中GLUT4基因表达水平 干 预结束后立即处死各组小鼠,剪取适量骨骼肌组织置于冻存管内,-80℃低温保存。取0.5g冻存的骨骼肌组织置于1 mL Trizol试剂中,提取组织总RNA。取1.0 μg总RNA逆转录合成cDNA。以管家基因β-actin为内参照,采用SYBR green Real time-PCR试剂盒检测GluT4基因cDNA。小鼠β-actin基因的扩增引物为:上游5′-AGGGTGTGATGGT GGGAATG-3′,下游5′-CTCATTGTAGAAGGTGTGGTGC-3′;PCR产物大小为158 bp。小鼠GluT4基因的扩增引物为:上游5′-CAGAGCTA CAATGCAACG-3′,下 游 5 ′-GCCAATGAGAAAGGAAGAG-3′ ;PCR产物大小为141 bp。PCR反应在Roche LightCyler定量PCR仪上完成,反应条件为95℃预变性15 s,95℃5 s,55℃20 s,72 ℃ 1 0 s,45个循环。靶基因cDNA相对含量以2-ΔCt表示。
1.2.5 Western blot检测细胞膜中GLUT4 取0.5 g冷冻保存的骨骼肌组织置于1.5 mL RIPA裂解液中充分匀浆,1 000×g离心10 min。取上清液于40 000×g离心1 h,以0.5 mL含1%TritonX-100的PBS溶液悬浮沉淀,20%能量输出条件下超声破碎3次,每次30 s,间隔3 min。再次40 000 ×g离心1 h,上清液中含有细胞膜蛋白。BCA法测定膜蛋白样本的总蛋白质浓度,取50 μg膜蛋白行SDS-PAGE,半干法转膜,4%脱脂奶粉对NC膜进行封闭,以兔抗小鼠GLUT4多克隆抗体为一抗,HRP标记的山羊抗兔IgG为二抗与膜进行温浴。将膜于发光底物溶液中浸泡4 min后对X线胶片进行曝光,随后对胶片进行显影及定影。
1.3 统计学分析 所 有数据均经SPSS 17.0统计软件处理,实验结果以x ±s表示。重复测量资料采用重复测量方差分析,2组比较采用t检验,多组比较采用方差分析,两两比较采用LSD-t法,以P<0.05为差异有统计学意义。
2 结果
2.1 db/db小鼠相关指标的检测 与同品系的正常小鼠相比,db/db小鼠在生后8周表现出肥胖、高血糖及明显的IR症状,血IGF-1水平也明显低于正常对照组,见图1、表1。
表1 8周龄db/db小鼠及正常对照小鼠的部分指标比较(n=6,±s)

表1 8周龄db/db小鼠及正常对照小鼠的部分指标比较(n=6,±s)
**P<0.01
?
2.2 电脉冲刺激对血糖的影响 电脉冲刺激后,组间血糖水平的差异有统计学意义(F组间=48.915,P<0.05),组内不同时间点血糖水平差异无统计学意义(F时间=1.295,P>0.05),组间和时间无交互效应(F交互=1.046,P>0.05)。电刺激不同时间时,NC组和NS组差异均无统计学意义(P>0.05);DS组和NC、NS、DC组相比,在不同时间点差异均有统计学意义(P<0.05或P<0.001),见表2。
表2 电脉冲刺激对血糖水平的影响(n=6,mmol/L,±s)

表2 电脉冲刺激对血糖水平的影响(n=6,mmol/L,±s)
**P<0.01
组别NC组(1)NS组(2)DC组(3)DS组(4)F P(1)∶(2)(1)∶(3)(1)∶(4)(2)∶(3)(2)∶(4)(3)∶(4)30 min 6.2±1.1 9.2±3.4 10.3±2.2 17.4±4.8 13.173**0.118 0.036<0.001 0.546<0.001<0.001 60 min 5.8±1.3 6.3±1.8 9.5±4.2 18.4±6.8 11.805**0.832 0.139<0.001 0.200<0.001<0.001 120 min 6.5±1.7 5.6±1.8 10.2±2.6 13.4±3.3 13.094**0.543 0.015<0.001<0.001<0.001 0.034 90 min 5.8±0.9 6.4±1.5 9.8±3.6 16.7±5.2 14.033**0.735 0.045<0.001 0.088<0.001<0.001
2.3 rhGF-1对应激性血糖升高的保护作用 干预后,组间血糖水平差异有统计学意义(F组间=36.947,P<0.05),不同时间点血糖水平差异有统计学意义(F时间=13.880,P<0.05),且组间和时间存在交互效应(F交互=11.769,P<0.05)。与 A组小鼠相比,rhIGF-1干预(C组)在干预60~90 min时即表现出了较明显的降血糖作用,A、B组与D相比,在不同时间点的血糖水平差异均有统计学意义(P<0.05或P<0.01),见表3。
2.4 骨骼肌中GluT4基因的表达水平 db/db小鼠肌肉组织中GluT4基因的表达水平低于同品系的正常小鼠。给予外源IGF-1可显著增加GluT4基因的表达,而胰岛素则不具有此作用,见表4。
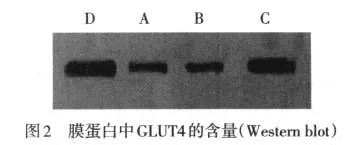
2.5 细胞膜中GLUT4的含量 所提取的膜蛋白经Western blot检测,在与GLUT4蛋白分子质量相符的位置上出现单一的曝光斑。与正常对照小鼠(D组)相比,db/db对照(A组)及胰岛素干预组(B组)细胞膜内GLUT4的含量明显降低,IGF-1干预(C组)则可使GLUT4的含量显著增加,见图2。
表3 应激前和干预后180 min血糖变化情况(n=6,mmol/L±s)

表3 应激前和干预后180 min血糖变化情况(n=6,mmol/L±s)
*P<0.05,**P<0.01
组别ABCDF P A∶B A∶C A∶D B∶C B∶D C∶D应激前9.3±3.2 8.9±2.5 9.5±2.8 5.6±1.3 3.306*0.801 0.891 0.002 0.697 0.030 0.013 30 min 16.3±3.9 15.8±4.2 12.4±1.8 9.7±3.6 4.677*0.782 0.064<0.001 0.109<0.001 0.204 60 min 17.4±2.7 17.1±3.3 10.3±2.1 6.6±1.5 27.373**0.864<0.001<0.001<0.001<0.001 0.018 90 min 14.7±4.6 13.1±2.2 9.3±3.1 6.5±1.7 8.585**0.382<0.001<0.001 0.046<0.001 0.136 120 min 11.5±2.1 10.8±2.7 9.6±3.5 6.2±1.4 5.102**0.632 0.216<0.001 0.438<0.001 0.031 150 min 10.1±2.4 9.6±3.1 9.8±2.6 5.8±1.4 4.071*0.746 0.835<0.001 0.908 0.014 0.011 180 min 8.6±2.3 9.2±1.9 8.7±3.7 5.7±1.1 2.547
表4 骨骼肌中GLUT4基因的表达水平 (±s)

表4 骨骼肌中GLUT4基因的表达水平 (±s)
**P<0.01
ABCDF 0.007±0.001 0.009±0.001 0.041±0.008 0.109±0.015 185.548**组比A∶B A∶C A∶D B∶C B∶D C∶D P 0.695<0.001<0.001<0.001<0.001<0.001统计学处理组别 2-△Ct n 6666
3 讨论
无论有无糖尿病,机体在面对刺激时均可能应激性升高血糖[5]。但是糖尿病患者的应激性高血糖难于控制且持续时间长,特别是伴有IR的T2DM患者所表现出的应激性高血糖难以被大剂量的胰岛素所控制,预后较差。研究显示,IGF-1有明显的降糖作用,特别是对有IR的糖尿病患者作用明显[6]。本研究以瘦素受体基因缺陷的db/db小鼠为动物模型,模拟伴IR的T2DM病例。db/db小鼠一般在生后6~10周表现出明显的血糖升高及IR,本研究证实了db/db小鼠在生后8周发生了高胰岛素血症及高血糖。
采用胰岛素和IGF-1干预显示,对于胰岛素治疗无效的应激性高血糖,IGF-1表现出了良好治疗效果。为了探究IGF-1的降糖机制,本文研究了IGF-1对骨骼肌组织中GLUT4表达及转位的影响。GLUT4所介导的葡萄糖摄取是外周组织利用葡萄糖的主要限速步骤[7],GLUT4可通过表达的增加向细胞膜的转位这2种途径来增加细胞对葡萄糖的摄取[8-9]。经Real time-PCR及Western blot检测证明,IGF-1不但可以显著增加db/db小鼠骨骼肌组织中GluT4基因的表达,还可增加GLUT4在细胞膜的聚集,并可能因此增加糖的摄取而降低血糖。综上,IGF-1可有效控制伴IR的T2DM产生的应激性高血糖,其机制与调节GLUT4的表达及转位有关。
[1]刘晓青,钟南山,刘思蓓,等.重症SARS患者接受临床营养支持及血糖水平胰岛素用量与结局的关系[J].中国临床营养杂志,2003,11(2):80-84.
[2]Van den Berghe G,Wouters P,Weekers F,et al.Intensive insulin therapy in critically ill patients[J].N Engl J Med,2001,345(19):1359-1367.
[3]Ranke MB.Insulin-like growth factor-I treatment of growth disor⁃ders,diabetes mellitus and insulin resistance[J].Trends Endocrinol Metab,2005,16(4):190-197.
[4]梁东春,左爱军,吴亚锋,等.重组人胰岛素样生长因子1的制备[J].天津医药,2005,33(7):434-436.
[5]Digman C,Borto D,Nasraway SA Jr.Hyperglycemia in the critically ill[J].Nutr Clin Care,2005,8(2):93-101.
[6]Mohamed-Ali V,Pinkney J.Therapeutic potential of insulin-like growth factor-1 in patients with diabetes mellitus[J].Treat Endocri⁃nol,2002,1(6):399-410.
[7]Tremblay F,Lavigne C,Jacques H,et al.Dietary cod protein re⁃stores insulin-induced activation of phosphatidylinositol 3kinase/Akt and GluT-4 translocation to the T-tubules in skeletal muscle of high-fat-fed obese rats[J].Diabetes,2003,52(1):29-37.
[8]Ikemoto T,Hosoya T,Takata K,et al.Functional role of neuroendo⁃crine-specific protein-like 1 in membrane translocation of GLUT4[J].Diabetes,2009,58(12):2802-2812.
[9]Aksentijevic D,Bhandari S,Seymour AM.Insulin resistance and al⁃tered glucose transporter 4 expression in experimental uremia[J].Kidney Int,2009,75(7):711-718.

