细胞角蛋白17在口腔鳞癌中的表达
魏魁杰 张雷 杨筱 韩伟 钟来平 叶冬霞 张志愿
(1.湖州师范学院医学院 口腔系,湖州 313000;2.上海交通大学医学院附属第九人民医院 口腔颌面外科,上海 200011)
口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)是头颈部最常见的恶性肿瘤之一,患者5年生存率约为50%,对于肿瘤晚期和复发患者,生存率更低[1]。因此寻找有效的生物标志物、阐明其发病机制十分重要。
本研究利用口腔黏膜上皮体外癌变模型[2-3],在前期工作中采用比较蛋白质组学技术,鉴定出癌变形成细胞较永生化细胞高表达的细胞角蛋白17(cytokeratin 17,CK17)。CK17是构成细胞骨架的一种酸性多肽,在乳腺癌、子宫颈癌、肺癌等多种恶性肿瘤中高表达[4-7]。本研究旨在探讨CK17在口腔黏膜上皮体外癌变模型、口腔鳞癌细胞株及临床组织标本中的表达情况及临床意义,以期为口腔鳞癌的诊断和预防提供依据。
1 材料和方法
1.1 试剂与器材
细胞培养基Defined keratinocyte-SFM、DMEM和RPMI-1640(Gibco公司,美国),RNA提取试剂(Invitrogen公司,美国),实时荧光定量试剂盒(TaKaRa公司,日本),Western鼠抗荧光抗体(Fermentas公司,立陶宛),EnVision鼠兔共抗二抗(Dako Cytomation公司,丹麦),CK17鼠抗人单克隆抗体(Millipore公司,美国),Odyssey激光成像分析系统(LI-COR Biosciences公司,美国)。
1.2 细胞培养
口腔黏膜上皮体外癌变模型中的永生化细胞(human immortalized oral epithelia cell,HIOEC)、HB56及HB96细胞、舌鳞癌细胞株Tca8113均由上海交通大学医学院附属第九人民医院口腔颌面外科肿瘤生物实验室建系,舌鳞癌细胞株TSCC由武汉大学口腔医学院建系并惠赠,CAL27购自美国American Type Culture Collection(ATCC)公司,口腔鳞癌细胞株OSC由日本高知大学医学院惠赠。HIOEC采用Defined keratinocyte-SFM培养,HB56、HB96和CAL27采用DMEM(含10%FBS,2×105U·L-1青、链霉素)培养,Tca8113、TSCC、OSC细胞用RPMI-1640(含10%FBS,2×105U·L-1青、链霉素)培养。所有细胞在37℃、5%CO2培养箱中培养。
1.3 组织标本
选取2007年2—7月上海交通大学医学院附属第九人民医院口腔颌面外科手术切除的原发口腔鳞癌组织标本30例,患者术前未经过放、化疗,且均知情同意。30例患者中,男性21例,女性9例;年龄31~84岁,平均年龄53.8岁。根据国际抗癌联盟(Union Internationale Contre Le Cancer,UICC)2002分类,T1 6例,T2 13例,T3 4例,T4 7例;N0 16例,N1-2 14例;临床分期:Ⅰ、Ⅱ级(早期)13例,Ⅲ、Ⅳ级(晚期)17例;病理分级:高分化12例,中分化15例,低分化3例。术中切取肿瘤实体内组织和肿瘤边界2 cm外的癌旁组织立即投入液氮后转移至-80℃冰箱保存备用,癌旁组织经病理证实为正常黏膜组织。
1.4 实时定量聚合酶链反应
待细胞丰度至70%~80%,按1×107收集细胞,移入1.5mL离心管中;取组织块约50mg置研钵中,加入液氮后迅速研磨成粉末状,分别加入1mL Trizol,根据RNA提取试剂盒操作步骤分别抽提各细胞及癌与癌旁组织总RNA,测定质量浓度。取2μg总RNA,按反转录试剂盒步骤进行反转录为cDNA,然后采用20μL反应体系,以cDNA为模板进行聚合酶链反应(polymerase chain reaction,PCR)扩增。PCR扩增CK17上游序列:5’-GAGATTGCCACCTACCGC-3’,下游序列:5’-TGCCATCCTGGACCTCTT-3’,扩增片段的长度为118 bp。内参照β-肌动蛋白上游序列:5’-TGGATCAGCAAGCAGGAGTAT-3’,下游序列:5’-GGTTTTGTCAAGAAAGGGTGTAACG-3’,扩增片段的长度为100bp。反应条件为:预变性95℃、10 s,95℃、5 s,60℃、30 s,共40个循环,β-肌动蛋白作为内参照,实验重复3次。根据Livak等[8]推导的2-ΔΔCt分别计算细胞系中目的基因相对内参基因的相对表达量以及口腔鳞癌癌组织相对癌旁组织中目的基因的相对表达量。
1.5 免疫印迹反应
待细胞长至70%~80%汇合,每1×107细胞加入1mL预冷的2×组织细胞蛋白裂解液(含125mmol·L-1Tris-HCl、5%十二烷基硫酸钠、24.75%甘油)提取总蛋白,Bradford法蛋白定量,每孔总蛋白上样量50μg,12%聚丙烯酰胺凝胶电泳2 h后,采用湿转法转至硝酸纤维素膜,5%脱脂牛奶封闭2 h,加入1∶1 000稀释的鼠抗人CK17单克隆抗体4℃孵育过夜。经过含0.1%Tween-20的磷酸盐缓冲液洗涤后,与1∶1 000稀释的荧光二抗在室温下孵育1 h。采用Odyssey激光成像分析系统进行扫描,测定电泳条带的积分密度值,以β-肌动蛋白作为内参照。
1.6 免疫组化检测
石蜡连续切片4μm,常规脱蜡至水,3%H2O2作用20min以消除内源性过氧化物酶活性,0.01mol·L-1pH6.0枸橼酸盐缓冲液水浴加热法抗原修复,滴加1∶100稀释的CK17鼠抗人的单克隆抗体50μL,湿盒内4℃过夜,次日室温下复温1 h;滴加EnVision鼠兔共抗二抗50μL,室温孵育40min;0.04%DAB显色1~5min,镜下控制反应时间;苏木素复染,脱水,中性树胶封片。用磷酸盐缓冲液代替一抗作为空白对照。CK17的染色结果由2名病理科医生采用双盲法镜检,根据阳性细胞数占总细胞数的比例计算阳性表达率,结果记录:阴性记为0分,1%~25%记为1分,26%~50%记为2分,51%~100%记为3分。
1.7 统计学分析
采用SPSS 10.0软件对数据进行统计,对癌组织与癌旁组织中CK17 mRNA表达进行单样本t检验,对CK17的表达水平与口腔鳞癌患者临床病理指标之间的关系、癌组织与癌旁组织中CK17蛋白的表达进行非参数分析配对样本Wilcoxon检验。
2 结果
2.1 CK17 mRNA和蛋白在体外癌变模型和口腔鳞癌细胞株中的表达
实时定量PCR反应检测结果:与永生化HIOEC细胞相比,CK17 mRNA在HB56和OSC细胞株中表达明显升高,而在HB96、Tca8113、TSCC和CAL27细胞中有不同程度的降低(图1)。Western blot印迹检测结果:与永生化HIOEC细胞相比,CK17蛋白表达水平在HB细胞及所有口腔鳞癌细胞株中均有不同程度的升高(图2,3)。

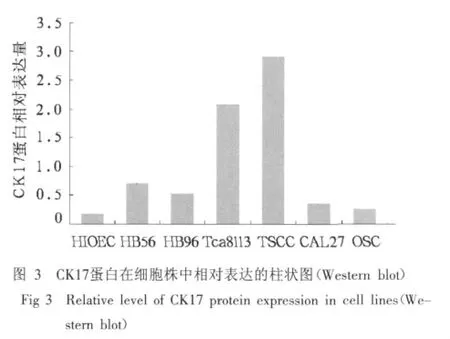
2.2 CK17 mRNA在口腔鳞癌组织标本中的表达
对30例口腔鳞癌癌组织相对于癌旁组织中CK17基因的表达变化倍数进行分析:口腔鳞癌组织中CK17 mRNA水平是癌旁组织的(3.041±3.504)倍,癌组织中CK17基因的转录水平显著高于癌旁组织(t=3.191,P=0.003)。CK17的表达水平与口腔鳞癌患者临床病理指标之间的关系见表1。
在分析口腔鳞癌中CK17基因水平与各临床病理指标关系时,仅发现直径大小不同的肿瘤间CK17 mRNA水平呈差异表达(P=0.035),但是进一步研究发现这种差异表达并未呈现出一种趋势,即随着肿瘤直径的增加,CK17 mRNA表达上升或下调,另外,CK17 mRNA表达水平与其他临床病理指标间均无明显相关性(表1)。
2.3 CK17蛋白在口腔鳞癌组织标本中的表达
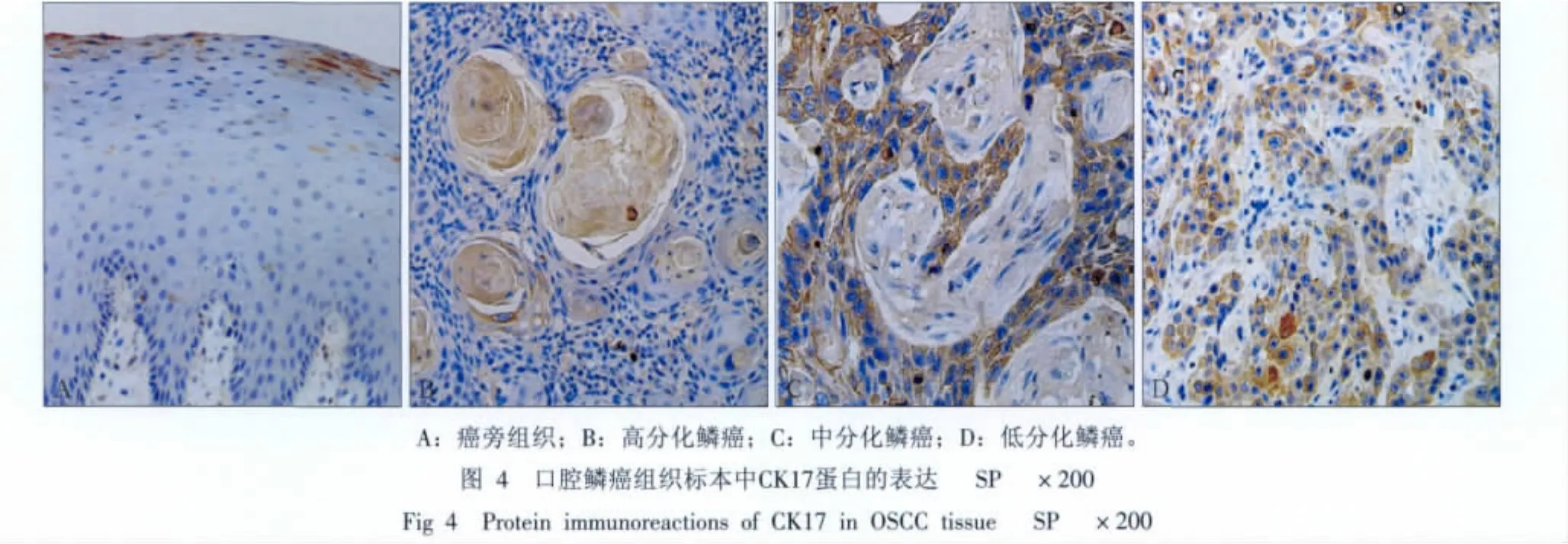
口腔鳞癌患者的癌组织和癌旁组织中CK17蛋白表达情况见表2和图4。在癌旁组织中,CK17蛋白的染色稍浅,阳性细胞率稍低;而在癌组织中CK17均为阳性表达,染色较深,主要表达在细胞浆中。用非参数分析配对样本Wilcoxon检验,Z=-3.892,P<0.001,二者之间的差异有统计学意义,表明口腔鳞癌患者癌组织中CK17阳性表达程度显著高于癌旁组织。CK17蛋白的表达与烟酒嗜好、肿瘤大小、淋巴结转移、临床分期和病理分化程度均无明显相关性。
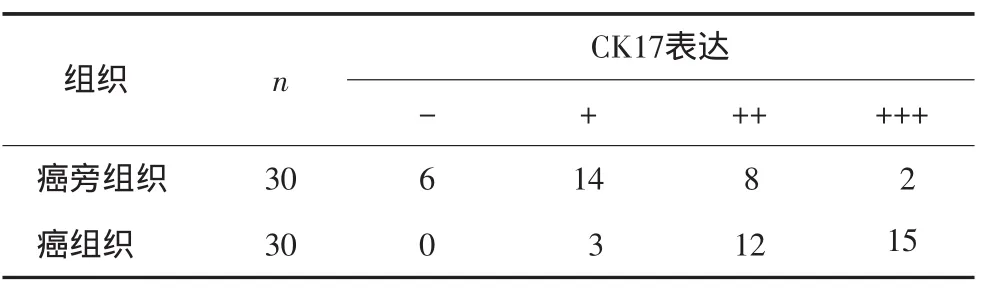
表2 30例口腔鳞癌癌组织和癌旁组织中CK 17蛋白表达Tab 2 The CK 17 protein expression in cancerous and para-cancerous tissues from 30 OSCC patients
3 讨论
口腔鳞状细胞癌的致癌过程是一个多因素、多步骤发展的过程,在生物因素、化学因素和血清中生长因子等多种因素的作用下,多种蛋白水平发生改变,出现细胞异常增殖,导致肿瘤形成。本课题前期研究已建立了国内第一株人永生化口腔上皮细胞株HIOEC[2],并利用苯丙芘诱导HIOEC细胞,形成具有裸鼠皮下成瘤能力等恶性表型的HB细胞株,包括HB56、HB96细胞,从而建立了人口腔黏膜上皮细胞体外癌变细胞模型[3]。从HIOEC到HB细胞恶性转化过程可能伴随一些重要的基因表达或功能变化,本课题组在前期工作中应用比较蛋白质组学方法,从HIOEC和HB细胞中鉴定出50多个差异表达蛋白,CK17是其中之一[9]。
为了验证比较蛋白质组学结果,本研究应用实时定量PCR和免疫印迹方法检测CK17 mRNA和蛋白在体外癌变模型和口腔鳞癌细胞株中的表达。结果显示:相对于HIOEC细胞,CK17 mRNA在HB56和OSC中表达上调,而在HB96及其他口腔鳞癌细胞株中有不同程度的降低,CK17蛋白在HB56、HB96和所有口腔鳞癌细胞株中均有不同程度的升高,提示CK17的表达上升可能在口腔鳞癌细胞株中是普遍现象。Lalli等[10]研究表明:在癌前病变口腔黏膜下纤维化(oral submucous fibrosis,OSF)中CK17蛋白表达上升,且与病变严重程度有关。上述研究结果均表明CK17可能在口腔鳞癌的发生过程中起到一定的作用。
对临床标本的研究结果显示:癌组织中CK17 mRNA和蛋白的表达均明显高于癌旁组织,与比较蛋白质组学及细胞株中免疫印迹结果一致,也与其他学者[4-7]在乳腺癌、子宫颈癌、肺癌等恶性肿瘤中的研究结果相一致。本研究中也发现无论从基因还是蛋白水平上,CK17的表达与各临床病理指标之间均无明显相关性。而在既往的口腔鳞状细胞癌的研究中,有学者[11-12]发现在淋巴结转移的标本中CK17 mRNA表达升高,认为可以利用检测CK17 mRNA表达水平来预测是否存在淋巴结转移。
以上研究结果表明:CK17在口腔黏膜上皮癌变过程中表达上调可能与口腔鳞癌的发生、发展有关,可作为口腔鳞癌早期诊断的检测指标。当然本研究也发现在细胞学水平上CK17存在基因和蛋白表达不同步的现象,与Sesterhenn等[13]在头颈部鳞癌中的研究结果相似,他们发现在15种头颈部鳞癌细胞株中,只有3株CK17 mRNA高表达,1株CK17蛋白高表达,而在15例头颈鳞癌组织标本中10例标本CK17 mRNA高表达,所有标本CK17蛋白高表达。这种基因和蛋白表达不同步的现象,可能与基因转录后的修饰如甲基化、磷酸化或泛素化有关,今后还需要进一步采用基于基因转染和小RNA干扰等手段的基因功能研究和长期大量的临床病例随访研究,以阐明CK17在口腔鳞癌发生、发展中的具体作用机制。
[1]Parkin DM,Bray F,Ferlay J,et al.Global cancer statistics,2002[J].CA Cancer J Clin,2005,55(2):74-108.
[2]张志愿,帕提曼·司地克,曹俊,等.16型人乳头状瘤病毒E6、E7诱导的人永生化口腔上皮细胞系的建立[J].中华口腔医学杂志,2002,37(1):12-14.Zhang Zhiyuan,Sdek Patima,Cao Jun,et al.Establishment of human immortalized oral epithelial cell line HIO615 induced by HPV16 E6 and E7[J].Chin J Stomatol,2002,37(1):12-14.
[3]潘红芽,张志愿,周晓健,等.口腔黏膜上皮细胞体外癌变模型的建立[J].中华口腔医学杂志,2006,41(1):20-24.Pan Hongya,Zhang Zhiyuan,Zhou Xiaojian,et al.The establishment of a carcinogenesis model of oral squamous cell carcinoma in vitro[J].Chin J Stomatol,2006,41(1):20-24.
[4]Cohen-Kerem R,Madah W,Sabo E,et al.Cytokeratin-17 as a potentialmarker for squamous cell carcinoma of the larynx[J].Ann Otol Rhinol Laryngol,2004,113(10):821-827.
[5]van de Rijn M,Perou CM,Tibshirani R,et al.Expression of cytokeratins 17 and 5 identifies a group of breast carcinomas with poor clinical outcome[J].Am J Pathol,2002,161(6):1991-1996.
[6]Carrilho C,Alberto M,Buane L,et al.Keratins 8,10,13,and 17 are useful markers in the diagnosis of human cervix carcinomas[J].Hum Pathol,2004,35(5):546-551.
[7]Wetzels RH,Schaafsma HE,Leigh IM,et al.Laminin and typeⅦcollagen distribution in different types of human lung carcinoma:Correlation with expression of keratins 14,16,17 and 18[J].Histopathology,1992,20(4):295-303.
[8]Livak KJ,Schmittgen TD.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCtmethod[J].Methods,2001,25(4):402-408.
[9]钟来平,潘红芽,叶冬霞,等.用比较蛋白质组学技术筛选口腔黏膜上皮细胞体外癌变的相关蛋白[J].中国口腔颌面外科杂志,2010,8(3):235-240.Zhong Laiping,Pan Hongya,Ye Dongxia,et al.Comparative proteomic analysis of differentially expressed proteins in the in vitro cellular carcinogenesis model of oral mucosal epithelial cells[J].Chin J Oral Maxillofac Surg,2010,8(3):235-240.
[10]Lalli A,Tilakaratne WM,Ariyawardana A,et al.An altered keratinocyte phenotype in oral submucous fibrosis:Correlation of keratin K17 expression with disease severity[J].J Oral Pathol Med,2008,37(4):211-220.
[11]Toyoshima T,Vairaktaris E,Nkenke E,et al.Cytokeratin 17 mRNA expression has potential for diagnostic marker of oral squamous cell carcinoma[J].J Cancer Res Clin Oncol,2008,134(4):515-521.
[12]Garrel R,Dromard M,Costes V,et al.The diagnostic accuracy of reverse transcription-PCR quantification of cytokeratin mRNA in the detection of sentinel lymph node invasion in oral and oropharyngeal squamous cell carcinoma:A comparison with immunohistochemistry[J].Clin Cancer Res,2006,12(8):2498-2505.
[13]Sesterhenn AM,Mandic R,Dünne AA,et al.Cytokeratins 6 and 16 are frequently expressed in head and neck squamous cell carcinoma cell lines and fresh biopsies[J].Anticancer Res,2005,25(4):2675-2680.

