棉铃虫酰基辅酶AΔ9去饱和酶基因的分子鉴定
陈丽君,杜孟芳,安世恒,张松斗,蒋金炜
(河南农业大学植物保护学院,河南 郑州 450002)
去饱和酶是一种催化脱饱和作用的功能性酶,能使饱和脂肪酸转变成不饱和脂肪酸.酰基CoA去饱和酶是脂肪酸去饱和酶的1种,存在于真菌和动物的内质网膜上并与膜结合,功能是在脂酰CoA上引入双键[1].根据脱饱和酶在脂酰链中引入双键的位置不同,可以将脱饱和酶分为Δ9,Δ12,Δ6,Δ5 等类别,分别在脂酰链的 Δ9,Δ12,Δ6,Δ5等位置引入双键[2].在酰基辅酶A去饱和酶家族中,编码Δ9去饱和酶同源体的基因已经从酵母类到脊椎动物中被克隆出来,包括节肢动物如美洲花蜱(Amblyomma americanum)[3]、果蝇(Drosophila melanogaster)[4]、粉夜蛾(Trichoplusia ni)[5].在国外,酰基辅酶AΔ9去饱和酶在很多昆虫中都有研究,如马尾松毛虫(Dendrolimus punctatus Walker)、家蚕(Bombyx mori)、果蝇、粉夜蛾、甘蓝夜蛾(Mamestra brassicae)等.研究显示,酰基辅酶 AΔ9去饱和酶在脂肪酸代谢过程中和调节细胞膜流动性方面起重要作用[6~8].目前对它的研究主要集中在昆虫产生信息素过程中的作用[9].而酰基辅酶AΔ9去饱和酶在棉铃虫幼虫的脂肪酸代谢过程中具体有什么作用,还没有相关报道.本试验对棉铃虫酰基辅酶AΔ9去饱和酶基因进行克隆,利用分子技术得到其cDNA全序列,并研究其在棉铃虫幼虫的不同发育期、饥饿处理、注射激素后的转录水平,以期为深入探讨酰基辅酶AΔ9去饱和酶在昆虫脂肪酸代谢中的作用为防治害虫提供理论依据.
1 材料与方法
1.1 供试昆虫与试剂
棉铃虫(Helicoverpa armigera)为河南农业大学昆虫实验室饲养,饲养条件为温度27℃,光周期为L∶D=16∶8,相对湿度为75%.载体 pDM -T载体购自TakaRa公司,大肠杆菌JM109为河南农业大学昆虫实验室保存.主要试剂为总RNA抽提试剂(RNAiso Reagent),限制性内切酶(BamHI和HandIII),3’-Full RACE 试剂盒,rTaqDNA 聚合酶,DL2000 Marker,荧光定量试剂盒(SYBR Primer Script RT-PCR Kit),TaKaRa One Step RNA PCR Kit试剂盒购自TaKaRa公司;反转录试剂盒(RevertAidTMFirst Strand cDNA Synthesis Kit)为MBI公司产品;其他均为国产或进口分析纯试剂.
1.2 试验方法
1.2.1 棉铃虫总RNA的提取 取5龄初期的棉铃虫幼虫后半部放入经DEPC处理过的Eppendorf管中匀浆,用RNAiso Reagent法提取RNA(具体参照Takara公司试剂说明书).用紫外分光光度计检测其纯度和浓度.
1.2.2 引物设计 对其他昆虫酰基辅酶AΔ9去饱和酶的核苷酸序列进行同源比对,在保守区设计并合成引物.本研究所用引物及其用途见表1,引物由上海博尚生物技术有限公司合成.
1.2.3 反转录扩增棉铃虫酰基辅酶AΔ9去饱和酶基因片断 根据反转录试剂盒说明,以5龄幼虫总RNA为模板合成cDNA第1链,随后以合成的cDNA第1链为模板,利用GP1和GP2引物进行PCR扩增.PCR反应条件为:94℃变性3 min;随后40个循环的扩增,扩增条件为94℃ 1 min,60℃50 s,72 ℃ 1 min;最后72 ℃ 10 min.
1.2.4 棉铃虫酰基辅酶AΔ9去饱和酶基因克隆和测序 反应结束后,取上述PCR反应液(5~10 μL)进行琼脂糖凝胶(质量浓度为1.3%)电泳,确认RT-PCR扩增产物.电泳、纯化后,按照载体PDM-T连接试剂盒说明书,将纯化的目的片段与PDM-T载体连接,重组质粒转化入大肠杆菌JM109感受态细菌,进行蓝白斑筛选.挑取检测出的阳性克隆白斑接种于附有Ampicillin 80 mg·L-1的LB培养基中,37℃下180 r·min-1过夜培养后,进行质粒的提取(具体过程参照SanPrep柱式质粒DNA抽提试剂盒说明书).将质粒送至上海生工进行测序.

表1 引物序列列表Table1 List of the primer sequences
为了获得棉铃虫酰基辅酶AΔ9去饱和酶基因完整cDNA序列,根据上述获得的基因序列,设计合成基因特异性引物P3和P4并分别与3'RACE试剂盒中的Outer Primer和Inner Primer引物配对进行套式PCR扩增,设计合成基因特异性引物P5和P6分别与5'RACE试剂盒中的Outer Primer和Inner Primer引物配对也进行套式PCR扩增.按照试剂盒(3'-Full Race Core Set Ver.2.0;TaKaRa)进行3’RACE;按照试剂盒(5'-Full Race Core Set Ver.2.0;TaKaRa)进行 5’RACE.
1.2.5 序列分析 核苷酸序列分析采用Chromaspro软件,氨基酸序列分析采用生物信息学在线工具 http://www.expasy.org/tools/pi_tool.html,同源性比较采用NCBI中的BLAST工具,序列多重联配采用Clustal W和Genedoc软件.
1.2.6 实时荧光定量PCR检测 Real-time PCR采用相对定量的方法计算,以棉铃虫18 SrRNA为内参基因,在 Mastercycler@ep realplex real-time PCR检测系统上进行操作,反应条件如下:95℃预变性10 s,95 ℃15 s,55 ℃15 s,68 ℃20 s,共40 个循环;95℃15 s,60℃15 s,95℃15 s用于记录溶解曲线.基因的相对表达量用2-△△Ct方法计算.
1.2.7 棉铃虫酰基辅酶AΔ9去饱和酶基因在棉铃虫幼虫不同发育期的表达 利用合成的不同发育期棉铃虫幼虫cDNA第1链作为模板,以P7和P8为引物进行Real-time PCR扩增,以18 S rRNA为内参基因.相对定量计算方法同1.2.6.
1.2.8 饥饿处理对酰基辅酶AΔ9去饱和酶基因因转录水平的影响 对5龄初期的棉铃虫幼虫进行饥饿处理,处理时间分别为 6,12,24,48 h,随后各取2头幼虫进行RNA提取.反转录与Real Time PCR反应按照试剂盒(SYBR Primer Script RT-PCR Kit)使用说明进行.Real-time PCR操作和计算方法同 1.2.6.
1.2.9 激素处理对酰基辅酶AΔ9去饱和酶基因因转录水平的影响 将40 ng(20 μg·L-1)保幼激素类似物溶液(用丙酮溶解)注射在5龄初期的棉铃虫幼虫腹部节间膜上,对照幼虫注射丙酮.分别选取处理后3,6,12 h及对照的5龄幼虫各2头提取RNA.
将100 ng(50 μg·L-1)蜕皮激素(用酒精溶解)注射在5龄初期的棉铃虫幼虫腹部节间膜上,对照幼虫注射酒精.分别选取处理后3,6,12,24 h及对照的5龄幼虫各2头提取RNA.
Real-time PCR 操作和计算方法同1.2.6.
2 结果与分析
2.1 棉铃虫酰基辅酶 AΔ9去饱和酶基因序列测定
RT-PCR及RACE结果发现,该基因总长度为2 931 bp,编码区长度为1 062 bp,编码353个氨基酸残基(图1).Genbank登录号为 HM629435.Ex-PAsy分析显示,该基因编码的蛋白质等电点为8.66,相对分子质量为40.66 kDa.同源性分析结果表明棉铃虫酰基辅酶AΔ9去饱和酶氨基酸序列与其他昆虫的酰基辅酶AΔ9去饱和酶氨基酸序列具有很高的一致性(图2),与谷实夜蛾(Helicoverpa zea)、烟夜蛾(Helicoverpa assulta)一致性达到95%以上,与海灰翅夜蛾(Spodoptera littoralis)、红带卷蛾(Argyrotaenia velutinana)、亚洲玉米螟(Ostrinia furnacalis)、欧洲玉米螟(Ostrinia nubilalis)的同源性一致性均达到85%以上,蔷薇斜条卷叶蛾(Choristoneura rosaceana)为84%.系统发育分析结果表明了酰基辅酶AΔ9去饱和酶基因在进化过程中的保守性.

图1 棉铃虫酰基辅酶AΔ9去饱和酶基因核苷酸序列、推测的氨基酸序列Fig.1 Nucleotide,and deduced amino acid sequences of acyl-CoA delta-9 desaturase from Helicoverpa armigera
2.2 棉铃虫不同发育期酰基辅酶AΔ9去饱和酶基因的转录情况
荧光定量PCR分析结果显示,不同发育期中,酰基辅酶AΔ9去饱和酶基因在5龄24 h到5龄72 h转录水平较高,在72 h时达到最高.在4龄12 h,4龄36 h,5龄12 h,5龄96 h直到蛹期2 d的转录水平较低.从4龄到5龄72 h,随着幼虫的生长,酰基辅酶AΔ9去饱和酶基因的转录水平基本呈增长趋势.(图4).

图2 棉铃虫酰基辅酶AΔ9去饱和酶与其他昆虫的氨基酸序列比对分析Fig.2 Alignments analysis of Helicoverpa armigera acyl-CoA delta-9 desaturase and other insect homogous

图3 棉铃虫酰基辅酶AΔ9去饱和酶与其他昆虫已知氨基酸的系统进化树Fig.3 Phylogenetic tree based on amino acid sequence of acyl-CoA delta-9 desaturase of Helicoverpa armigera and other reported insects
2.3 饥饿处理对棉铃虫酰基辅酶AΔ9去饱和酶基因转录情况的影响
对5龄期2 d的棉铃虫幼虫进行饥饿处理,提取RNA,进行荧光定量分析.结果表明,饥饿处理对酰基辅酶AΔ9去饱和酶基因转录有较强的抑制作用(图5).
2.4 注射激素对棉铃虫酰基辅酶AΔ9去饱和酶基因转录水平的影响
2.4.1 注射保幼激素类似物对棉铃虫酰基辅酶AΔ9去饱和酶基因转录水平的影响 利用丙酮对照、保幼激素类似物(Methoprene acid)对5龄初期的棉铃虫幼虫进行注射,提取RNA,进行荧光定量分析.结果表明,注射保幼激素6 h时,对酰基辅酶AΔ9去饱和酶基因的转录表现出较强抑制作用(图6).

图4 酰基辅酶AΔ9去饱和酶基因在棉铃虫不同发育期的转录水平Fig.4 Developmental transcription level of acyl-CoA delta-9 desaturase

图5 饥饿处理后酰基辅酶AΔ9去饱和酶基因的转录水平Fig.5 Transcription level of hunger-inducted acyl-CoA delta-9 desaturase

图6 受保幼激素刺激后酰基辅酶AΔ9去饱和酶基因的转录水平Fig.6 Transcription level of Methoprene acid-inducted acyl-CoA delta-9 desaturase
2.4.2 注射蜕皮激素对棉铃虫酰基辅酶AΔ9去饱和酶基因转录水平的影响 利用体积分数为0.5%乙醇对照、蜕皮激素20E对5龄初期的棉铃虫幼虫进行注射,提取RNA,进行荧光定量分析.结果表明,在注射6 h之内无明显作用,在注射12 h时,有明显的促进作用,其相对转录水平最高.之后促进作用减弱(图7).
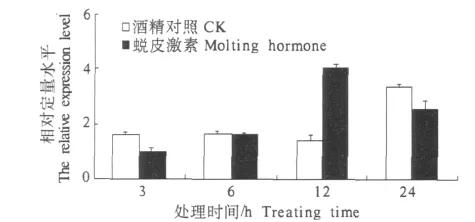
图7 受蜕皮激素刺激后酰基辅酶AΔ9去饱和酶基因的转录水平Fig.7 Transcription level of 20E-inducted acyl-CoA delta-9 desaturase
3 讨论
酰基辅酶A去饱和酶在真核细胞中是普遍存在的,对调控膜的流动性起着重要作用[10].在哺乳动物中,它不仅维持膜流动性,而且在脂肪酸代谢中起中心调节作用.因为酰基辅酶A去饱和酶是单不饱和脂肪酸(MUFA)生物合成的限速酶,有催化饱和脂肪酸的脂酰辅酶A脱氢的作用,其首选底物是软脂酰和硬脂酰辅酶A.而单不饱和脂肪酸生物合成过程中的关键的一步就是在Δ9位引入的第1个顺式双键(在C9与C10之间)[11].在昆虫中,酰基辅酶A去饱和酶在许多生物反应过程中起重要作用,如果蝇酰基辅酶AΔ9去饱和酶活性对其体内生理平衡、生长发育和雌性联系信息素的生物合成有极大影响[12,13].此外,酰基辅酶 AΔ9去饱和酶广泛存在于蛾类性信息素腺体中[14].所以,酰基辅酶A去饱和酶在昆虫中几乎所有的研究都集中于鳞翅目昆虫性信息素生物合成的过程.鳞翅类昆虫性信息素最普通的组成成分是不饱和脂肪酸(UFA)前体物的派生物,这些派生物在数量、位置、双键几何学方面都不一样.而不饱和脂肪酸(UFA)前体物是由酰基辅酶A去饱和酶在专门的性信息素腺体中表达而产生的[15,16].目前对酰基辅酶AΔ9去饱和酶基因的研究和认识越来越多,研究证明其在诸多重要的生物反应过程中担任重要角色.
本研究利用RT-PCR及RACE的方法[17]克隆了酰基辅酶AΔ9去饱和酶基因,序列分析结果显示出其氨基酸序列在昆虫中非常保守,其一致性高达80%以上.这种高度的一致性说明了酰基辅酶AΔ9去饱和酶基因在进化过程中是很保守的.
对于无脊椎的昆虫来说,蜕皮是一个生物学奇迹,也是目前昆虫生理生化研究的重点和难点.本研究分析了酰基辅酶AΔ9去饱和酶基因在棉铃虫中的时序的表达,发现该基因的表达与蜕皮激素的滴度变化相一致,推测可能是受蜕皮激素调控,进一步的激素处理也证实蜕皮激素诱导其表达,而保幼激素则抵消蜕皮激素对酰基辅酶AΔ9去饱和酶基因的诱导作用.昆虫性信息素主要组成成分为不饱和脂肪酸(UFA)前体物的派生物,而酰基辅酶AΔ9去饱和酶的去饱和作用催化了这些物质的形成.所以说,其在昆虫幼虫脂肪酸代谢过程中也一定起着重要作用.本试验尽管已经克隆了酰基辅酶AΔ9去饱和酶基因,并鉴定出了一些基本特性,但要阐明酰基辅酶AΔ9去饱和酶基因在棉铃虫幼虫的脂肪酸代谢过程中的具体作用还有待进一步的研究.
[1]KNIPPLE D C,ROSENFIELD C L,NIELSON R.Evolution of the integral membrane desaturase gene family in moths and flies[J].Genetics ,2002,162:1737 -1752.
[2]朱 敏,余龙江.脂酰脱饱和酶[J].生命的化学,2001(6):478-480.
[3]LUO C,MCSWAIN J L,TUCKER J S,et al.Cloning and sequence of a gene for the homologue of the stearoyl CoA desaturase from salivary glands of the tick Amblyomma americanum[J].Insect Mol Biol,1997,6:267 -271.
[4]WICKER-THOMAS C,HENRIET C,DALLERAC R.Partial characterization of a fatty acid desaturase gene in Drosophila melanogaster[J].Insect Biochem Mol Biol,1997,27(11):963 -972.
[5]LIU W,MA P W,MARSELLA-HERRICKP,et al.Cloning and functional expression of a cDNA encoding a metabolic acyl-CoA Δ9 desaturase of the cabbage looper moth,Trichoplucia ni[J].Insect Biochem Mol Biol,1999,29(5):435-443.
[6]JEFFCOAT R.The biosynthesis of unsaturated fatty acids and its control in mammalian liver[J].Essays in Biochemistry,1979,15:1-36.
[7]TIKU P E,GRACEY A Y,MACARTNEY A I,et al.Cold - induced expression of Δ9-desaturase in carp by transcriptional and posttranslational mechanisms[J].Science,1996,271:815-818.
[8]VIGH L,LOS D A,HOVATH I,et al.The primary signal in the biological perception of temperature:Pd-catalyzed hydrogenation of membrane lipids stimulated the expression of the desA gene in Synechocystis PCC6803[J].Proceedings of the National Academy of Science USA,1993,90:9090-9094.
[9]ROELOFS W L,BJOSTA D L.Biosynthesis of Lepidopteran pheromones.Bioorg Chem,1984,12:279-298.
[10]EIGENHEER A L,YOUNG S,BLOMQUIST G J,et al.Isolation and molecular characterization of Musca domestica delta-9 desaturase sequences[J].Insect Molecular Biology,2002,11(6):533 -542.
[11]郑 婷.多不饱和脂肪酸对动物脂酰辅酶A去饱和酶基因的影响及调控机制[J].畜禽业,2007(5):16-17.
[12]CARLSON D A,MAYER M S,SILLHACEK D L,et al.Sex attractant pheromone of the housefly:isolation,identification and synthesis[J].Science,1971,174:76-78.
[13]DILLWITH J D,NELSON J H,POMONIS J G,et al.A 13C-NMR study of methyl-branched hydrocarbon biosynthesis in the housefly[J].J Biol Chem,1982,257:11305-11314.
[14]KNIPPLE D C,ROSENFIELDC L,MILLER S J,et al.Cloning and functional expression of a cDNA encoding a pheromone gland-specific acyl-CoA D11-desaturase of the cabbage looer moth,Trichoplusia ni[J].Proc Natl Acad Sci USA,1998,95:15287-15292.
[15]ROELOFS W L.Chemistry of sex attraction[J].Proc Natl Acad Sci USA,1995,92:44 -49.
[16]TILLMAN J A,SEYBOLD S J,JURENKA R A,et al.Insect pheromones—an overview of biosynthesis and endocrine regulation [J].Insect Biochem Mol Biol,1999,29(6):481 -514.
[17]安世恒,杜孟芳,张传溪,等.棉铃虫核型多角体病毒(HaSNPV)ORF99基因在昆虫细胞中的表达及亚细胞定位[J].河南农业大学学报,2010,44(6):670 -674.

