TK酶基因在乳酸乳球菌中的表达
阿 荣,孟祥晨*,王丽群
(1.乳品科学教育部重点实验室,哈尔滨 150030;2.东北农业大学食品学院,哈尔滨 150030)
基因治疗是肿瘤治疗的一大趋势,自杀基因治疗是其一大热点,其中单纯疱疹病毒I型胸苷激酶基因(HSV1-TK)在自杀基因治疗中的应用更是得到了广泛的关注[1]。TK酶可将无毒的抗癌前体药物GCV代谢成磷酸化的GCV,后者是一种细胞毒性药物,能够作用于分裂期的细胞,掺入细胞DNA合成并抑制DNA聚合酶的活性,进而使细胞合成终止,从而达到杀死肿瘤细胞的目的[2]。从目前的研究结果来看,选择好的载体系统以提高基因治疗的靶向性、杀伤性和稳定性是提高基因治疗水平的关键。在载体选择方面,病毒载体的缺点在于能够造成正常细胞的损伤;非病毒载体如脂质体以及裸露的DNA的缺点在于靶向性不强。因此,以双歧杆菌等益生菌菌株作为安全无毒的载体在基因治疗中的应用前景不容忽视。Yazawa等在动物实验中,首次证实了长双歧杆菌可用作胸部实体瘤的基因治疗载体[3]。郭志英等构建了婴儿双歧杆菌介导的CD/5-FC肿瘤治疗系统,对小鼠黑色素瘤B16-F10细胞具有明显的体外杀伤效应[4]。Fujimori等则采用酶前体药物策略,利用长双歧杆菌携带无活性的前体药物,实现了高水平的厌氧菌靶向定植及较好的前体药物激活[5]。由于双歧杆菌对生长条件要求绝对厌氧,而且在乏氧的肿瘤生长环境中有很好的定植效果,这一点使其非常适用于作为基因治疗载体。但是由于双歧杆菌的基因组学研究尚未成熟,双歧杆菌重组质粒的构建及转化存在着一定的困难。
2001年伴随着第一株乳酸乳球菌IL1403全基因组测序的完成[6],迎来了乳酸菌基因组研究的时代,随后分离和鉴定了乳酸乳球菌大量的基因及其调控元件,作为乳酸菌中最具有代表性的模式菌株之一的乳酸乳球菌则在现代生物技术应用中扮演着越来越重要的角色[7-8]。同理作为兼性厌氧菌的乳酸乳球菌便具备了很好的基因治疗载体的条件,有待去研究与开发。本研究旨在利用乳酸乳球菌nisin诱导基因表达系统,表达TK基因,拟构建一种安全无毒的基因治疗的载体,为自杀基因治疗载体的可行性研究提供理论依据与技术支持。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒
质粒pGEX-6p-1-HSV1-TK,Lactococcus lactis NZ9000,表达质粒pNZ8148由本实验室保存。
1.1.2 培养基、主要试剂及仪器
GM17培养基用于乳酸乳球菌液体以及固体培养;SGM17MC(含有0.5 mol·L-1蔗糖,20 mmol·L-1MgCl2,2 mmol·L-1CaCl2的GM17培养基)用于点击后细胞的复苏。
主要试剂:工具酶和试剂盒包括PrimeSTAR®HS DNA Polymerase,限制性内切酶HindⅢ和NcoⅠ,T4DNA Ligase(均购自TaKaRa公司);质粒小提取试剂盒(购自天根生化科技(北京)有限公司);琼脂糖凝胶回收DNA试剂盒;DNA片段纯化试剂盒(购自TaKaRa公司);氯霉素、氨苄青霉素(购自Amersco公司);乳链球菌素(Nisin)(购自Sigma公司);其他试剂为国产分析纯。
仪器:电击池和电击仪(购自美国BioRad公司);9700PCR仪(购自美国Applied Biosystems公司);凝胶成像系统仪(购自美国UVP公司);
1.1.3 PCR引物
根据TK基因序列设计并合成一对引物,引物序列如表1所示。为便于克隆两引物引入了两个酶切位点—NcoⅠ和HindⅢ,在表格中以下划线指出了其具体作用位点。引物委托上海Invitrogen公司合成。

表1 基因扩增的引物序列Table 1 Sequence of primers for gene amplication
1.2 方法
1.2.1 质粒以及表达载体DNA的提取
质粒pGEX-6P-1-HSV1-TK的提取按照天根质粒小提试剂盒具体操作进行,pNZ8148质粒的提取,首先用含有30 mg·mL-1溶解酶的TE在37℃下作用于菌体40 min,后续步骤按照宝生物质粒提取试剂盒说明进行。
1.2.2 PCR扩增目的基因
用材料中所给引物P1和P2,对所提取的质粒pGEX-6P-1-HSV1-TK按以下50 μL的体系进行PCR扩增,具体组分为:2.5 U的PrimeSTAR HS DNA Polymerase,5×PCR 缓冲液(含Mg2+)10 μL,dNTPs(各 2.5 mmol·L-1)4 μL,DNA 模板各 4 μL,上下游引物(10 μmol·L-1)各 1 μL,剩余的用ddH2O补齐至50 μL进行PCR扩增。
反应条件如下:

1.2.3 质粒和目的基因片段的双酶切以及胶回收
在1 mL Ependorf管中加入下列反应体系:1 μL NcoⅠ,1 μL HindⅢ,2 μL 10× Buffer,2 μL 0.1%BSA,6 μL基因片段,8 μL去离子水。放入37℃金属浴中3 h。使用琼脂糖凝胶DNA回收试剂盒回收DNA片段,-20℃放置备用。
1.2.4 目的基因和载体连接
将T4DNA连接酶缓冲液1 μL加入灭菌的Ependorf管中,加入胶回收的载体DNA和目的DNA双酶切片断,使其浓度比为1∶3,室温下加入T4DNA连接酶1 μL,4℃反应过夜,即可用于转化。
1.2.5 电转化
按HoLo和Nes[9]方法制备电转化感受态,将1 μg重组质粒与40 μL的感受态细胞加入到冰预冷的电击杯(0.2 cm)中,在电压2.5 kV、电脉冲25 μF、电阻200 Ω条件下进行电穿孔。脉冲结束后将细胞悬浮液与0.96 mL冰冷的SGM17MC混合,冰上放置5 min。30℃培养2 h,待质粒抗性基因充分表达后,均匀地涂布于含有0.4 mmol·L-1CdCl2的GM17固体培平板上,30℃培养2 d。同时以未转抗性质粒的乳酸乳球菌做阴性对照,以转化pNZ8148质粒的细胞悬浮液作为阳性对照。
1.2.6 转化子的鉴定
提取转化子质粒后,用引物P1和P2进行PCR鉴定,并用酶切法进行酶切鉴定。由北京Invitrogen公司进行测序。测序结果进行DNAman软件分析,并在NCBI进行BLAST比对。重组质粒命名为pNZ8148-HSV1-TK。
1.2.7 重组TK酶的诱导表达及鉴定
将活化后的菌按2%的接种于M17液体培养基中,每隔2 h在600 nm处测吸光值(OD600),绘制重组菌pNZ8148-HSV1-TK的生长曲线。重组菌培养至对数前中期加入10 ng·mL-1Nisin进行诱导表达,2 h后收集菌体。溶菌酶处理后,进行全蛋白的SDS-PAGE,操作方法参见文献[10]。
2 结果与分析
2.1 TK基因的扩增
以实验室前期构建的重组质粒pGEX-6P-1-HSV1-TK DNA为模板,用引物P1和P2进行PCR扩增后,产物用1%琼脂糖凝胶电泳后,于凝胶成像系统下观察,在1 200 bp处得到了一条很清晰的条带,如图1所示。对PCR产物进行纯化回收,用于下一步实验。

图1 目的基因的PCR扩增结果Fig.1 PCR amplication of the target gene
2.2 重组表达质粒的鉴定
目的片段与克隆载体在经过HindⅢ和NcoⅠ双酶切后,酶切产物进行胶回收用于连接反应。连接产物电转化后,经过含有0.4 mmol·L-1CdCl2抗性的平板进行筛选。如图2所示,阴性对照的平板上没有菌落生长,转化了空载体pNZ8148质粒的阳性对照平板上菌落生长成片,将连接产物电转化之后的平板上长出了少数的单菌落。
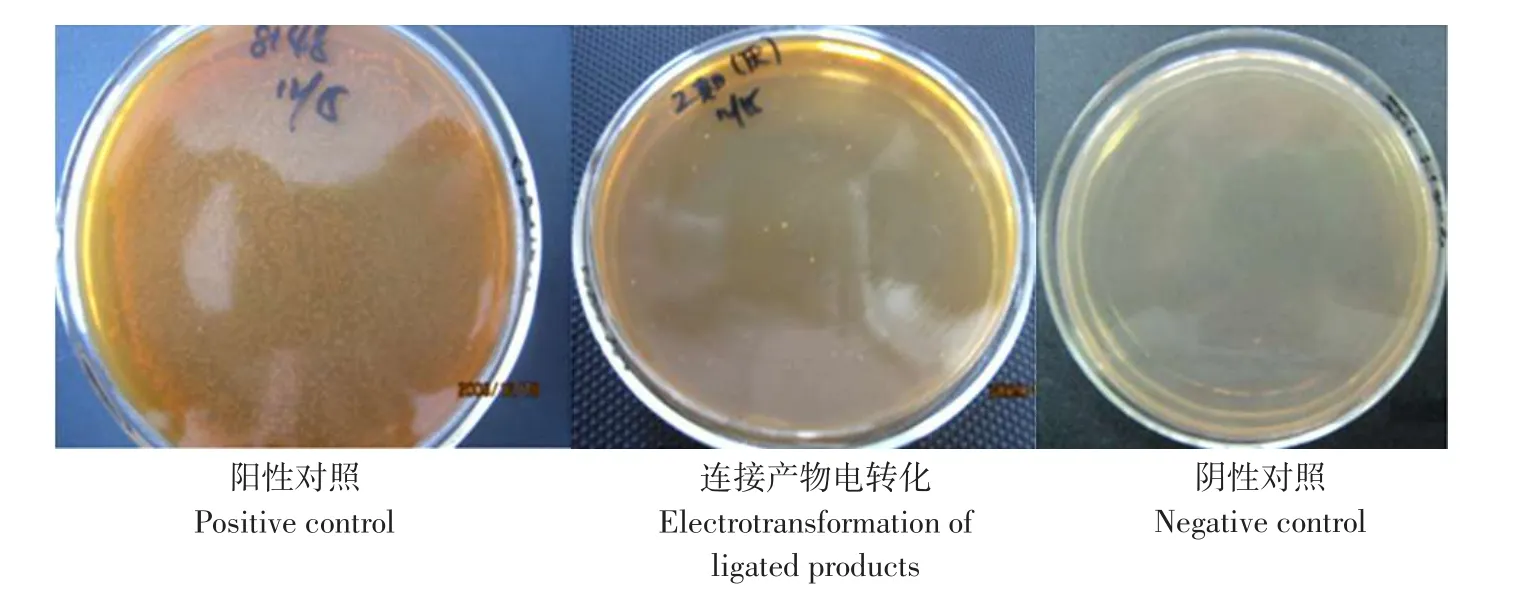
图2 连接产物电转化结果Fig.2 Results of electrotransformation
随机地挑取阳性克隆的单菌落,提取质粒进行双酶切鉴后,分别在1 200 bp大小与3 100 bp处获得目的条带,结果如图3所示。同时提取质粒进行PCR扩增,结果如图4所示,得到的重组质粒大小约为4 300 bp(第一泳道),PCR产物大小与目的基因大小一致,约1 200 bp左右,PCR产物送往Invitrogen公司进行测序。测序之后将得到的序列在NCBI上进行BLAST比对,该序列与Accession No.EU530625.1的Cloning vector pWSTK6基因相似度最高达到99%。因此判断重组质粒构建成功。
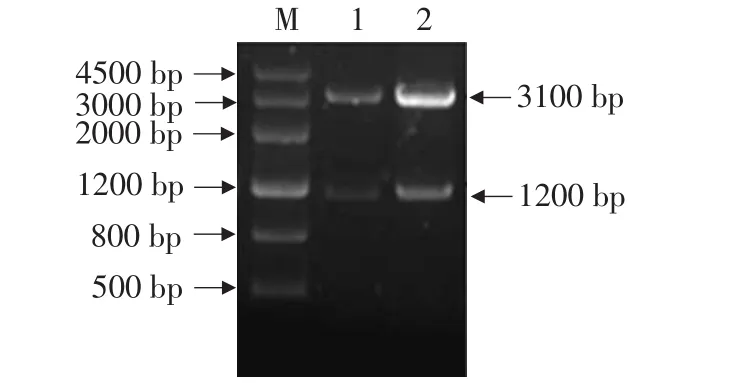
图3 重组质粒双酶切鉴定结果Fig.3 Identification of restrict product of pNZ8148-HSV1-TK

图4 重组质粒以及其PCR结果Fig.4 Recombinant plasmid and its PCR ptoducts
2.3 重组TK酶的SDS-PAGE鉴定
根据重组乳酸乳球菌NZ9000/pNZ8148-HSV1-TK的生长曲线(数据未列出),经过10 h培养重组菌达到对数前中期,此时加入10 ng·mL-1的Nisin进行诱导,诱导2 h后进行SDS-PAGE,结果如图5所示。重组菌泳道增加了一条41 ku左右的蛋白条带,与TK酶分子质量大小一致。含空载体pNZ8148的NZ9000经相同操作没有该条带(第一泳道),这说明重组质粒在乳酸乳球菌中得到稳定的表达。
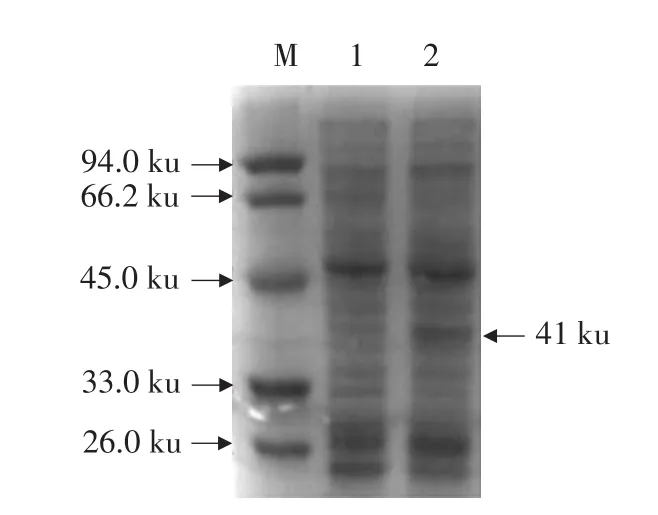
图5 表达产物SDS-PAGE电泳鉴定Fig.5 Identification of recombinant protein after expression by SDS-PAGE
3 讨论
TK基因自从1986年首次被用到自杀基因治疗肿瘤后以来,该基因已经慢慢的被广泛应用于各种系统的肿瘤基因治疗。美国等国家已经批准该基因用于临床治疗包括脑胶质瘤、黑色素瘤、前列腺癌、卵巢癌等在内的肿瘤[11]。在这些治疗中用到的载体有逆转录病毒、腺病毒载体等,这里提及到的基因治疗载体大致分为两大类:一是病毒载体:目前,世界各国绝大多数的基因治疗所用载体是经过改造的无害病毒载体,其具有天然的侵袭细胞和整合于宿主细胞的能力,转染效率高。但有研究表明,病毒载体具有免疫原性、细胞毒性作用等不足。二是非病毒载体:主要是依据病毒载体的缺陷来研制的,由于病毒载体靶向性差,进入人体后,分散于各种组织,进入肿瘤细胞甚少,严重影响了疗效,因此近年来各种能够高效、靶向地将功能基因运送到人体特定细胞的非病毒载体应运而生,非病毒转移载体安全,操作简便,但其转染率很低。
目前肿瘤基因治疗载体缺乏选择性,对于正常组织和肿瘤组织亲嗜性无明显差异,使载体进入体内后无法特异性地集中于肿瘤组织,而其所携带的目的基因往往会对正常组织产生毒副作用,造成机体损伤。所以,提高载体的靶向性是肿瘤基因治疗的研究热点[12]。人类和啮齿类动物的大多数肿瘤为实体瘤(癌症患者中约90%以上死于实体瘤),实体瘤中心都存在一个明显的低氧区。而一些厌氧菌,由于其趋低氧的特性可选择性的定植于实体瘤内[13-15]。解决了基因治疗载体选择性差的问题。
乳酸乳球菌的NICE系统是目前乳酸菌基因表达系统中发展最成熟的体系,本研究采用的表达载体pNZ8148/宿主菌NZ9000是近年来NICE系统中乳酸乳球菌基因表达研究的典型代表,该系统具有NICE系统的所有基本特征。我们构建的乳酸乳球菌pNZ8148-HSV1-TK属于一个食品级的宿主菌,对人体没有毒负作用、过敏反应,作为食品级宿主菌它们几乎都来源于食品及其食源性材料。我们构建载体用到的诱导物Nisin是乳酸乳球菌分泌的一种抗菌肽,经研究证实,对人体安全无毒害,现今已被大部分国家食品药品部门批准,是可以直接添加到食品中的天然防腐剂。因此该载体与其他的基因治疗载体相比使用时是安全的,并且乳酸乳球菌是一种兼性厌氧菌,可以在肿瘤体组织很好的定植。在接下来的研究中我们会将该载体用于体外实验来进一步研究其治疗癌症的作用,为自杀基因治疗的深入研究奠定基础。
4 结论
本研究利用两种限制性内切酶NcoⅠ和HindⅢ同时对重组质粒pGEX-6P-1-HSV1-TK的PCR产物进行酶切,将酶切产物插入乳酸乳球菌表达载体pNZ8148,电脉冲转化该重组载体到乳酸乳球菌NZ9000,经氯霉素抗性平板筛选、酶切鉴定和测序鉴定,结果表明已成功构建了乳酸乳球菌表达载体pNZ8148-HSV1-TK。含pNZ8148-HSV1-TK重组质粒的乳酸乳球菌用Nisin进行诱导表达,表达产物经SDS-PAGE鉴定表明,重组TK酶分子质量大小与预期一致,为41 ku。
[1]Zhang Y,Dai X M,David F.Kallmes,et al.Synthesis of a technetium-99m-labeled thymidine analog:a potential HSV1-TK substrate for non-invasive reporter gene expression imaging[J].Tetrahedron Letters,2004(45):8673-8676.
[2]Lee KA,Cho K J,Kim S H,et al.IL-18 E42A mutant is resistant to the inhibitory effects of HPV-16 E6 and E7 oncogenes on the IL-18-mediated immune response[J].Cancer Letters,2005,229(2):261-270.
[3]Yazawa K,Fujimori M,Nakamura T,et al.Bifidobacterium longum as a delivery system for cancer gene therapy of chemically induced rat mammary tumors[J].Breast Cancer Res Treat,2001,66(2):165-170.
[4]郭志英,任启伟,巴再华等.厌氧菌介导的CD/5-FC系统对鼠黑色素瘤的杀伤效应[J].医学研究杂志,2010,39(4):49-51.
[5]Nakamura T,Sasaki T,Fujimori M,et al.Cloned cytosine deaminase gene expression of Bifidobacterium longum and application to enzyme/pro-drug therapy of hypoxic solid tumors[J].Biosci Bio Technol Biochem,2002,66(11):2362-2366.
[6]Bolotin A,Wincker P,Mauger S,et al.The complete genome sequence of the lactic acid bacterium Lactococcus lactis ssp.lactis IL1403[J].Genome Research,2001,11:731-753.
[7]Morello E,Bermudez-humaran L G,Llull D,et al.Lactococcus lactis,an efficient cell factory for recombinant protein production and secretion[J].Journal of Molecular Microbiology and Biotechnology,2008,14:48-58.
[8]Mifune J,Grage K,Rehm B H.Production of functionalized biopolyester granules by recombinant Lactococcus lactis[J].Applied and Environmental Microbiology,2009,75(14):4668-4675.
[9]HoLo H,Nes I F.High-frequency transformation by electropotation of Lactococus lactis subsp.Cremoris growth with glycine in osmotically stabilized media[J].Applied and Environmental Microbiology,1989,55(12):3119-3123.
[10]萨姆布鲁克J,弗里奇E F,曼尼阿蒂斯T.分子克隆实验指南[M].2版.金冬雁,黎孟枫译.北京:科学出版社,2002:888-897.
[11]何祥梁,刘宝义.TK基因肿瘤治疗研究现状[J].国外医学肿瘤学手册,2000,27(6):329-331.
[12]楚雍烈,答嵘.肿瘤基因治疗载体在临床应用中的问题和研究进展[J].西安交通大学学报:医学版,2006,27(4):314-318.
[13]Price D J,Miralem T,Jiang S,et al.Role of vascular endo the lial growth factor in the stimulation of cellular invasion and signaling of breast cancer cells[J].Cell Growth Differ,2001,12(3):129-135.
[14]Bos R,van Diest P J,vander Groep P,et al.Expression of hypoxia-inducible factor 21A and cell cycle proteins in invasive breast cancer are estrogen receptor related[J].Breast Cancer Res,2004,6(4):450-459.
[15]Zhong H,Semenza G L,Simons J W.Up-regulation of hypoxiainducible factor 1 alpha is an early event in prostate carcinogenesis[J].Cancer Det and Prey,2004,28(2):88-93.
- 东北农业大学学报的其它文章
- 酶水解制备鲤鱼肉蛋白抗氧化肽

