二氧化碳的捕集及资源化研究进展
闫平科, 王来贵
(辽宁工程技术大学资源与环境工程学院,辽宁 阜新 123000)
各种含碳物质的燃烧、氧化,人和动物的呼吸活动,都会产生CO2。近年来,随着国民经济的快速发展,天然碳资源不断地被消耗,使大气中的CO2含量迅速增加,导致“温室效应”,这给社会和经济带来严重的负面影响[1]。鉴于新能源的开发与应用目前还存在技术及经济方面的极大困难,专家预测在今后50年间石化燃料仍将是世界的主要能源,故二氧化碳的排放量还将急剧上升,由此而产生的环境影响不容忽视。同时,CO2作为潜在资源在农业、轻工、机械、化工等行业有着广泛的应用。在此背景下,二氧化碳的回收、利用及相关的资源再生问题已成为全球关注的“热点”课题[2]。
1 二氧化碳的捕集方法分析
目前二氧化碳的捕集方法有:物理吸收法、物理化学吸收法、化学吸收法、变压吸附法、膜分离法及低温分离法。
1.1 物理吸收法
物理吸收法就是溶剂吸收CO2仅通过物理溶解作用,CO2与溶剂之间不发生化学反应。具体的物理吸收方法包括水洗法、PC法、Rectisol及NHD法等[3]。
物理吸收法适合于CO2分压较高,净化度要求低的情况,再生时不用加热,只需降压或气提,总能耗比化学吸收法低,但CO2分离回收率低,在脱CO2前需将硫化物去除。
1.2 化学吸收法
化学吸收法是利用CO2为酸性气体的性质,以弱碱性物质进行吸收,然后加热使其解吸,从而达到脱除CO2的目的。目前典型的化学吸收剂为烷基醇胺和热钾碱溶液。其中热钾碱法主要用于CO2分压和总压较高的气体中CO2的捕集,在中型化工厂应用较多,其缺点是溶液腐蚀性较强。烷基醇胺法主要有MEA、DEA法等。
化学吸收法适合于CO2分压较低、净化度要求高的情况,但再生时需要加热、能耗大。
1.3 物理化学吸收法
其特点是将2种不同性能的溶剂混合,使溶剂既有物理吸收功能又有化学吸收功能。溶剂的再生热耗比物理吸收法高又比化学吸收法低。
物理化学吸收法,净化度要求较高,总能耗介于化学吸收法和物理吸收法之间。用两种不同方法交替使用联合组成一个系统,可以发挥各自的长处,在某些情况下,可比采用其中任何一个单独方法节省操作费用。
1.4 变压吸附法
变压吸附法的基本原理是利用吸附剂对吸附质在不同分压下有不同的吸附容量、吸附速度和吸附力,并且在一定压力下对被分离的气体混合物的各组分有选择吸附的特性,加压除去原料气中的杂质组分,减压脱附这些杂质而使吸附剂再生。
变压吸附法的优点是工艺过程简单、能耗低、适应能力强,但此法的吸附容量有限,需要大量的吸附剂,吸附解吸频繁,自动化程度要求较高[4]。
1.5 膜分离法
膜分离法是根据在一定条件下,膜对气体渗透的选择性把CO2和其他气体分离开。
膜分离装置简单,投资费用比溶剂吸收法低,膜分离法的缺点是需要前级处理、脱水和过滤,难以得到高纯度的CO2。
1.6 低温分离法
可以用低温分离的方法从天然气中分离出CO2,在处理高含量的CO2时,特别是在与其他的工艺方法联合采用时,这是一种费用低廉的工艺[4]。各种方法的比较见下表。
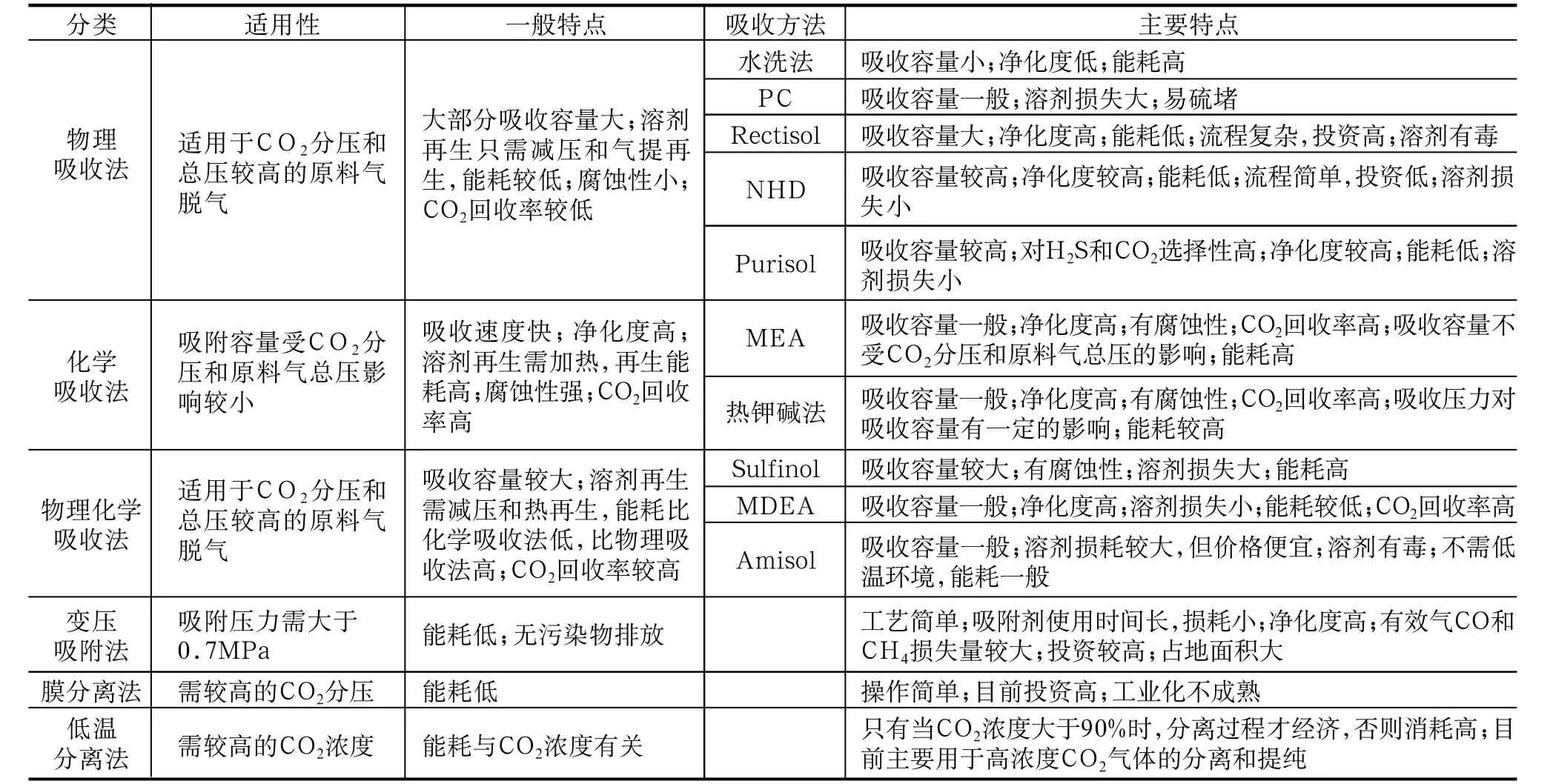
几种二氧化碳捕集方法比较
2 二氧化碳的资源化分析
据统计,目前全世界产生的二氧化碳超过240×108t,除150×108t被植物吸收外,90×108t排放到大气中,如何有效地利用二氧化碳已成为广大科技工作者的奋斗目标[5]。
2.1 二氧化碳的应用现状分析
二氧化碳具有较高的民用和工业价值,在多种领域有着广泛的应用,是一种非常宝贵的资源。不仅广泛应用在石油开采、冶金、焊接、低温冷媒、机械制造、人工降雨、消防、化工、造纸、农业、食品业、医疗卫生等方面,还可应用于超临界溶剂、生物工程、激光技术、核工业等尖端高科技领域。近年来开发出的新用途如棚菜气肥、蔬菜(肉类)保鲜、生产可降解塑料等也展现良好的发展前景[6]。
2.1.1 物理应用
(1) 用作惰性气体:CO2可用于电弧焊接、灭火材料、灭菌气体。
(2) 用作冷却剂:CO2可用于原子能反应堆的冷却剂、食品的冷却冷冻等。
(3) 用作压力剂:CO2可用作粉末灭火剂的压出剂、喷枪喷射剂、呼救船的气源、碳酸饮料、鲜啤酒压出剂、混凝土破碎。
(4) 用作清洗剂:超临界CO2可以用为一种清洗剂清除半导体晶片上的光刻胶,可对光学零件、电子器件、精密机械零件进行清洗[7]。
2.1.2 生物应用
(1) 用作气肥:CO2可用覆盖植物的气肥,能提高光合作用的效率,使产品早熟、产量提高。
(2) 用作果蔬保鲜剂:通过注入高浓度CO2,降低O2含量,以抑制果蔬中微生物呼吸和病菌发生[7]。
2.1.3 化学应用
(1) 传统应用:主要是合成尿素,苯酚羧化的科尔比反应,用CO2与金属或金属氧化物反应生成MgCO3、Na2CO3、NaHCO3、CaCO3、K2CO3、BaCO3等无机材料,以及其他一些化工产品,如白炭黑、轻质氧化镁等。
(2) 合成酯:CO2与环氧丙烷加压反应可制得碳酸丙烯酯。CO2在卤化季胺盐、卤化钙、或卤化镁催化条件下与环氧乙烷反应可制得碳酸亚乙酯。
(3) 合成胺:CO2在Cu/Al2O3催化剂条件下与H2、NH3反应可转化成胺类。CO2在Mo-Cu催化作用下与乙烯、H2、N H3反应生成丙胺。C O2与C6H11NH2在一定条件下反应可制得碳酸环己胺[7]。
2.2 二氧化碳的应用前景分析
(1) CO2与环氧化合物反应生成聚碳酸酯树脂。
利用CO2与环氧化合物反应生成聚碳酸酯树脂,合成产品可用于全生物降解及可控生物降解高回弹软泡、塑料母粒、粘合剂、涂料等领域[8]。
(2) CO2加氢合成甲醇。
有研究报道用铜基催化剂进行CO2+H2直接合成甲醇研究[9],取得很好的进展。催化剂表现出高的活性和选择性,具有一定的应用价值。
(3) CO2加氢生成乙醛。
华东理工大学范宾等[10]研究了二氧化碳在铑催化剂作用下合成乙醛,当n (CO2)/n (H2)=0.4、t =250℃,在3.3MPa条件下,原料气流速V =100mL/min时,在Rh-Ag/SiO2催化剂上乙醛的选择性可达43.36%;当n (CO2)/n (H2)=0.4、t =250℃,在3.3MPa条件下,原料气流速V =100mL/min时,在Rh-Ag-LiCl/SiO2催化剂上乙醛的选择性可达45.89%。二氧化碳在铑催化剂作用下合成乙醛的研究还需提高催化剂的性能[8]。
(4) CO2转化成塑料原料。
德国亚琛工大研究人员托马斯·米勒最近在美国化学协会年会上介绍了德国正在研究的将发电厂排放的大量二氧化碳转化成有用的塑料原料[8]。
(5) 其他。
还有CO2与氢气合成二甲醚、CO2加氢合成低碳烯烃、CO2和甲醇直接催化合成碳酸二甲酯、CO2加氢合成醋酸、CO2用作生物原料等。
综上所述,通过化学的方法实现CO2的资源化利用是一种非常理想的CO2减排途径,除了涉及到的环境效益以外,将CO2这种自然界大量存在的廉价碳源化合物转化为具有较高工业附加值的产品亦能够带来可观的经济效益[11-14]。因此,从各方面考虑,发展CO2资源化利用技术势在必行。
3 结语
二氧化碳作为石化燃料燃烧的副产物,对其进行回收和综合利用,不仅可提高原料总利用率,降低生产成本,提高产品市场竞争力,而且可改善工厂生产环境,为社会提供优质而丰富的二氧化碳产品,具有良好的社会效益和经济效益[15]。开展CO2资源化利用的研究既是机遇,又是挑战。这一领域的发展需要企业和科研机构的通力协作,同时政府应进行相应的政策引导,从而促进技术突破及节能减排,对于我国的社会经济发展意义重大。
[1]宿辉,崔琳.二氧化碳的吸收方法及机理研究[J].环境科学与管理,2006,31(8):79-81.
[2]黄黎明,陈赓良.二氧化碳的回收利用与捕集储存[J].石油与天然气化工.2006,35(5):354-357.
[3]李新春,孙永斌.二氧化碳捕集现状和展望[J].能源技术经济.2010,22(4):21-26.
[4]曾群英,伟宏,亚丽.二氧化碳分离回收技术及应用前景[J].华工科技市场.2008,31(6):12-14.
[5]刘恩莉.二氧化碳应用新进展[J].科技进展.2006(11):14-16.
[6]宋师忠,焦艳霞.二氧化碳用途徐述与生产现状[J].2003(12):12-15.
[7]周家贤.二氧化碳开发利用综述[J].化工设计,2004,14(4):7-8.
[8]张晓阳.二氧化碳气体综合利用研究进展[J].化肥设计,2009,47(3):26-28.
[9]凌华招.富二氧化碳合成气制甲醇铜基催化剂制备研究[J].天然气化工,2009,34(2):12-14.
[10]范宾,张成芳,陆岗,等.CO2加氢生成醋酸的研究[J].燃料化学学报,1997(6):95-98.
[11]田恒水,李峰,陆文龙,等.发展二氧化碳的绿色高新精细化工产业链促进产业结构优化节能减排[J].化工进展,2010,29(6):977-983.
[12]YORK A P E, XIAO T C, Green M L H, et al.Methane oxyforming for synthesis gas production[J].Catal.Rev-Sci.Eng.,2007,49(4):511-560.
[13]HU Y H, RUCKENSTEIN E. Binary MgO-based solid solution catalysts for methane conversion to syngas[J].Catal.Rev-Sci.Eng., 2002,44(3):423-453.
[14]BRADFORD M C J, VANNICE M A.CO2reforming of CH4[J].Catal. Rev-Sci.Eng., 1999,41(1):1-42.
[15]彭淑婧,任爱玲.烟气中二氧化碳资源化技术及应用前景[J].河北化工,2006,29(8):30-32.

