大叶冬青苦丁茶多糖提取、纯化与抗氧化活性研究
赵天湖,范嘉龙,闫 冬,徐人杰,郎昌野,孙 怡,曾晓雄
(南京农业大学食品科技学院,江苏南京 210095)
大叶冬青苦丁茶是我国民间传统的“代用茶”品种,系由大叶冬青(Ilex latif olia Thunb)叶加工而成。据报道,大叶冬青苦丁茶富含多酚类、萜类、氨基酸、皂苷和多糖等生物活性成分,具有清热解毒、杀菌消炎、健胃消积、止咳化痰、生津止渴、提神醒脑、明目益智和抗辐射、抗衰老、活血脉、调节血脂等功效[1~3]。以往对苦丁茶生物活性成分的研究主要集中在三萜类化合物、皂苷类化合物、多酚化合物以及挥发性成分的分析等方面[4~8]。近几年来,Sun、何玲玲等对苦丁茶冬青叶多糖的提取、纯化、体外抗氧化活性等进行了初步研究[9~13],但未见有关大叶冬青苦丁茶多糖的研究报道。本文采取热水提取与醇沉制备大叶冬青苦丁茶多糖,利用层析技术对其进行分离纯化,并对大叶冬青苦丁茶粗多糖及其纯化组分的体外抗氧化活性进行评价,旨在为我国特有药用植物的深层次开发利用研究提供理论基础。
1 材料与方法
1.1 材料、试剂与仪器
大叶冬青苦丁茶由浙江大学茶学系(浙江杭州)提供。
1,1-二苯基苦基苯肼(DPPH)、菲咯嗪、氯化硝基四氮唑蓝(NBT)、吩嗪硫酸甲酯(PMS)、还原型辅酶Ⅰ (NADH)、三吡啶吖嗪 (TPTZ),美国 Sigma公司;DEAE-52纤维素,Whatman公司;邻二氮菲、磷酸氢二钠、磷酸二氢钠、过氧化氢、硫酸亚铁、氯化铁、氯化亚铁、苯酚、浓硫酸、氯化钠、无水乙醇、氢氧化钠等试剂均为国产分析纯。
AY-120电子精密天平,日本 Shimadzu公司;Heidolph Laborota 4000真空旋转蒸发仪,德国Heidolph;722可见分光光度计,上海菁华科技仪器有限公司;Alpha1-2型冷冻干燥机,英国 LABCONCO公司;HL-2B数显恒流泵、BS-100A自动部份收集器,上海沪西分析仪器厂。
1.2 方法
1.2.1 多糖提取
大叶冬青苦丁茶多糖的提取参照何玲玲等[10]报道的方法并稍作改动。将大叶冬青苦丁茶磨碎,过 80目筛。称取一定量大叶冬青苦丁茶粉样,用 15倍体积的85%乙醇80℃回流提取2次,每次1h,以除去大部分脂类和多酚类物质。残渣用20倍体积的去离子水进行热提取 3次,水浴温度 90℃,每次提取时间3 h。提取液离心,合并3次上清液,置旋转蒸发仪 50℃减压浓缩至初始体积的1/4,再用 S-8大孔树脂脱色[14]。脱色液用sevage法脱蛋白3次,加3倍体积无水乙醇搅拌,过夜,离心,沉淀物经干燥后即为大叶冬青苦丁茶粗多糖(粗ILPS)。
1.2.2 粗多糖的纯化
粗 ILPS用水溶解,溶液上DEAE-52离子交换柱,并用去离子水、0.1、0.3和 0.5 mol/L NaCl溶液依次梯度洗脱,流速 1.0 mL/min,分步收集 (10 min/管),每梯度20管。用苯酚-硫酸法检测洗脱液中多糖的含量。根据洗脱曲线的主峰位合并收集液,50℃旋转蒸发浓缩,去离子水透析 48 h以去除NaCl及小分子杂质,最后将透析液冷冻干燥,得大叶冬青苦丁茶纯化多糖(ILPS-1,ILPS-2,ILPS-3和 ILPS-4)。
1.2.3 体外抗氧化活性的测定
(1)清除DPPH·自由基活性测定。DPPH·清除能力测定参考文献[15]的方法。取不同浓度的多糖样品溶液 1.0 mL于试管中,分别加入 0.3 mL DPPH·溶液(无水乙醇配制,0.4 mmol/L),再加入 2.0 m L水。混匀反应体系,30 min后于分光光度计517 nm处测定吸光值。以水代替样品溶液、无水乙醇代替DPPH·溶液,作空白实验调零用。清除效果依下面公式计算:
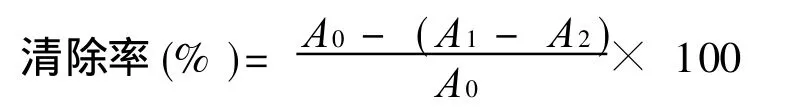
其中:A0为对照实验(水代替样品溶液)的吸光值;A1为样品实验的吸光值;A2为样品干扰实验(无水乙醇代替DPPH·溶液)的吸光值。
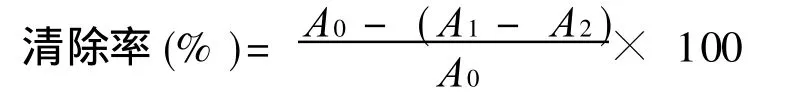
其中:A0为对照实验(水代替样品溶液)的吸光值;A1为样品实验的吸光值;A2为样品干扰实验(0.1 M pH7.4磷酸盐缓冲液代替NBT溶液)的吸光值。
(3)清除羟基自由基(·OH)活性测定。苦丁茶多糖对·OH的清除能力测定参考文献 [11]的方法,并作适当修改。在反应体系中分别加入 1 mL邻二氮菲(5 mmol/L),2 mL PBS缓冲液 (0.2 mol/L,pH7.4),充分混匀后,加入 1 mL FeSO4溶液(7.5 mmol/L),立即混匀,再向反应体系中加入不同浓度的多糖溶液 1 m L,混匀。另设阴性对照管和正常管,不加多糖溶液。再分别加入 1 mL0.01%的 H2O2溶液,正常管不加H2O2溶液,以等体积蒸馏水补充体积。在37℃水浴中反应30 min,测定 A536。清除能力依下面公式计算:

其中:A0正常管吸光值:1 mL邻二氮菲+2 mL PBS+1 mL FeSO4+2 mL H2O;A1阴性对照管吸光值:1 mL邻二氮菲+2 mL PBS+1 mL FeSO4+1 mL H2O+1 mL H2O2;A2样品管吸光值:1 mL邻二氮菲+2 mL PBS+1 mL FeSO4+1 mL样品溶液+1 mL H2O2。
(4)螯合金属离子能力测定。大叶冬青苦丁茶粗多糖及其纯化组分螯合金属离子能力的测定参照Yang等[17]的方法进行。取不同浓度的多糖溶液 1.0 m L于试管中,分别加入 0.05 mL氯化亚铁溶液(2.0 mmol/L)、0.2 mL菲咯嗪溶液(5.0 mmol/L)和 2.25 m L水。混匀反应体系,10 min后于分光光度计562 nm处测吸光值。以水代替多糖溶液和氯化亚铁溶液,作空白实验调零用。螯合能力依下面公式计算:
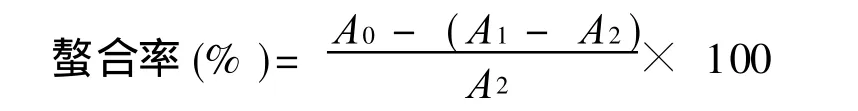
其中:A0为对照实验(水代替多糖溶液)的吸光值;A1为样品实验的吸光值;A2为样品干扰实验(水代替氯化亚铁溶液)的吸光值。
(5)总还原力测定。采用铁还原 /抗氧化能力(Ferric reducing/antioxidant power,FRAP)分析法[18]测定大叶冬青苦丁茶粗多糖及其纯化组分的总还原能力。
FeSO4标准曲线的绘制:依次取一系列浓度FeSO4溶液 1.0 mL于不同试管中,再分别加入 5.0 m L FRAP试剂。混匀反应体系,37℃水浴 10 min,于分光光度计593 nm处测吸光值。以FeSO4的浓度为横坐标,吸光值为纵坐标,绘制 FeSO4标准曲线。
样品抗氧化活性的测定:配制适当浓度的多糖溶液,取多糖溶液1.0 mL,加FRAP试剂5.0 mL。混匀反应体系,37℃水浴 10 min,于分光光度计 593 nm处测吸光值 A1。以水代替多糖样液,作空白实验调零用。以水代替 FeCl3溶液作为样品干扰管,测量 A2。
抗氧化能力的 FRAP值以每毫克样品达到同样吸光度(A1-A2)所需 FeSO4的摩尔数表示。
2 结果与分析
2.1 大叶冬青苦丁茶多糖的提取与纯化
30 g大叶冬青苦丁茶样经提取后,得到粗 ILPS 1.877 g,得率为 6.26%。
利用 DEAE-52层析柱对大叶冬青苦丁茶粗多糖进行分离,结果见图 1。从图中可以看出,粗 ILPS经DEAE-52层析柱分离后得到 4个主要组分,分别是水洗脱的组分 ILPS-1,0.1 mol/L NaCl溶液洗脱的组分 ILPS-2,0.3 mol/L NaCl溶液洗脱的组分 ILPS-3和 0.5 mol/L NaCl溶液洗脱的组分 ILPS-4。

图1 大叶冬青苦丁茶粗多糖经DEAE-52色谱柱的梯度洗脱曲线Fig.1 Stepwise elution curve of crude ILPS on DEAE-52chromatography column
2.2 粗ILPS及其纯化组分的体外抗氧化活性
2.2.1 大叶冬青苦丁茶多糖清除DPPH·自由基活性
DPPH·自由基是一种较稳定的自由基,已被广泛应用于抗氧化剂清除自由基活性的评价中[19]。图2反映的是大叶冬青苦丁茶多糖及其纯化组分清除DPPH·自由基的活性。从图中可以看出,在试验浓度范围内,大叶冬青苦丁茶多糖具有一定的清除 DPPH·自由基的能力,其清除活性与多糖浓度呈正相关。其中粗ILPS,ILPS-1,ILPS-2具有较强的清除DPPH·自由基能力;ILPS-3和 ILPS-4在试验浓度范围内清除能力相对较弱。在质量浓度为 1 000μ g/mL时,粗 ILPS,ILPS-1,ILPS-2,ILPS-3与 ILPS-4对DPPH·自由基的清除率依次为80.21%,65.28%,59.03%,37.50%与4.67%。
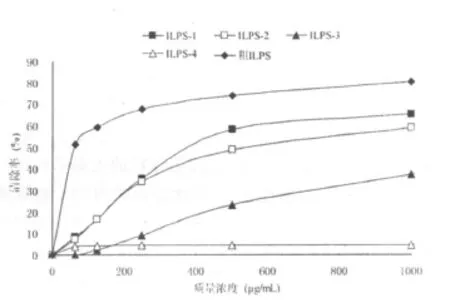
图2 大叶冬青苦丁茶粗多糖及其纯化组分清除DPPH·自由基活性Fig.2 The scavenging activities of crude ILPS and its purified fractions on DPPH·free radical

图3 大叶冬青苦丁茶粗多糖及其纯化组分清除活性Fig.3 Scavenging activity of crude ILPS and its purified fractions on
2.2.3 大叶冬青苦丁茶多糖清除羟自由基(·OH)活性
邻二氮菲-Fe2+氧化还原指示剂的颜色变化可敏锐地反映溶液氧化还原状态的改变,通过 Fenton反应产生的·OH是一种强氧化剂,邻二氮菲与·OH相互作用并产生有色物质,该物质在 536 nm下有最大吸收[21]。·OH在体内可以造成细胞损伤,从而会引起许多病理变化,故·OH清除率是反映药物抗氧化作用的重要指标。
大叶冬青苦丁茶多糖对·OH的清除作用见图4。

图4 大叶冬青苦丁茶粗多糖及其纯化组分清除·OH活性Fig.4 Scavenging activity of crude ILPS and its purified fractions on hydroxyl radicals
从图4可以看出,苦丁茶多糖对·OH具有一定的清除作用,且随着多糖浓度的增加,清除率上升。在质量浓度为 4 000μ g/mL时,粗 ILPS,ILPS-1,ILPS-2,ILPS-3和 ILPS-4的清除率分别为 78.86%,60.04%,60.27%,9.42%和0.64%。同阳性对照物Vc相比,粗ILPS在4 000μ g/mL时清除率与其接近,说明粗ILPS具有较强的清除·OH的能力。
2.2.4 大叶冬青苦丁茶多糖螯合金属离子能力
在体内,过渡金属离子起催化脂质过氧化过程的作用,从而导致多种疾病。在过渡金属离子中,Fe2+因其具有高的反应活性被认为是最重要的脂质过氧化促进剂。因此,对金属离子Fe2+的螯合能力被认为是评价药品抗氧化能力的方法之一。
图5反映的是大叶冬青苦丁茶粗多糖及其纯化组分螯合Fe2+的能力。从图中可以看出,Fe2+能够被大叶冬青苦丁茶多糖以剂量依赖方式所螯合。在0~2 000 μ g/mL质量浓度范围内,大叶冬青苦丁茶多糖表现出较好的螯合金属离子的能力,其螯合能力的大小顺序依次是 ILPS-4>粗 ILPS>ILPS-1>ILPS-2>ILPS-3。大叶冬青苦丁茶粗多糖及其纯化组分在低浓度范围内,螯合金属离子能力随浓度变化较明显,而在高浓度范围内变化较平稳。在质量浓度为2 000μ g/mL时,粗ILPS,ILPS-1,ILPS-2,ILPS-3和 ILPS-4的螯合率分别为66.15%,46.70%,11.27%,4.71%和76.29%。

图5 大叶冬青苦丁茶粗多糖及其纯化组分螯合金属离子能力Fig.5 Metal ion chelating activities of crude ILPS and its purified fractions
2.2.5 大叶冬青苦丁茶多糖的总还原力
大叶冬青苦丁茶中的抗氧化物质,可将 Fe3+-T PT Z复合物还原成深蓝色的 Fe2+-TPTZ复合物,该蓝色复合物在593 nm处有最大吸收值。因此可根据吸光值的大小计算样品抗氧化活性的强弱[18]。
本研究中,FRAP值(以每mg样品达到同样吸光度所需 FeSO4的mol数表示)被用来评价大叶冬青苦丁茶多糖(粗 ILPS,ILPS-1,ILPS-2,ILPS-3和 ILPS-4)的抗氧化能力。FRAP值越高,表明抗氧化物质还原的Fe2+越多,即抗氧化物质的抗氧化活性越强。FRAP法的FeSO4标准曲线线性回归方程为 y=0.0036x+0.0530,回归系数 R2= 1.0000。粗 ILPS,ILPS-1,ILPS-2,ILPS-3和 ILPS-4的 FRAP值分别是 307.5,47.2,37.5,11.8和 41.4 mol/mg,即大叶冬青苦丁茶多糖对 FRAP的总抗氧化活性顺序为粗 ILPS>ILPS-1>ILPS-4>ILPS-2>ILPS-3。
3 结论与讨论
大叶冬青苦丁茶粗多糖及其纯化多糖组分对DPPH·,和·OH都有一定的清除作用,具有较强的还原能力与螯合金属离子能力。从实验结果中可以看出 ,在 DPPH·,和·OH清除能力与总还原力测定中,大叶冬青苦丁茶粗多糖的抗氧化活性明显高于纯化组分的活性。这可能是由于分离纯化等操作去除了与多糖结合的成分,如蛋白、多酚等,而这些成分的存在可能会提高样品的抗氧化活性,同时多种多糖的相互作用也有可能提高其抗氧化活性,具体机理有待于进一步的研究。在螯合金属离子能力测定中,ILPS-4的螯合金属离子能力高于粗 ILPS与其它纯化组分,并且其具有较强的清除的能力。因此,大叶冬青苦丁茶多糖的结构与其抗氧化能力的关系有待于进一步的研究。
综上所述,大叶冬青苦丁茶多糖具有较强的体外抗氧化活性,大叶冬青苦丁茶多糖应是大叶冬青苦丁茶的主要功能成分。系统地研究其生物活性有利于有效、全面利用大叶冬青苦丁茶资源。
[1]庄辉发.大叶冬青苦丁茶的研究现状与发展前景[J].热带农业科学,2009,29(8):51-54.
[2]刘祖生.苦丁茶化学成分研究[J].浙江农业大学学报,1992,18(5):66-69.
[3]潘慧娟,廖志银,应奇才,等.苦丁茶大叶冬青的降脂作用研究 [J].茶叶科学,2004,24(1):49-52.
[4]欧阳明安,苏军华,刘玉青,等.苦丁茶冬青化学成分的结构研究 [J].天然产物研究与开发,1997,9(3):19-23.
[5]毛莉娟,刘学文,冉 旭.苦丁茶中黄酮的提取工艺 [J].食品技术,2002,(11):18-24.
[6]Liu L,Sun Y,Laura T,et al.Determination of polyphenolic content and antioxidant activity of Kudingcha made from Ilex kudingcha C.J.Tseng[J].Food Chemistry,2009,112:35-41.
[7]何 炜,屠幼英,胡丹竹,等.浙江省大叶冬青苦丁茶化学成分的分析 [J].浙江农业科学,2006,(1):44-46.
[8]牟利辉.江西婺源大叶冬青苦丁茶治疗高血压的临床疗效对比观察 [J].现代诊断与治疗,2005,16(4):223.
[9]Sun Y,Hu Z,Zhang D,et al.Extraction and antioxidant activities of polysacharides from Kudingcha made from Ilex kudingcha C.J.Tseng[J].Glycobiology,2009,19:1307-1308.
[10]何玲玲,王 新.苦丁茶冬青叶多糖的提取与鉴定 [J].沈阳化工学院学报,2006,20(1):12-15.
[11]王 新 ,何玲玲,刘 彬.苦丁茶冬青叶多糖的分离纯化及其对羟自由基的清除作用 [J].食品科学,2008,29(6):37-40.
[12]吴晓鹏,王一飞,刘秋英,等.苦丁茶多糖抗氧化活性研究 [J].食品与发酵工业,2008,34(2):34-36.
[13]何玲玲 ,陈尚东,兰丽艳.苦丁茶冬青叶多糖的组成分析[J].沈阳化工学院学报,2007,21(1):68-70.
[14]Liu J,Luo JG,Sun Y,et al.A simple method for the simultaneous decoloration and deproteinization of crude levan extract from Paenibacillus polymyxa EJS-3 by macroporous resin[J].Bioresource Technology,2010,101:6077-6083.
[15]林恋竹,赵谋明.反应时间对 DPPH·法、ABT S+·法评价抗氧化性结果的影响[J].食品科学,2010,31(5):63-67.
[16]Li X,Zhou A,Han Y.Anti-oxidation and antimicroorganism activities of purification polysaccharide from Lygodium japonicum in vitro[J].Carbohydrate Polymers,2006,66(1):34-42.
[17]YangXB,Gao XD,Han F,et al.Sulfation of a polysaccharide produced by a marine filamentous fungusPhoma herbarumYS4108alters its antioxidant properties in vitro[J].Biochimica et Biophysica Acta-General Subjects,2005,1725(1):120-127.
[18]Benzie IFF,Strain JJ.The ferric reducing ability of plasma as a measure of“antioxidant power”:the FRAP assay[J].Anal Biochem,1996,239:70-76.
[19]Hu F,Lu R,Huang B,et al.Free radical scavenging activity ofextracts prepared from fresh leaves of selected Chinese medicinal plants[J].Fitoterapia,2004,75(1):14-23.
[20]Taso R,Deng ZY.Seperation procedures for naturally occurring antioxidantphytochemicals[J].Journal Chromatography B,2004,812:85-99.
[21]金鸣蔡,亚 欣,李金荣,等.邻二氮菲-Fe2+氧化法检测H2O2/Fe2+产生的羟自由基[J].生物化学与生物物理进展,1996,23(6):553-555.

