单核细胞诱导同种异体血管内皮细胞产生干扰素诱导T细胞α型趋化因子的作用机制
高庆贞 朱彬 姬凌飞 王小平 任万军 徐何
受者免疫细胞向移植物的趋化和粘附是排斥反应过程的早期步骤,趋化因子在此过程中发挥重要作用。移植物血管内皮细胞(vascular endothelial cell,VEC)是供、受者之间的最早接触部位,能产生多种趋化因子,在排斥反应中具有重要意义。干扰素诱导蛋白10(interferon-inducible protein 10,IP-10)和干扰素诱导的T细胞α型趋化因子(interferoninducible T-cell alpha chemoattractant,I-TAC)属于趋化因子CXC亚家族。在发生急性排斥反应时,移植物中IP-10和I-TAC的表达会明显升高[1-2]。目前对于上述趋化因子生成的机制尚不明确。我们通过体外实验,观察单核细胞和VEC共培养后上清液中趋化因子浓度的变化,并研究 TNF和核因子(nuclear factor,NF)-κB细胞信号通路在其过程中的作用,以探讨同种异体移植后IP-10和I-TAC生成的机制。
1 材料与方法
1.1 材料和试剂
重组人TNF以及抗TNF抗体购自美国R&D systems公司。NF-κB通路阻断剂BAY11-7082购自Calbiochem公司。FBS牛胶质、胰酶和VEC生长因子购自Sigma公司。Multiplex试剂盒从Upstate公司获得。分离纯化单核细胞用的Ficoll来自Sigma公司,Percoll来自 Amersham公司。
1.2 VEC分离和培养
所有涉及人体组织的研究均通过医院伦理委员会和审查委员会审核批准。主动脉与胶原酶在37℃培养箱内培养后消化分离VEC。用RPMI 1640培养液洗涤1次,在M199培养液(含青霉素、链霉素各100单位、10%FBS、150 mg/L的VEC生长因子)中进行原代培养。待细胞长满80%~90%,消化传代,选用2~4代细胞。流式细胞仪检测vW因子的阳性率大于95%。
1.3 单核细胞分离、纯化和鉴定
取肝素化健康志愿者外周血,Ficoll密度梯度离心法获取外周血单个核细胞。用不含钙离子和镁离子的PBS洗涤3次,稀释到2×1010个/L后与Percoll细胞分离液均匀混合,常温下半径10 cm,2800 r/min,离心30 min分离淋巴细胞和单核细胞。流式细胞仪检测单核细胞CD14表达判定细胞纯度>95%。收集单核细胞,用含20%FBS的M199培养液调整细胞至1×109/L备用。
1.4 VEC与单核细胞共培养
VEC以5×105/孔加入6孔培养板,培养24 h后形成细胞单层。在VEC培养液中加入终浓度为10 μg/L 的 TNF,24 h 后取上清液检测 IP-10、I-TAC浓度,观察外源性TNF对VEC活化作用。另取吸除内皮细胞的培养基,加入制备的单核细胞悬液2×106个进行共培养,在24、48、72 h取培养上清液检测 TNF、IP-10、I-TAC 水平。
1.5 抗TNF抗体和BAY11-7082干预
在VEC和单核细胞共培养体系中,加入终浓度为1 mg/L的抗TNF抗体,在共培养24、48、72 h后,取细胞培养上清液和细胞检测细胞因子浓度和mRNA水平。用二甲基亚砜溶解NF-κB通路阻断剂BAY11-7082,在VEC培养液中加入10 mg/L BAY11-7082,置37℃的培养箱内培养12 h,然后洗涤VEC培养液3次清除BAY11-7082。BAY11-7082处理后的VEC加入单核细胞进行共培养。
1.6 细胞因子检测
取细胞培养上清液,加入到Upstate公司提供的培养板中,每份标本设为双孔,按照产品说明书进行操作,最后使用Multiplex检测系统测定上清液中TNF、IP-10、I-TAC的水平,并根据标准曲线自动计算细胞因子的浓度。
1.7 细胞因子基因表达检测
采用实时定量PCR技术测定单核细胞和VEC共培养前后TNF、IP-10、I-TAC基因表达水平。将细胞和Trizol试剂/肝糖RNA试剂分离液混合后,按照标准方法提取RNA。按照反转录试剂盒(美国罗氏公司产品)说明书进行操作,将RNA转换为cDNA。将cDNA标本100 ng均匀地加入到96孔检测板中,实时PCR检测每一孔中含有针对特异靶目标的上下游引物(900 nmol)和6-FAM(荧光标记物)标记的探针,用于内部对照的标本为18s核糖体(100 ng)、上下游引物及其VIC(荧光标记物)标记的探针(美国Applied Biosystems公司产品)。使用Applied Biosystems公司产7300型定量PCR仪进行检测和结果分析。
1.8 统计学处理
数据以均数±标准差表示,组间比较采用方差分析,统计学处理用SPSS 13.0软件完成。P<0.05为差异有统计学意义。
2 结果
2.1 外源性TNF对VEC产生IP-10、I-TAC的作用
加入终浓度为10 μg/L的TNF后VEC快速大量产生IP-10、I-TAC,24 h后培养液中 I-TAC、IP-10的浓度显著升高(P<0.01),见表1。
表1 外源性TNF对VEC产生IP-10、I-TAC的影响(±s,ng/L)
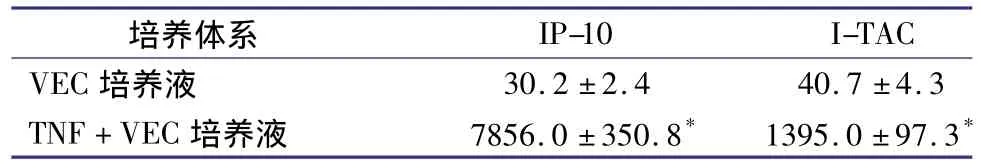
表1 外源性TNF对VEC产生IP-10、I-TAC的影响(±s,ng/L)
注:与VEC培养液比较*P<0.05。TNF,肿瘤坏死因子;VEC,血管内皮细胞;IP-10,干扰素诱导蛋白10;I-TAC,干扰素诱导的T细胞α型趋化因子
I-TAC VEC 培养液 30.2 ±2.4培养体系 IP-10 40.7 ±4.3 TNF+VEC 培养液 7856.0 ±350.8* 1395.0 ±97.3*
2.2 VEC和单核细胞共培养对TNF产生的影响
在单核细胞、VEC单独培养的上清液中,TNF的浓度很低,培养72 h后分别为(0.60±0.24)ng/L和(3.40±0.54)ng/L。当单核细胞和同种异体VEC共培养72 h后,上清液中TNF浓度明显升高,达到(64.6±6.9)ng/L,与单独培养差异均有统计学意义(均 P <0.01)。
2.3 VEC 和单核细胞共培养后 TNF、IP-10、I-TAC基因表达变化
与共培养前的单核细胞和VEC的混合细胞相比,共培养24、48 h后细胞上清液中 TNF、IP-10、ITAC基因均呈现明显上调;共培养72 h后,IP-10、ITAC基因表达仍维持在高水平,而TNF基因表达开始下降,见表2、图1。
表2 VEC和单核细胞共培养后TNF、IP-10、I-TAC mRNA相对表达量变化(±s)

表2 VEC和单核细胞共培养后TNF、IP-10、I-TAC mRNA相对表达量变化(±s)
注:表中的数据为相对于共培养前单核细胞和VEC混合细胞中各因子基因的倍增量。VEC,血管内皮细胞;TNF,肿瘤坏死因子;IP-10,干扰素诱导蛋白10;I-TAC,干扰素诱导的T细胞α型趋化因子
共培养时间(h)TNF IP-10I-TAC 24 3.5 ±0.6 12 ±1.3 7.9 ±1.2 5.8 ±0.7 48 8.9 ±0.4 33.5 ±2.7 8.7 ±1.0 72 0.57 ±0.03 16.6 ±2.1
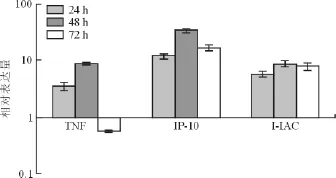
图1 单核细胞和VEC共培养后TNF、IP-10、I-TAC基因表达的变化
2.4 共培养体系IP-10和I-TAC浓度变化以及抗TNF抗体、BAY11-7082对 IP-10和 I-TAC生成的影响
单核细胞或VEC单独培养时,IP-10和I-TAC浓度均很低,不随培养时间延长而升高或仅有轻微升高。当单核细胞和内皮细胞共培养24 h后,上清液中IP-10和I-TAC的浓度开始升高;在共培养48和72 h后,上清液中IP-10和I-TAC的浓度明显升高。而在共培养体系中加入终浓度为1 ng/L的抗TNF抗体后,能消除共培养产生的趋化因子浓度升高(均P<0.05)现象,见表 3和图 2;使用 BAY11-7082也能消除趋化因子浓度上升(均P<0.05)的现象,见表4和图3。
表3 单核细胞和VEC共培养以及使用抗TNF抗体、BAY11-7082对IP-10生成的影响(±s,ng/L)

表3 单核细胞和VEC共培养以及使用抗TNF抗体、BAY11-7082对IP-10生成的影响(±s,ng/L)
注:与单核细胞+VEC比较*P<0.05。VEC,血管内皮细胞;TNF,肿瘤坏死因子;IP-10,干扰素诱导蛋白10
共培养时间(h)单核细胞 VEC 单核细胞+VEC 单核细胞+VEC+抗TNF抗体 单核细胞+VEC+BAY11-7082 24 10.3 ±2.3 8.9 ±2.9 27.5 ±3.3 17.8 ±3.8* 27.3 ±3.6*48 20.5 ±3.6 4.3 ±2.6 536.9 ±45.2 50.2 ±10.6* 38.6 ±8.7*72 36.5 ±4.1 9.2 ±2.4 820.6 ±52.9 102.8 ±21.5* 287.1 ±30.9*
表4 单核细胞和VEC共培养以及使用抗TNF抗体、BAY11-7082对I-TAC生成的影响(±s,ng/L)

表4 单核细胞和VEC共培养以及使用抗TNF抗体、BAY11-7082对I-TAC生成的影响(±s,ng/L)
注:与单核细胞+VEC比较*P<0.05。VEC,血管内皮细胞;TNF,肿瘤坏死因子;I-TAC,干扰素诱导的T细胞α型趋化因子
共培养时间(h)单核细胞 VEC 单核细胞+VEC 单核细胞+VEC+抗TNF抗体 单核细胞+VEC+BAY11-7082 24 2.2 ±0.31 12.8 ±2.5 11.4 ±2.5 7.4 ±1.3* 8.9 ±1.2*48 1.4 ±0.24 13.3 ±1.6 37.3 ±4.3 14.7 ±2.6* 16.1 ±3.1*72 2.1 ±0.36 16.2 ±3.3 77.3 ±5.5 20.8 ±3.9* 30.6 ±1.6*
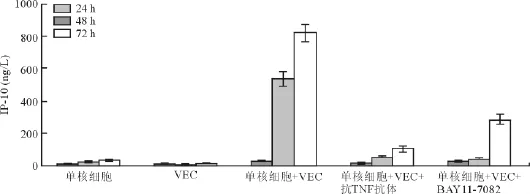
图2 单核细胞和VEC共培养以及使用抗TNF抗体、BAY11-7082对IP-10生成的影响
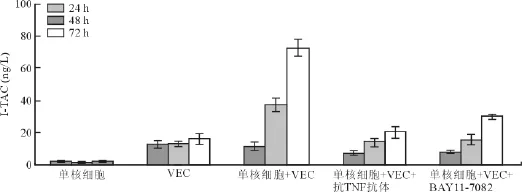
图3 单核细胞和VEC共培养以及使用抗TNF抗体、BAY11-7082对I-TAC生成的影响
3 讨论
器官移植后最早聚集到移植物的免疫细胞是单核细胞,然后发生淋巴细胞的趋化反应[3]。即使术前清除T淋巴细胞,仍然会发生急性排斥反应[4],而清除受者的单核细胞后则不会发生排斥反应[5]。因此单核细胞在移植免疫早期具有重要意义。体外研究显示,单核细胞能与同种异体VEC发生高水平的粘附,随后相互活化,诱导VEC表达HLA-DR以及CD54、CD62等黏附分子[6]。在众多趋化因子中,IP-10和I-TAC具有强大的趋化效应,能够诱导T淋巴细胞和NK细胞聚集。研究已明确,T淋巴细胞能刺激同种异体VEC活化并产生IP-10和I-TAC等趋化因子[7],但单核细胞对上述趋化因子的效果和机制尚不清楚。
在以往的研究中,用实时定量PCR技术检测VEC和同种异体单核细胞共培养后IP-10和I-TAC mRNA表达情况,结果显示在共培养24 h后细胞内IP-10和I-TAC mRNA表达水平显著增加,且48 h和72 h后表达维持在较高的水平[8]。在本实验中,采用Multyplex技术检测上清液中两种趋化因子浓度,结果,单独培养的单核细胞和VEC上清液中仅能检测到微量的IP-10和I-TAC,但在共培养24 h后两种趋化因子的浓度开始升高,48、72 h后明显升高。这些结果都表明单核细胞和VEC共培养能活化产生IP-10和I-TAC。
单核细胞和VEC的活化反应是直接黏附反应,但同时也需要细胞因子的参与[9]。对T淋巴细胞的研究发现,T淋巴细胞主要通过产生IFN-γ刺激VEC产生IP-10和I-TAC[10]。单核细胞在体内活化后能产生TNF、IL-6、IL-12、IL-18等多种因子,但不包括 IFN-γ。外源性 TNF能刺激 VEC生成CX3CL1等趋化因子[11];在单核细胞与VEC反应产生细胞间黏附分子-1和血管细胞间黏附分子-1的过程中,TNF也发挥重要作用[12]。为了研究 TNF在IP-10和I-TAC生成过程中的作用,本实验中首先加入培养液终浓度为10 μg/L的外源性TNF。结果表明,24 h后上清液中IP-10和I-TAC的浓度快速大量升高。这表明外源性TNF是一种强效的刺激因子,能直接刺激VEC生成IP-10和I-TAC。单核细胞、VEC单独培养时,培养液中TNF浓度都很低;而当两种细胞共培养后,TNF在基因转录水平和表达上都有明显升高,这表明单核细胞和同种异体VEC共培养能使单核细胞发生活化反应产生TNF。由于单核细胞和VEC的共培养体系中会生成内源性TNF,这些内源性的TNF应该也能导致IP-10和I-TAC生成增加。实验中对共培养上清液趋化因子的监测结果也证实这一点。而在共培养体系中加入抗TNF抗体后IP-10、I-TAC产量被抑制,这进一步说明 TNF在生成 IP-10、I-TAC过程中的关键性作用。
TNF主要通过激活 NF-κB、Caspase蛋白酶、ERK等信号通路产生其多种生物学效应。对于VEC而言,NF-κB途径在VEC活化生成趋化因子(如单核细胞趋化蛋白-1)以及细胞间黏附分子(如CD54、CD62E、CD62P和 CD106)的过程中发挥重要作用[13]。NF-κB 静息状态下与 NF-κB 抑制因子IκBα结合以非活性状态存在细胞浆中,受到外界刺激活化后,IκBα发生磷酸化降解,NF-κB得以进入细胞核发生作用。应用BAY11-7082可以抑制IκBα 发生磷酸化,阻止 NF-κB 活化[14]。以往的实验结果表明,BAY11-7082可以阻断重组人TNF诱导或者 CD40-CD154间反应所诱导的VEC活化[15-16]。本实验使用10 mg/L的BAY11-7082预处理VEC 12 h,可以抑制共培养导致的IP-10、I-TAC升高。由此可以推断,在单核细胞与VEC参与的免疫反应中,主要通过NF-κB信号通路刺激VEC产生IP-10、I-TAC等趋化因子。
综上所述,单核细胞和VEC共培养时,能够生成IP-10、I-TAC等趋化因子,在此过程中,TNF和NF-κB信号通路发挥重要作用。因此提示同种异体器官移植后,供者的单核细胞聚集到移植物局部,与VEC接触并活化。单核细胞活化后产生TNF,再进一步通过NF-κB信号通路刺激VEC产生IP-10、I-TAC等趋化因子,参与移植后排斥反应。应用抗TNF抗体或者NF-κB信号通路阻断剂,能够抑制单核细胞与VEC免疫反应中IP-10、I-TAC等趋化因子的生成,从而降低器官移植后排斥反应的发生率。
1 Zhao DX,Hu Y,Miller GG,et al.Differential expression of the IFN-gamma-inducible CXCR3-binding chemokines,IFN-inducible protein 10,monokine induced by IFN,and IFN-inducible T cell alpha chemoattractant in human cardiac allografts:association with cardiac allograft vasculopathy and acute rejection[J].J Immunol,2002,169(3):1556-1560.
2 Panzer U,Reinking RR,Steinmetz OM,et al.CXCR3 and CCR5 positive T-cell recruitment in acute human renal allograft rejection[J].Transplantation,2004,78(9):1341-1350.
3 Hoffmann SC,Kampen RL,Amur S,et al.Molecular and immunohistochemical characterization of the onset and resolution of human renal allograft ischemia-reperfusion injury[J].Transplantation,2002,74(7):916-923.
4 Kirk AD,Mannon RB,Kleiner DE,et al.Results from a human renal allograft tolerance trial evaluating T-cell depletion with alemtuzumab combined with deoxyspergualin[J].Transplantation,2005,80(8):1051-1059.
5 Jose MD,Ikezumi Y,van Rooijen N,et al.Macrophages act as effectors of tissue damage in acute renal allograft rejection[J].Transplantation,2003,76(7):1015-1022.
6 王小平,刘子栋,朱彬,等.低温缺氧条件下血管内皮细胞的基因表达及与单核细胞间的相互作用[J].中华器官移植杂志,2007,28(10):589-594.
7 Raju R,Malloy A,Shah T,et al.Alloimmune induction of endothelial cell-derived interferon-γ-inducible chemokines[J].Transplantation,2003,75(7):1072-1074.
8 高庆贞,王璞,王琪,等.同种异体单核细胞活化血管内皮细胞产生IP-10、I-TAC的体外研究[J].山东大学学报(医学版),2010,48(6):45-48.
9 Takahashi M,Ikeda U,Masuyama J,et al.Monocyte-endothelial cell interaction induces expression of adhesion molecules on human umbilical cord endothelial cells[J].Cardiovasc Res,1996,32(2):422-429.
10 Marx N,Mach F,Sauty A,et al.Peroxisome proliferator-activated receptor-gamma activators inhibit IFN-gamma-induced expression of the T cell-active CXC chemokines IP-10,Mig,and I-TAC in human endothelial cells[J].J Immunol,2000,164(12):6503-6508.
11 Matsumiya T,Ota K,Imaizumi T,et al.Characterization of synergistic induction of CX3CL1/fractalkine by TNF-alpha and IFN-gamma in vascular endothelial cells:an essential role for TNF-alpha in posttranscriptional regulation of CX3CL1[J].J Immunol,2010,184(8):4205-4214.
12 Funayama H,Ikeda U,Takahashi M,et al.Human monocyte-endothelial cell interaction induces platelet-derived growth factor expression[J].Cardiovasc Res,1998,37(1):216-224.
13 Zhou Z,Connell MC,MacEwan DJ.TNFR1-induced NF-kappaB,but not ERK,p38MAPK or JNK activation,mediates TNF-induced ICAM-1 and VCAM-1 expression on endothelial cells[J].Cell Signal,2007,19(6):1238-1248.
14 Ghosh S.Regulation of inducible gene expression by the transcription factor NF-κB[J].Immunol Res,1999,19(2-3):183-189.
15 朱彬,王璞,刘子栋,等.核转录因子-κB通路在CD40-CD154诱导血管内皮细胞活化中的作用[J].中华器官移植杂志,2008,29(4):204-207.
16 Zhu B,Liu Z,Wang P,et,al.A nuclear factor-kappaB inhibitor BAY11-7082 inhibits interactions between human endothelial cells,T cells,and monocytes[J]. Transplant Proc, 2008,40(8):2724-2728.

