基因Hath1表达对结肠癌细胞的抑制作用
赵丽丽,刘忠,张渝洁
Hath1 也称作 ATOH1(atonal homolog 1),是一个碱性螺旋-环-螺旋结构(basic helix-loop-helix,bHLH)的转录因子。Hath1 基因与果蝇属 atonal基因和鼠 Math1(mouse atonal homolog 1)基染色体同源,定位于人染色体 4q22,mRNA 长 1065 bp,编码蛋白 38 kD[1]。结肠癌是常见的恶性肿瘤,发病率逐年上升,Hath1 基因能促进肠分泌细胞包括杯状细胞(goblet)的终末分化,并诱导黏蛋白 2(mucin 2)的表达[2]。在结肠癌发生的渐进累积过程中,杯状细胞逐渐减少甚至消失,黏蛋白也明显减少[3]。在绝大多数结肠癌中 Wnt 信号一直处于活化状态[4],使得 Hath1 的表达受到抑制。而Hath1 基因的表达可以促进结肠分泌细胞的分化,Hath1 基因表达的缺失限制了分泌型细胞的分化。因此尝试在结肠癌中表达 Hath1 基因,研究 Hath1在结肠癌中是否可以发挥肿瘤抑制基因的作用。
1 材料和方法
1.1 材料
1.1.1 试剂 肿瘤细胞 HT-29、LS174T、SW480、SW620、IEC-6 购自上海生命科学院;Lipofectamine Reagent 转染试剂盒购自美国 Invitrogen 公司;RT-PCR 试剂盒购自宝生物工程(大连)有限公司;MTS 购自美国 Promega 公司;trizol 购自上海生物工程公司;DNase I 购自大连宝生物公司;荧光染料超混合液购自美国 BioRad 公司;细胞 RNA抽提试剂盒购自上海华舜生物工程有限公司;pcDNA3.1(+) 大肠杆菌菌保(DH5 a)菌株由本公司保存。
1.1.2 仪器 FCAS440 流式细胞仪为美国 BD公司产品;Model 680 酶标仪为美国 BioRad 公司产品;7700 型实时荧光定量 PCR 仪为美国Applied Biosystems 公司产品。
1.2 方法
1.2.1 总 RNA 的提取 肿瘤细胞在 10cm 培养板中培养到 80%密度的时候,用 trizol 试剂提取细胞总 RNA。吸去细胞培养液,加入 3 ml trizol试剂,轻轻摇匀,室温放置 5min 使细胞裂解完全,收集裂解液于离心管中,加 300 µl 氯仿剧烈摇匀,室温放置 2min,4℃12 000×g离心 15min,取上层水相到另一离心管内,加入 750 μl 异丙醇摇匀,室温放置 10min,4℃12 000×g离心 10min,弃去上清,用 1 ml 焦碳酸二乙酯(DEPC)–75%乙醇洗涤沉淀,晾干,溶解于 100 µl DEPC 水中。加11.3 µl 10×DNase I (脱氧核糖核酸酶)缓冲液,2 µl DNase I,42℃处理 25min,用分光光度计定量 RNA 浓度。组织总 RNA 的提取,在超声破碎组织后以同法用 trizol(总 RNA 抽提试剂)试剂提取。
1.2.2 定量逆转录 PCR 法测 Hath1 的表达 取3 µg 总 RNA 于 PCR 管中,加 3 µl random primer p(dN)6(随机引物)80 ng/µl,1.5 µl 10mmol/L dNTPs,加双蒸水至 16 µl,于 PCR 仪中 65℃加热 5min,冷却至 4℃,加 6 µl 5×First Strand Buffer(合成第一链缓冲液),3 µl 50mmol/L MgCl2,3 µl 0.1 mol/L 二硫苏糖醇(DTT),2 µl RNaseOUT(重组核糖核酸酶抑制剂),4℃5min,25℃2min,加 80 UnitsmmLV(莫洛尼鼠白血病病毒)逆转录酶,25℃10min,42℃50min 进行 cDNA 的第一链合成。75℃10min 失活逆转录酶,合成的cDNA 保存于 –20℃备用。
取 2 µl cDNA,加 10 µl 荧光染料超混合液,0.6 µl 10 µmol/L 引物,加水至 20 µl,在定量 PCR仪上检测基因的表达水平。以 beta-actin 基因作为对照。引物序列如下:
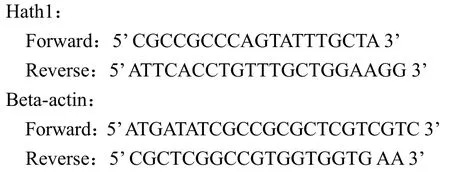
1.2.3 细胞培养及转染 人肿瘤细胞 HT-29、LS174T、SW480、SW620 培养于 10%的胎牛血清的 RPMI 培养液中,在培养 48 h 后接种于6 孔板,按照 Lipofectamine 说明书进行脂质体转染。
1.2.4 MTS 法测细胞增殖率 细胞增殖率用MTS 法测定。肿瘤细胞 HT-29、LS174T、SW480、SW620 在瞬时转染 pcDNA3.1 或者 pcDNA3.1-Hath1 24 h 后,以每孔 1000 个细胞铺于 96 孔板内,加 0.5%的血清于 37℃培养箱中培养 24 h。在测定前 1 h 加 MTS 到细胞中。具体方法参考试剂盒说明书。
1.2.5 IEC-6 稳定表达 Hath1 siRNA 细胞系的构建 RNA 干扰通过小发卡或短发卡 RNA(shRNA)实现。首先构建载有 Hath1 特异性 shRNA 的表达质粒载体 MSCV-LTRmiR30-PIG,将其转染 LinX-1细胞包装逆转录病毒载体,48 h 后收集含有逆转录病毒载体的细胞培养液,经 0.45 μm 的滤膜除去细胞及碎片,病毒冻存于 –80℃备用。
IEC-6 细胞以 200 μl 病毒液感染,感染的同时加 5 μg/ml 的聚凝胺(polybrene)提高病毒的感染效率。IEC-6 细胞以不含 shRNA 的病毒载体感染作为阴性对照。成功整合了病毒基因组的细胞会表达载体上的绿色荧光蛋白(GFP)。转染了病毒的细胞用 2 μg/ml 的嘌呤霉素筛选 2 周。筛选后的具有药物抗性的细胞采用实时荧光定量 PCR 和Western blot 方法分别从基因和蛋白质水平评价shRNA 对 Hath1 基因的干扰效应,并筛选出干扰效率最高的克隆。shRNA 的序列:AAACGACAAG AAGCTGTCCAAATAGTGAAGCCACAGATGTAT TTGGACAGCTTCTTGTCGTTG。
1.2.6 流式细胞仪检测细胞凋亡百分率 细胞处理后,收集悬浮细胞于离心管,连同贴壁细胞视情况用胰酶消化后制成单细胞悬液同悬浮细胞合并。(700~1000)×g离心 5min,用 PBS 漂洗,重复离心,漂洗。用 70%乙醇固定,4℃过夜。离心,弃固定液,PBS 洗两次并重悬细胞。加100 μl RNase A(0.5 mg/ml)至总浓度为50 μg/ml,37℃30min。再加入 400 μl 碘化丙啶(PI)染色液(100 μg/ml PI,1%Triton X-100,0.9%NaCl)至总浓度为50 μg/ml,混匀,避光保存 30min。上机测试,记录激发波长 488 nm。以标准程序用FACScan 流式细胞仪检测细胞内亚二倍体凋亡峰,使用 Mac V1.01 版本的 Cellquest 和 Modfit LT软件分析。
1.3 统计学分析
应用 SPSS10.0 统计学软件进行统计分析,两组间比较采用组成设计t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 Hath1 基因的表达
对 4株结肠癌细胞,一株大鼠小肠上皮细胞IEC-6 以及正常人小肠与结肠组织提取总 RNA,然后进行定量 PCR(图1)。
结果显示:在正常人的小肠与结肠组织中有着比较高水平的 Hath1 的表达,结肠中的表达比小肠高。此外,在大鼠小肠上皮细胞 IEC-6 中也有着较多 Hath1 的表达。而在 4株结肠癌细胞中Hath1 的表达都很低,尤其在转移瘤 SW480 细胞中几乎无表达。这些结果表明 Hath1 基因在肿瘤细胞中的表达低于正常组织,可能起着肿瘤抑制基因的作用。
2.2 Hath1 基因对结肠癌细胞增殖的影响
结肠癌细胞中的 Hath1 表达很低或是几乎无表达,为研究 Hath1 对结肠癌细胞的作用,在 4株结肠癌肿瘤细胞中过表达人的 Hath1 基因,通过MTS 法测定细胞的增殖率(图2)。
实验结果表明,在所有 4株结肠癌细胞中Hath1 的表达都显著地抑制了肿瘤细胞的增殖。在SW480 细胞中,细胞增殖率被抑制了 38.5%;在HT29 中细胞生长被抑制了 23.4%;而在 LS174T细胞中抑制率达到 55%。结果证明 Hath1 基因抑制了结肠癌细胞的增殖。
2.3 Hath1 基因的表达对结肠癌细胞凋亡的影响
为进一步阐明 Hath1 抑制结肠癌肿瘤细胞生长的机制,研究 Hath1 对结肠癌细胞 LS174T 的凋亡诱导作用(图3)。实验表明,LS174T 细胞过表达 Hath1 与对照组相比并无统计学差异。即Hath1 本身并不能有效地诱导肿瘤细胞的凋亡,其肿瘤生长抑制作用不是通过凋亡诱导实现的。但是,过表达 Hath1 的结肠癌细胞对化疗药物 5-FU引起的凋亡由对照组的 21.3%上升到 28.5%。即Hath1 的表达提高了肿瘤细胞对化疗药物的敏感性。
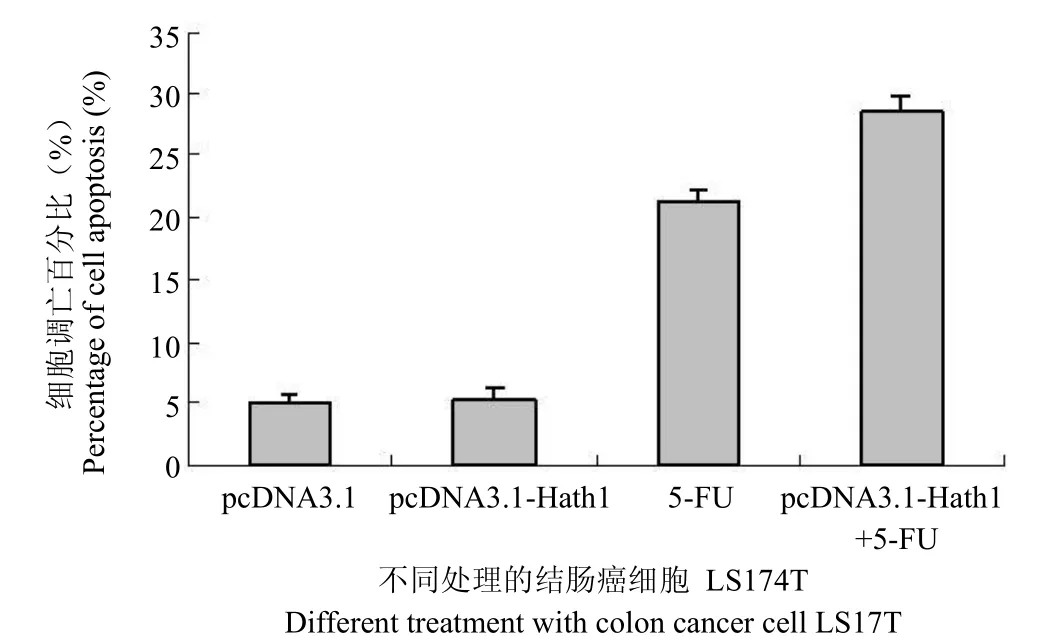
图3 Hath1 基因对结肠癌细胞凋亡的影响Figure 3 The effect of Hath1 gene on the colon cancer cell apoptosis
2.4 正常细胞中下调 Hath1 的表达可提高细胞的生长率
在结肠癌细胞中的试验表明提高 Hath1 的表达抑制了结肠癌细胞的生长。图1 结果显示正常细胞中有着较高水平的 Hath1 表达。针对大鼠中的 Hath1 同源基因设计的 siRNA 干扰试验抑制大鼠 Hath1 同源基因的表达水平(图4)。Hath1 基因被抑制的 IEC-6 细胞显示出了显著的细胞生长率的提高,从另一方面证明了 Hath1 起着肿瘤抑制基因的作用。
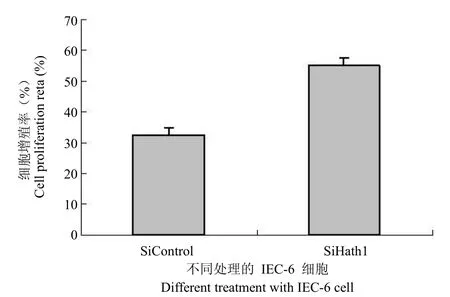
图4 Hath1 siRNA对IEC-6细胞生长的影响Figure 4 The effect of Hath1 siRNA on the IEC-6 cell growth
3 讨论
Hath1 基因作为一个转录因子,具有高度的同源性。Hath1 是 Ben-Arie 等[5]于 1996年克隆得到的果蝇 atonal 基因的同源基因。果蝇 atonal基因在果蝇神经系统的发育中起着关键的作用。Hath1 在小鼠中的同源基因 Math1 也在小鼠的消化系统的发育及分化过程中起着关键的作用。Math1缺失的转基因小鼠在消化系统的发育中存在严重的缺陷。Math1 基因敲除的小鼠不能发育出所有三种小肠分泌型细胞[6],其中包括 goblet 细胞,但是吸收细胞 enterocytes 不受影响。Math1 与细胞增殖的标记 Ki-67 的共定位表明所有这些分泌型细胞都是来自一个表达 Math1 的前体细胞,Math1在分泌型细胞的发育中起着关键性的作用。其他研究也表明 Math1 基因在背部神经管的发育和细胞形态分化中有着重要的作用[7]。
所有这些研究都表明 Hath1 及其同源基因在个体的生长发育及多个组织的发生过程中起着重要的作用。其在小肠分泌型细胞的发生中起着的决定性作用已经得到了比较充分的研究,而在组织发育与细胞分化之外的作用一直没有得到很好的研究。在结肠癌发生的渐进累积过程中,杯状细胞逐渐减少[8],在结肠癌中,杯状细胞明显减少甚至消失。除发病率较低的黏液腺癌和印戒细胞癌外,大多数结肠癌中的黏蛋白都明显减少[9-10],因此推测Hathl 基因与结肠癌的发病有关。
实验阐明了这一在正常组织中高表达而在肿瘤细胞中低表达的因子具有对结肠癌细胞显著的肿瘤抑制作用。过表达 Hath1 基因的结肠癌细胞都显示出了显著的生长抑制。在转移性肿瘤 SW480中(38.5%)比原位性肿瘤 SW620 中(35.6%)的抑制作用略高。而在 LS174T 细胞中的抑制率达到了 55%。为此在 LS174T 细胞中进一步研究了这一抑制作用是否通过细胞凋亡发生。实验结果表明Hath1 在LS174T 中不能有效地诱导肿瘤细胞发生凋亡,但是可以显著地提高肿瘤细胞对化疗药物的敏感性。这为临床研究提供了一些有意义的参考。
[1]Hutcheson DA, Vetter ML.The bHLH factors Xath5 and XneuroD can upregulate the expression of XBrn3d, a POU-homeodomain transcription factor.Dev Biol, 2001, 232(2):327-338.
[2]Vetter ML, Brown NL.The role of basic helix-loop-helix genes in vertebrate retinogenesis.Semin Cell Dev Bio1, 2001, 12(6):491-498.
[3]Boland CR, Montgomery CK, Kim YS.Alterations in human colonic mucin occurring with cellular differentiation and malignant transformation.Proc Natl Acad Sci U S A, 1982, 79(6):2051-2055.
[4]Bienz M, Clevers H.Linking colorectal cancer to Wnt signaling.Cell,2000, 103(2):311-320.
[5]Ben-Arie N, McCall AE, Berkman S, et al.Evolutionary conservation of sequence and expression of the bHLH protein Atonal suggests a conserved role in neurogenesis.Hum Mol Genet, 1996,5(9):1207-1216.
[6]Yang Q, Bermingham NA, Finegold MJ, et al.Requirement of Math1 for secretory cell lineage commitment in the mouse intestine.Science,2001, 294(5549):2155-2158.
[7]Gowan K, Helms AW, Hunsaker TL, et al.Crossinhibitory activities of Ngn1 and Math1 allow specification of distinct dorsal interneurons.Neuron, 2001, 31(2):219-232 .
[8]Velcich A, Yang W, Heyer J, et al.Colorectal cancer in mice genetically deficient in the mucin Muc2.Science, 2002, 295(5560):1726-1729.
[9]Yang W, Velcich A, Lozonschi I, et al.Inactivation of p21 WAFI/cip1 enhances intestinal tumor formation in Muc2-/-mice.Am J Pathol,2005, 166(4):1239-1246.
[10]Akazawa C, Ishibashi M, Shimizu C, et al.A mammalian helix-loop-helix factor structurally related to the product of Drosophila proneural gene atonal is a positive transcriptional regulator expressed in the developing nervous system.J Biol Chem, 1995,270(15):8730-8738.

