以 FOXP3为靶点的免疫抑制剂药物筛选模型的建立
巫晔翔,司书毅,蒋建东,唐巍然
在 20 世纪 70年代曾有学者发现一群 T 细胞具有免疫抑制功能,但直至 1995年Sakaguchi等[1]发现 CD4+CD25+ 为调节性 T 细胞的表面标志后,人们才开始对调节性 T 细胞的分化、发育和功能进行深入的研究,并发现转录因子FOXP3在调节性 T 细胞中的作用,开始关注调节性 T 细胞在维持机体免疫耐受,防止自身免疫性疾病的发生,抗移植物排斥以及肿瘤免疫中的重要作用。
FOXP3是一种具有叉头螺旋(forkhead/winged helix)结构的转录调节因子[2]。它的基因编码产物是一个分子量为48 kD 的 Scurfin 蛋白质。它主要表达于 CD4+/CD25+ 调节性 T 细胞,是决定调节性 T 细胞免疫抑制功能的关键基因。尽管有关FOXP3的信号传导途径还有待进一步研究,但Hori 等的研究表明FOXP3能够特异性地表达于CD4+ 的调节性 T 细胞,CD4+/CD25- 细胞在转染FOXP3基因后能够赋予这些细胞具有调节性T 细胞的表型,具有高表达水平的 CD25、CD103、GITR、CTLA4 和低水平表达的细胞因子[3-5],是控制调节性 T 细胞发生分化的关键性转录因子。转染FOXP3基因的 CD4+/CD25– 细胞在体外通过细胞间接触可发挥其免疫抑制功能,在体内能够抑制自身免疫性疾病和炎症性疾病的发生。FOXP3还能够抑制自身反应性 T 细胞功能,FOXP3功能缺陷会导致许多自身免疫病的出现如:糖尿病、湿疹、变态反应性疾病、淋巴细胞增生等。而FOXP3功能的异常增强也会导致病理性的免疫抑制和肿瘤疾病的发生[6-7]。
这些研究结果表明调节性 T 细胞中的转录因子FOXP3不仅有望成为治疗自身免疫病,变态反应性疾病和解决移植排斥反应难题的作用靶点,而且也可能成为肿瘤免疫学治疗中的理想治疗靶点之一。尽管已有瞬时表达FOXP3细胞用于研究其功能的报道,但有关建立以FOXP3为靶点永久、稳定细胞系用于高通量筛选免疫抑制剂的细胞模型,尚未见文献报道。为此,我们将转录调节因子FOXP3基因启动子克隆到 pGeneBLAzer-TOPO载体中并与报告子 β-内酰胺酶相偶联,建立以FOXP3为靶点的免疫抑制剂药物筛选模型。
1 材料与方法
1.1 材料
1.1.1 质粒,菌株和细胞株:真核细胞表达载体pGeneBLAzer-TOPO 为美国 Invitrogen 公司产品;大肠杆菌E.coliDH5α 为大连宝生物工程公司产品;Jurkat 细胞株为中国医学科学院基础医学研究所提供。
1.1.2 主要试剂 转染试剂(Lipofectamine 2000)购自美国 Invitrogen 公司;基因组提取试剂盒、DNA 回收试剂盒、DNA 聚合酶(PrimeSTARTMHS DNA polymerase)购自大连宝生物工程公司;G418购自美国 Amresco 公司;PMA(Phorbol 12-myristate 13-acetate)和 Ionophore 购自美国 Sigama 公司;前列腺素 E2(PGE2)购自美国 Cayman Chemical公司。
1.2 方法
1.2.1 目的基因的体外扩增 用广谱基因组DNA 抽提试剂盒从正常人外周血单核细胞中分离基因组 DNA,并以此为模板,通过自行设计引物,使用 PrimeSTARTMHspolymerase 进行 PCR 扩增FOXP3启动子全区域 1834 bp。
1.2.2 重组质粒的构建和鉴定 将 PCR 扩增的DNA 片段切胶回收纯化,T-A 克隆至pGeneBLAzer-TOPO 载体上,转化至E.coliDH5α中增殖扩增,提取纯化质粒,通过 PCR 选择插入正方向片段的质粒克隆,测序鉴定插入片段的DNA 全序列,选取与 GeneBank AF235097 序列有100%同源性的克隆作为转染用质粒。
1.2.3 重组质粒转染细胞和建立稳定转染细胞株 将 Jurkat 细胞培养于 6 孔无菌培养板内,培养基为不含抗生素的 RPMI 1640 培养液。采用脂质体法用 LipofectamineTM2000 Reagent 试剂盒转染FOXP3启动子/pGeneBLAzer-TOPO 载体于培养的 Jurkat 细胞后,置于 37℃二氧化碳培养箱内,培养 18~48 h。其间每 6~8 h 换液一次,用新鲜的含 10%FBS 的 1640 无双抗培养液换掉转染液,继续培养 24 h。以含 G418 1100 μg/ml 的选择性培养基筛选稳定转染细胞株。
1.2.4 转染细胞株中外源性基因稳定性的鉴定 将经 G418 选择性培养基筛选的稳定转染细胞株,经多次传代后,以未转染的 Jurkat 细胞为对照,用基因组提取试剂盒提取 Jurkat 细胞基因组,以 PCR 扩增融合载体中FOXP3启动子DNA 片段。
FOXP3扩增引物:上游引物:T7 promoter primer(源自 pGeneBLAzer-TOPO 载体):5’ TAAT ACGACTCACTATAGGGA 3’;下游引物:primer 2(源自FOXP3启动子序列):5’ ACCTTACCTGG CTGGAATCACG 3’,片段长度:1934 bp。
管家基因GAPDH:上游引物:5’ CAACGGAT TTGGTCGTATTG 3’;下游引物:5’ CTTCCACGAT ACCAAAGTTGTC 3’,片段长度:493 bp。
1.2.5 转染细胞株中FOXP3基因启动子活性的检测 以 PMA 20 ng/ml、Ionophore 1 μg/ml 和PGE226 μm 单独和联合刺激稳定转染细胞株 18 h后[8],将 GeneBLAzer Detection kits 提供的荧光底物(CCF2-AM)加入细胞中后移至 96 孔培养板中室温孵育 1 h。通过荧光检测仪读取 460 nm 蓝色荧光数值(a)和 530 nm 的绿色荧光数值(b)。β-内酰胺酶活性评价采用比率制读数:Ratio = a/b,当 β-内酰胺酶上游的FOXP3启动子对刺激物反应,驱使下游 β-内酰胺酶表达时在加入底物的细胞群中呈现蓝色荧光,反之细胞群中则呈现绿色荧光。
2 结果
2.1 目的基因的体外扩增
以人类基因组 DNA 为模版,PCR 扩增FOXP3启动子全长,扩增产物经琼脂糖凝胶电泳,获得 1.8 kb 的 DNA 片段,如图1 所示。

图1 PCR 扩增产物人类 FOXP3 基因启动子的琼脂糖凝胶电泳检测Figure 1 Human FOXP3 promoter fragment amplified with PCR was analyzed by gel electrophoresis
2.2 重组质粒的构建和测序鉴定

图2 FOXP3 启动子/pGeneBLAzer-TOPO 重组载体模式图Figure 2 The schema for construct FOXP3 promoter/pGeneBLAzer-TOPO

图3 人类 FOXP3 启动子序列(GenBank accession NO.AF235097)Figure 3 Sequence of human FOXP3 promoter region(GenBank accession NO.AF235097)
如图3 所示,将此 PCR 扩增产物克隆至pGeneBLAzer-TOPO 载体中,挑取含有插入正向片段质粒的菌落,提取菌落精制质粒。使用 T7 promoter primer 和自行设计的引物对上述质粒进行 DNA 测序(图3)。其中 CTB573-23DNA 序列与文献[9]报道以及 GeneBank 中所登录的序列具有高度同源性。其余克隆都不同程度上存在有若干突变点。故选择该克隆融合载体作为转染细胞用质粒。
2.3 转染细胞株中外源性基因稳定性的鉴定
以未转染的 Jurkat 细胞为对照,用基因组提取试剂盒提取转染 Jurkat 细胞及对照组细胞基因组,以其为模板,PCR 扩增确定 Jurkat 细胞基因组中是否整合有已构建的FOXP3启动子/pGeneBLAzer- TOPO 载体。结果表明:以对照Jurkat 细胞基因组为模板,以 pGeneBLAzer-TOPO载体序列为上游引物,以FOXP3启动子序列为下游引物的 PCR 产物中没有扩增出任何 DNA 片段(图4,Lane 2),而稳定转染有融合载体的两个Jurkat 细胞株却能够扩增出长度为1.9 kb 的DNA 片段,如图4 中 3~4 泳道所示。在以转染细胞与对照细胞基因组为模板的管家基因GAPDH 的 PCR 中均能扩增出长度为493 bp 的GAPDH DNA 片段(图4,Lane 5~7)。上述结果表明:稳定转染的 Jurkat 细胞基因组中已整合有已构建的启动子融合载体,并能够稳定地随 Jurkat细胞传代培养。

图4 PCR 扩增转染细胞基因组片段的琼脂糖电泳检测Figure 4 The fragments of transfectant genome amplified with PCR were analyzed by gel electrophoresis
2.4 阳性对照 PGE2 对稳定转染细胞中目的基因启动子活性的影响
以 PGE226 μm 以及 PMA 20 ng/ml 和Ionophore 1 μg/ml(PI)单独和联合刺激稳定转染细胞株 18 h 后,将 GeneBlazer Detection kits 提供的荧光底物(CCF2-AM)加入细胞中后移至 96 孔培养板中室温孵育 1 h。通过荧光检测仪读取 460 nm蓝色荧光数值和 530 nm 的绿色荧光数值。结果如图5 所示:PGE2以及 PI 均能够提高FOXP3启动子活性。该实验结果表明:启动子刺激物能够有效地作用于已构建的FOXP3启动子/pGeneBLAzer-TOPO 载体,启动子活性能够通过其下游的报告子β-内酰胺酶活性得以准确的反映。利用该模型我们筛选了研究所内 2500 余种天然产物,获得 4 种对FOXP3启动子具有上调作用的天然产物(图6),这些结果表明:该模型具有用于以FOXP3基因为靶点的药物筛选可行性。

图5 以 β-内酰胺酶报告子检测 Jurkat 细胞 FOXP3 启动子活性。分别用 PGE2(26 μm);PI(PMA 20 ng/ml 和Ionophore 1 μg/ml)和 PI/PGE2 刺激 Jurkat 细胞株Figure 5 FOXP3 promoter activity was analyzed by fluorescent detection of β-lactamase reporter activity in Jurkat cell lines.Jurkat was stimulated with PGE2 (26 μm); PI(PMA 20 ng/ml and Ionophore 1 μg/ml) and PI/PGE2
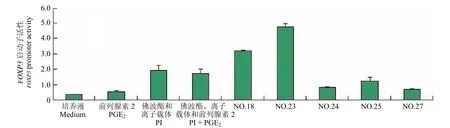
图6 用筛选模型高通量筛选 2500 余种天然产物Figure 6 2500 natural products were screened using the screening model
3 讨论
在本项研究中,我们克隆了FOXP3基因启动子片段,构建了FOXP3基因启动子/pGeneBLAzer-TOPO 载体,建立了稳定转染该融合载体的 Jurkat细胞株。探讨了阳性对照 PGE2对稳定转染细胞中目的基因启动子活性的影响,同时筛选了我们研究所中的 2500 余种天然产物。
我们从人类外周血单核细胞中提取人类基因组,并以其为模板 PCR 扩增FOXP3基因启动子片段,测序结果表明该区域序列与 GenBank AF235097 具有100%的同源性,真核细胞核心启动子的标志性元件 TATA、GC、CAAT box 均存在于启动子区域中,并含有 NFAT、AP-1 等转录因子结合位点和 TSS 转录起始位点[9]。
我们将转录因子FOXP3基因启动子克隆到pGeneBLAzer-TOPO 载体,并与报告子基因 β-内酰胺酶相偶联,经 G418 抗性筛选和外源性基因稳定性的鉴定结果表明:稳定转染 Jurkat 细胞株的基因组中整合有FOXP3启动子/pGeneBLAzer-TOPO 载体,并能够稳定地随 Jurkat 细胞传代培养。这表明我们已得到有稳定转染靶基因启动子的细胞株。在检测刺激物对FOXP3启动子活性影响的实验中,我们选择文献[8]报道的 PGE2用于检测阳性刺激物对稳定转染细胞中FOXP3启动子活性的影响,实验结果表明:阳性刺激物能够提高稳定转染细胞中FOXP3启动子活性,而 PGE2对经 PI 激活的 Jurkat 细胞对启动子活性的影响要优于单独使用 PGE2。PGE2、PMA 和 Ionophore 对FOXP3启动子活性的影响以及高通量筛选 2500余种天然产物的实验结果表明:我们建立的药物筛选模型能够适用于检测该启动子活性,具有进行高通量药物筛选的可行性。有关已得到的阳性天然产物对FOXP3基因表达的影响目前正在研究中。
[1]Sakaguchi S.Naturally arising CD4+ regulatory Tcells for immunologic self-tolerance and negative control of immune responses.Annu Rev Immunol, 2004, 22:531-562.
[2]Suhubert LA, Jeffery E, Zhang Y, et al.Scurfin (FOXP3) acts as a receptor of transcription and regulatory T cell activation.J Biol Chem,2001, 276(40):37672-37679.
[3]Ramsdell F, Ziegler SF.Transcription factors in autoimmunity.Curr Opin Immunol, 2003, 15(6):718-724.
[4]Sakaguchi S, Sakaguchi N, Shimizu J, et al.Immunologic tolerance main2 tained by CD25+ CD4 + regulatory T cells: their common role in controlling autoimmunty, tumor immunity, and transplantation tolerance.Immunol Rev, 2001, 182:18-32.
[5]McHugh RS, Whitters MJ, Piccirillo CA, et al.CD4(+)CD25(+)immunoregulatory T cells: gene expression analysis reveals a functional role for the glucocorticoid-induced TNF receptor.Immunity,2002, 16(2):311-323.
[6]Hori S, Nomura T, Sakaguchi S.Control of regulatory T cell development by the transcription factor Foxp3.Science, 2003,299(5609):1057-1061.
[7]Kim JM, Rasmussen JP, Rudensky AY.Regulatory T cells prevent catastrophic autoimmunity throughout the lifespan of mice.Nat Immunol, 2007, 8(2):191-197.
[8]Baratelli F, Lin Y, Zhu L, et al.Prostaglandin E2 induces FOXP3 geng expression and T regulatory cell function in human CD4+ T cells.J Immunol, 2005, 175(3):1483-1490.
[9]Mantel PY, Ouaked N, Rückert B, et al, Molecular mechanisms underlying FOXP3 induction in human T cells.J Immunol, 2006,176(6):3593-3602.

