用聚合酶链反应技术对粉尘螨和屋尘螨进行鉴别和检测*
丁 雪,罗晓东,罗洁琳,李小敏,沈浩贤,陈代雄
近几十年来,各种变态反应性疾病如过敏性鼻炎、皮炎、支气管哮喘和变应性结膜炎等的流行呈逐年上升趋势[1],已成为全球性的健康问题[2]。变态反应性疾病是接触变应原后人体产生的一种免疫病理反应过程[3]。现有资料证明[4],尘螨是引起变态反应性疾病最重要的变应原之一。而尘螨中又以粉尘螨(Dermatophagoidesf arinae)和屋尘螨(Dermatophagoides pteronyssinus)数量最多、分布最广、危害最大[5-7]。但是一方面屋尘螨和粉尘螨的分布不完全相同,另一方面两者又常在同一环境中同时存在,因此了解某一地区或环境中尘螨的种类和优势螨种,对过敏性疾病的诊断、预防和治疗是非常重要的。本研究尝试用聚合酶链反应(Polymerase Chain Reaction,PCR)技术对粉尘螨和屋尘螨进行鉴别和检测。
1 材料和方法
1.1 试剂 粉尘螨原种由中山医学院提供,在本实验室进行培养繁殖用于实验;屋尘螨购自瑞典Al-lergon公司。DNA聚合酶、PCR试剂盒和 DNA Marker从 TAKARA公司购买。其它试剂:如乙醇、酚、氯仿、异戊醇均为分析纯。
1.2 仪器 1-15PK离心机为SIGMA公司生产;S1000TMPCR仪由BIORAD公司生产;WS-01恒温恒湿培养箱由湖北黄石恒丰医疗器械有限公司生产。
1.3 方法
1.3.1 粉尘螨和屋尘螨DNA提取 参照赵亚娥[8]和王继英[9]等报告的方法进行。
1.3.2 随机引物PCR扩增 参考陈观今等[10]的研究报告设计随机引物,由Invitrogen公司合成。两条引物分别为 RP1、RP3,序列如下:RP1:5'-GAG GCC AGT-3';RP3:5'-GCA ACG CAA T-3'。分别以粉尘螨和屋尘螨DNA为模板进行PCR扩增,PCR 反应体系 25μL(5×PCR Buffer 5μL,上下游引物各 1μL,dNTP(2.5mmol/L)4μL,模板0.5μL,PrimerSTAR HS DNA聚合酶0.5μL,ddH2O 13μL);反应条件参考赵亚娥[8]、周华云等[11]报告:94℃5min预变性,94℃ 1min、36℃1min、72℃2min反应45个循环,72℃延伸 10min。产物经3%琼脂糖凝胶电泳后,紫外灯下观察并拍照。
1.3.3 测序 将随机引物扩增产物交给TAKARA公司,对所选取的条带进行DNA测序分析。
1.3.4 PCR引物设计 根据测序结果重新设计可用于粉尘螨或屋尘螨检测的PCR引物。为使引物符合其设计要求,对引物的个别碱基进行了替换,序列如下:
根据粉尘螨约750bp大小DNA扩增片段设计引物:

根据屋尘螨约500bp大小片段设计引物:

1.3.5 PCR扩增粉尘螨和屋尘螨DNA 用新设计的引物,按照1.3.2的PCR反应条件(退火温度调整为48℃),分别对粉尘螨和屋尘螨的DNA进行扩增。
1.3.6 PCR反应特异性 用新设计的屋尘螨的引物扩增粉尘螨 DNA;用粉尘螨引物扩增屋尘螨DNA,观察这些引物的特异性。
1.3.7 PCR反应敏感性 各取粉尘螨和屋尘螨DNA 0.25μL和0.1μL量按1.3.5的PCR 条件进行扩增反应,以初步估计该法的敏感性。
2 结 果
2.1 随机引物扩增结果 分别以粉尘螨和屋尘螨DNA为模板进行PCR扩增,结果见图1。粉尘螨在750bp和500bp左右均有明显条带;而屋尘螨仅500bp左右条带较清晰,无大于500bp的扩增产物出现。

图1 随机引物PCR扩增粉尘螨和屋尘螨结果Fig.1 RP-PCR amplification results of D.f and D.p
2.2 测序和同源性分析 对粉尘螨750bp和500bp左右大小的两个扩增条带(标记为 df750、df500)与屋尘螨约500bp的一个扩增条带(标记为dp500)进行回收测序,结果如下。
2.2.1 df750测序和同源性分析结果


片段长度为666bp,划线部分为设计引物f1,f2所在位置。
同源性分析:未发现与之高度同源序列,与其相似程度最高的基因为Collimonas sp.MPS11E8的3-氧酰基-(酰载体蛋白)合酶,总的相似度为46%。
2.2.2 df500测序和同源性分析结果


同源性分析:未发现与之高度同源序列。
2.2.3 dp500测序和同源性分析结果

片段总长度为500bp。划线部分为设计引物p1,p2所在位置。
同源性分析:未发现与之高度同源序列。
2.3 PCR扩增结果 如图2所示,粉尘螨和屋尘螨的PCR扩增产物大小与预期的一致。

图2 粉尘螨和屋尘螨PCR扩增结果Fig.2 PCR amplification results of D.f and D.p
2.4 PCR反应特异性 由图3可看见,无论是粉尘螨还是屋尘螨,均无明显的目的条带出现,表明引物具有较好的特异性。
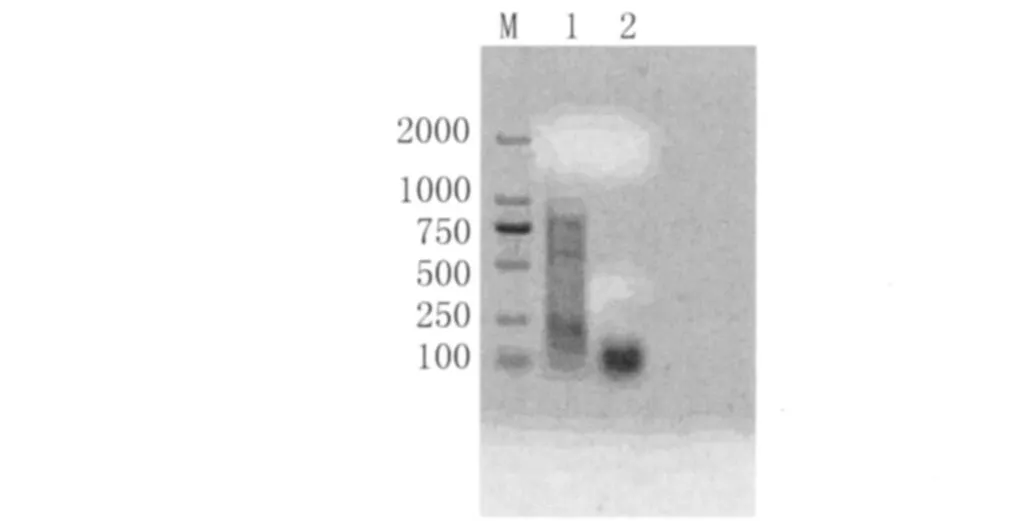
图3 粉尘螨和屋尘螨PCR反应的特异性结果Fig.3 The specificity of PCR amplification
2.5 PCR反应敏感性 如图 4。在模板量为0.25μL和0.1μL的条件下,粉尘螨和屋尘螨均可扩增出目的条带,而0.1μL模板相当于1.5只尘螨的DNA量,表明引物用于尘螨检测应具有较好的敏感性。

图4 粉尘螨和屋尘螨PCR反应敏感性结果Fig.4 The sensitivity of PCR amplification
3 讨 论
目前,螨的分类和鉴别方法包括形态学方法[12]和分子生物学方法等。其中形态学分类和鉴别,由于粉尘螨和屋尘螨之间形态非常接近;同时,采样过程中也可能造成螨体的损伤甚至残缺,而给后续的形态鉴别工作带来不便;此外,对于螨卵,幼螨的形态学鉴别则更为困难。分子生物学方法分类和鉴别方面,Yang B等[13]根据核糖体第二转录间隔(ITS2)和线粒体细胞色素氧化酶亚基(CO1)位点基因序列,用PCR方法尝试对六种尘螨(包括屋尘螨,粉尘螨,热带无爪螨,埋里宇尘螨,腐食酸螨,椭圆板白螨)进行分类。Suarez-Mzrtinez EB等[14]基于mtDNA 12SRNA的13条序列片段,对屋尘螨、热带无爪螨、隐秘甘螨和椭圆板白螨4种螨进行了系统进化关系的分析。此外我国学者罗萍[15]用4对随机引物对腐酪食螨和屋尘螨基因组DNA进行分析,提示其DNA存在可鉴别的异质性。但利用随机引物PCR进行粉尘螨和屋尘螨的鉴别目前尚未见文献报道。本研究首次尝试用该法对粉尘螨和屋尘螨DNA进行了扩增,结果显示:此方法对这两种尘螨有较好的鉴别作用。这也为粉尘螨和屋尘螨的鉴别和分类提供了一项新的手段。
本研究还对3个粉尘螨和屋尘螨的DNA片段进行了序列测定。经同源性分析,未发现与之高度同源的序列,因此这3个片段有可能为新的基因片段,其具体功能还有待进一步的研究。此外,在这3个DNA片段中,df500与dp500由同一对引物扩增得到,且片段长度非常接近,但测序发现二者并非相同或相似的一段DNA序列。上述DNA序列的测定为粉尘螨和屋尘螨的遗传背景研究提供了新的信息,并为用分子生物学技术对尘螨进行进一步的研究提供了可能。
文献报道[16]:尘螨的致病作用与环境中尘螨的密度有关。每1g灰尘中包含100只尘螨就会导致人体致敏,每1g灰尘中超过500只尘螨就会引发过敏性体质者哮喘等过敏性疾病的发作。因此,对环境中尘螨及其密度的检测于过敏性疾病的诊断、预防和治疗都有重要意义。目前,尘螨的检测方法主要有镜检计数检查[7]、免疫学检测[17]、鸟嘌呤检测[18]和酶学检测[19]等。镜检计数是最传统的方法。该法的优点是检测成本低,结果直观可靠并可对多种螨进行计数,但是该方法工作量大,且检测过程中残缺螨、变异螨和幼螨的识别存在困难。免疫学方法、鸟嘌呤检测或酶学检测是通过检测灰尘中尘螨变应原或尘螨排泄物的鸟嘌呤含量或变应原酶活性来估计尘螨种类和数量的一种检测方法。这些方法均属于间接检测方法,同时,免疫学反应存在交叉反应,且不同螨种产生的变应原也可能性质相同,因此,其结果可能存在较大误差,且难以提供环境中某种尘螨数量、优势尘螨的种类等重要信息。PCR技术具有敏感、快速、可进行定量检测等优点,且该方法直接检测虫源性DNA,较免疫学检测方法有更好的特异性。因此,本研究初步尝试用PCR方法对这两种尘螨进行检测。结果显示:该方法具有较好的特异性和敏感性。为进一步将其实际应用于环境中粉尘螨和屋尘螨的定性和定量检测奠定了基础。
[1]Sequndo G R,Sopelete MC,Terra SA,et al.Diversity of aller-gen exposure:implications for the efficacy of environmental control[J].Braz J Otorhinolaryngol,2009,75(2):311-316.
[2]Arlian LG,Platts Mills T A.The biology of dust mites and the remediation of mite allergens in allergic disease[J].J Allergy Clin Immunol,2001,107(3 suppl):406-413.
[3]Hainsworth T.提高对日益增多的变态反应相关疾病的认识[J].国外医学护理学分册,2004,6(23):263-264.
[4]International Workshop Report.Dust mite allergens and asthmaa worldwide problem[J].J Allergy Clin Immunol,1989,83:416-427.
[5]Fernandez-Caldas E,Iraola V,Boquete M,et al.Mite immunotherapy[J].Vet Dermatol,2006,17(4):223-235.
[6]胡传翠,李朝品.尘螨与变应性疾病的研究进展[J].医学综述,2009,15(7):1054-1056.
[7]陈国健,卢祺,庞力沛,等.广州市某高校学生宿舍尘螨孽生的调查[J].环境与健康杂志,2008,3(25):229-231.
[8]赵亚娥,成慧,寻萌,等.人体蠕形螨的DNA提取与随机引物PCR检测[J].昆虫学报,2009,52(8):929-933.
[9]王继英,俞英,冯利霞,等.酚-氯仿法从猪毛囊中提取基因组DNA[J].遗传,2010,32(7):752-756.
[10]陈观今,罗超权,韦相才,等.随机引物聚合酶链反应技术鉴别弓形虫株的研究[J].寄生虫与医学昆虫学报,1994,2(1):6-7.
[11]周华云,高琪,潘波,等.随机引物聚合酶链反应用于鉴别嗜人按蚊不同地理株的初步研究[J].中国血吸虫病防治杂志,2000,4(12):214-216.
[12]Colloff MJ.Tax onomy and identification of dust mites[J].Allergy,1998,53(48 Suppl):7-12.
[13]Yang B,Cai J,Cheng X.Identification of astigmatid mites using IT S2 and COI regions[J].Parasitol Res,2011,108(2):497-503.
[14]Suarez-M artinez EB,Montealegre F,Sierra-Montes JM,et al.Molecular identification of pathogenic house dust mites using 12S rRNA sequences[J].Electrophoresis,2005,26(15):2927-34.
[15]罗萍.两株粉尘螨基因组DNA的研究[J].四川省卫生管理干部学院学报,1998,4(17):197-198;202.
[16]Plattis-mills T AE,De Weck AL.Dust mite allergens and asthma-A world wide problem[J].J Allergen Clin Immunol,1989,83:416-427.
[17]练玉银,杨杏芬.尘螨变应原含量检测研究进展[J].热带医学杂志,2006,5(6):603-605.
[18]Quoix E,Le Mao J,Hoy et C,et al.Prediction of mite allergen levels by guanine measurements in house-dust samples[J].Allergy,1993,48(5):306-309.
[19]谢建云.尘螨变应原的酶学研究[J].国外医学寄生虫病分册,1994,3(21):111-114.

