老年代谢综合征患者前列腺体积与体重指数、血压及高敏C反应蛋白的关系探讨
孙岩,廖淑萍
深圳市人民医院(暨南大学附属第二医院),广东 深圳 518020
良性前列腺增生症(benign prostatic hyperplasia,BPH)的病理特征为前列腺体积(prostatic volume,PV)增大,是老年男性常见疾病,但确切病因至今尚不明确[1]。前列腺体积增大病因涉及遗传、性激素、营养等多种因素,而与体重指数(body mass index,BMI)及血压的关系尚存争议。有资料显示肥胖、高血压及高血糖等是前列腺体积增大的危险因素[2]。也有学者发现肥胖与前列腺增生负相关,高血压及糖尿病史与前列腺增生不相关[3]。代谢综合征(metabolic syndrome,MS)是心血管疾病多种代谢危险因素如超重或肥胖、高血压、高血糖及血脂紊乱等在体内聚集的状态。为了解老年MS患者前列腺体积与BMI、血压及高敏C反应蛋白(high-sensitivity C reactive protein,Hs-CRP)的关系,我们测量了一组老年MS患者的前列腺体积、BMI、血压及Hs-CRP等指标,现将结果报道如下。
1 资料和方法
1.1 资料
2008年6月至2011年4月间在本院行常规体检及老年病门诊就诊、年龄在60岁以上、有1个及以上MS组分和无MS组分的老年男性患者共342例纳入研究。342例中,60~69岁190例、70~79岁者138例、≥80岁者14例,平均年龄(68.1±6.0)岁。符合下列4个组成成分中的3个或全部者诊断为 MS[4]:(1)超重或肥胖:BMI≥25kg/m2;(2)高血糖:空腹血糖(FPG)≥6.1mmol/L和(或)餐后2h血糖≥7.8mmol/L,及或已诊断为2型糖尿病并治疗者。(3)高血压:收缩压(SBP)/舒张压(DBP)≥140/90mm Hg及或已确诊为高血压并治疗者;(4)血脂紊乱:空腹血甘油三酯(TG)≥1.70mmol/L,及或空腹血高密度脂蛋白胆固醇(HDLC):男性<0.9mmol/L,女性<1.0mmol/L。排除有严重肝、肾、消化道、血液系统疾患;有急慢性感染、自身免疫性疾病、肿瘤史者;血前列腺特异抗原(PSA)≥4ng/ml、有前列腺手术史者。
342例入选者依据有无MS组分及具备MS组分数目多少分为4组:无MS组分组(对照组)82例、有1个 MS组分组(MS1组)93例、有2个 MS组分组(MS2组)87例、≥3个MS组分组(MS组)80例,各组平均年龄分别为(67.4±6.2)、(68.8±6.7)、(68.3±5.9)、(68.1±5.7)岁,差异无统计学意义。
1.2 方法
受检者均禁食10h以上,次日晨空腹采集静脉血,Hs-CRP、总胆固醇(TC)、TG、HDL-C、低密度脂蛋白胆固醇(LDL-C)、FPG由本院临床检验医学部临床化学室进行测定;前列腺特异抗原(PSA)由本院临床检验医学部免疫检验室检测。测量血压、身高、体重,换算BMI(kg/m2)=体重(kg)/身高(m)2[5]。前列腺体积(PV)根据本院超声诊断仪测量的前列腺左右径(cm)、上下径(cm)及前后径(cm),应用公式[前列腺体积(PV)(ml)=左右径×上下径×前后径×π/6]计算得出[6]。
1.3 统计学方法
采用SPSS12.0软件包进行统计学分析。计量资料用均数±标准差表示,行t检验,组间比较行方差分析,方差不齐者行非参数检验。相关分析若变量服从正态分布即应用PEARSON相关分析,若不服从正态分布则应用SPEARMAN相关分析,P<0.05为差异有统计学意义。
2 结果
2.1 各组患者临床参数检测结果
从表1可见,随着 MS组分增多、Hs-CRP增高,前列腺体积渐增大。MS组前列腺体积、Hs-CRP、BMI、收缩压、舒张压、FPG、TG高于对照组,而 HDL-C低于对照组,两组间差异有统计学意义;MS组TC、LDL-C也高于对照组,但两组间差异无统计学意义。MS2及MS1两组前列腺体积、Hs-CRP、BMI、收缩压、舒张压、FPG、TG高于、HDL-C低于对照组,MS2及MS1两组前列腺体积、TC及LDL-C与对照组间差异无统计学意义;两组 Hs-CRP、BMI、FPG、TG、HDL-C与对照组间差异有统计学意义。MS2组收缩压、舒张压及MS1组收缩压与对照组间差异有统计学意义;MS1组与对照组间舒张压差异无统计学意义。
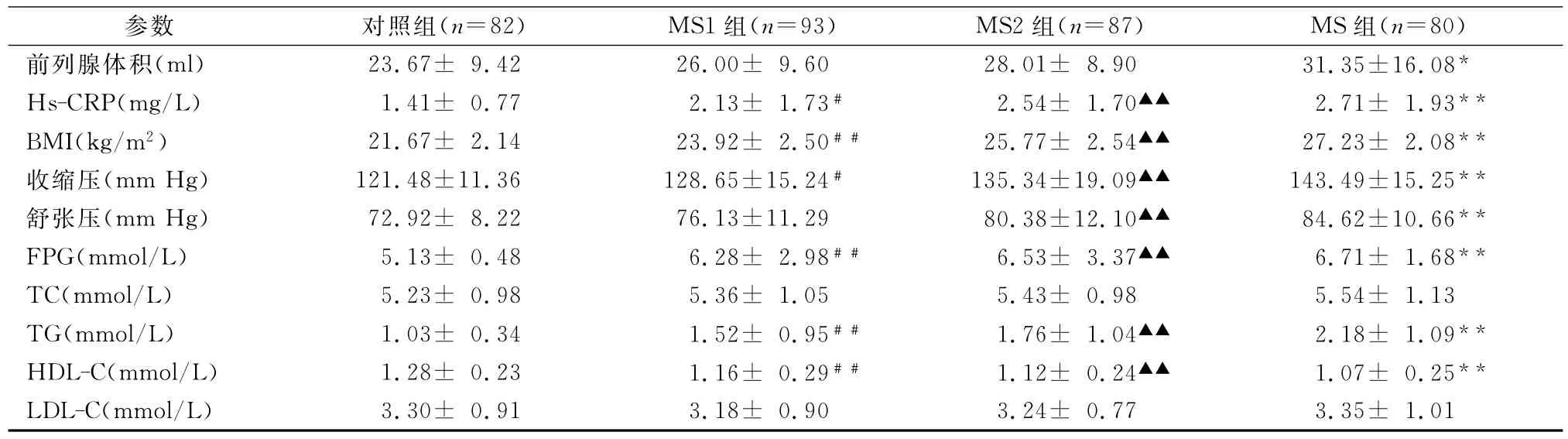
表1 四组临床参数检测结果Tab.1 Determination of the clinical parameters in four groups
2.2 四组患者前列腺体积与MS各组分相关性
从表2可见,MS组前列腺体积与Hs-CRP、BMI、舒张压正相关;与年龄、收缩压、FPG、TC、TG、HDL-C及LDL-C不相关。MS2组、MS1组及对照组前列腺体积与年龄、Hs-CRP、BMI、收缩压、舒张压、FPG、TC、TG、HDL-C及LDL-C不相关。
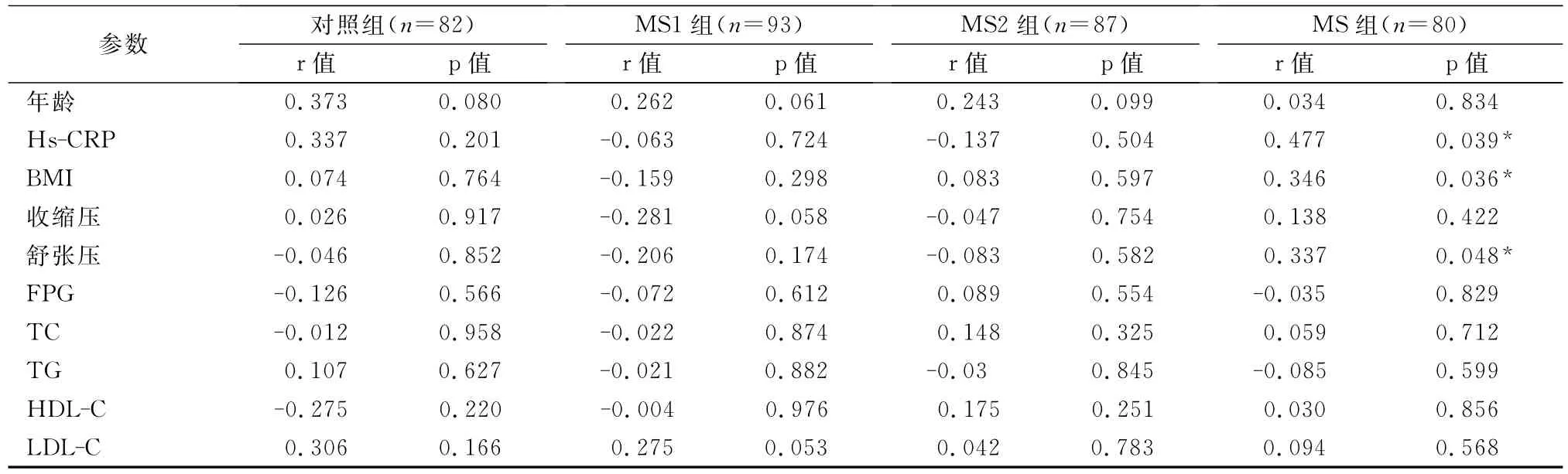
表2 4组PV与MS各组分相关性Tab.2 Correlation between prostatic volume and components of MS in four groups
3 讨论
文献报道肥胖男性前列腺体积较非肥胖男性增大,肥胖是前列腺体积增大的危险因素[7]。也有文献报道肥胖与前列腺增生负相关,认为雄激素涉及前列腺增生发展与维持,而肥胖者雄激素水平减低[3]。本资料显示自 MS1组至 MS组,随着MS组分增多,BMI渐增高,前列腺体积也渐增大。2000年国际肥胖特别工作组提出亚洲成年人BMI在18.5~22.9kg/m2为正常,在25~29.9kg/m2为Ⅰ度肥胖[5],本资料 MS组老年男性平均BMI(27.23±2.08)kg/m2,高于对照组,MS组与对照组前列腺体积差异有统计学意义,与Parsons等[7]报道类似。雄激素与前列腺增生相关[3],但近年来研究显示雌激素也有刺激前列腺基质细胞增殖的作用[8]。生理浓度的雌雄激素比例,主要由雄激素维持,较高的雄激素水平可抑制雌激素促细胞增殖作用[9]。前列腺增生与男性雌雄激素比例失衡有关,男性因增龄性腺功能减退,雄激素下降,雌二醇与雌酮随年龄增长并未下降,仍维持一定浓度,致血浆中雌/雄激素比例增高,雌激素水平与前列腺体积正相关[10]。老年人常见肥胖,肥胖者体内雌激素水平较非肥胖者增高,增加的雌酮与雌二醇来源于脂肪组织转变肾上腺等外周组织产生的雄烯二酮。BMI与雌激素水平正相关[11]。本组入选对象均为老年人,显示随着BMI渐增高,前列腺体积渐增大;MS组前列腺体积与BMI正相关,推测老年男性随着肥胖程度的加重,体内脂肪组织聚集增多,雌激素外周转换也可能增加,致体内雌激素水平相对较高,前列腺体积渐增大。
有资料显示长期高血压尤其高舒张压状态促进前列腺增生的发展[12],也有学者报道高血压史与前列腺增生无关[3]。前列腺增生患者TC、TG、HDL-C及LDL-C水平与对照组差异无统计学意义[13],糖尿病史与前列腺增生不相关[3]。本组MS1、MS2及MS组收缩压及舒张压均高于对照组,其中MS2组及MS组两组舒张压与对照组差异有统计学意义,MS组前列腺体积与舒张压正相关,与血脂、FPG不相关。本组观察结果支持血压尤其舒张压对前列腺体积的增大有一定影响,随着舒张压的增高,前列腺体积逐渐增大,而血脂、血糖对前列腺体积的影响有限。
MS患者体内存在系统炎症反应[14],给予非甾体类抗炎药可使发生前列腺增生风险下降47%[15],故有学者推测前列腺增生的发生发展,可能与炎症介质有一定联系[16]。本组结果表明,随着MS组分增多,Hs-CRP水平逐渐增高,前列腺体积渐增大。MS1、MS2与MS组的Hs-CRP较对照组高,而且前列腺体积也较对照组增大。MS组前列腺体积与Hs-CRP正相关,提示老年男性在机体存在多种代谢紊乱因素时,其体内非特异炎症反应加剧,前列腺体积较大。
MS是心血管疾病多种危险因素的聚集,冠心病患者前列腺增生发病率较高[17],心血管疾病的发病因素,也是前列腺增生发生发展的危险因素[2]。本组观察中,仅有1或2个MS组分的MS1组及MS2组患者的前列腺体积与对照组比较,差异无统计学意义,两组前列腺体积与BMI及舒张压不相关。而有3个及以上心血管疾病危险因素的MS组,BMI最高、舒张压维持在较高状态、非特异炎症反应较明显,其前列腺体积也最大,该组前列腺体积与BMI、舒张压及 Hs-CRP正相关。以上结果提示,机体代谢紊乱因素增多、程度加重时,老年男性前列腺体积有较明显变化。
我们的资料表明,老年 MS患者前列腺体积变化,与肥胖程度、代谢紊乱成分多少、舒张压及非特异炎症反应状态等多种因素密切关联。随着BMI增高即肥胖程度的加重、舒张压升高及非特异炎症反应加剧,前列腺体积有增大趋势。
[1]那彦群.良性前列腺增生症//陈孝平.外科学(七年制教材)[M].北京:人民卫生出版社,2002:850-853.
[2]Hammarsten J, Högstedt B.Clinical,anthropometric,metabolic and insulin profile of men with fast annual growth rates of benign prostatic hyperplasia[J].Blood Press,1999,8(1):29-36.
[3]Zucchetto A,Tavani A,Dal Maso L,et al.History of weight and obesity through life and risk of benign prostatic hyperplasia[J].Int J Obes(Lond),2005,29(7):798-803.
[4]中华医学会糖尿病分会代谢综合征研究协作组.中华医学会糖尿病学会分会关于代谢综合征的建议[J].中华糖尿病杂志,2004,12(3):156-161.
[5]傅祖植.肥胖症//叶任高,陆再英.内科学(第6版)[M].北京:人民卫生出版社,2006:832-836.
[6]Lekili M,Müezzinoĝlu T,Uyanik BS,et al.Serum lipid levels in benign prostatic hyperplasia[J].World J Urol,2006,24(2):210-213.
[7]Parsons JK,Carter HB,Partin AW,et al.Metabolic factors associated with benign prostatic hyperplasia[J].J Clin Endocrinol Metab,2006,91(7):2562-2568.
[8]Ho CK,Nanda J,Chapman KE,et al.Oestrogen and benign prostatic hyperplasia:effects on stromal cell proliferation and local formation from androgen[J].J Endocrinol,2008,197(3):483-491.
[9]朱刚,王建业.雌激素致前列腺增生作用[J].中华泌尿外科杂志,1998,19(7):444-445.
[10]Suzuki K,Ito K,Ichinose Y,et al.Endocrine environment of benign prostatic hyperplasia:prostate size and volume are correlated with serum estrogen concentration[J].Scand J Urol Nephrol,1995,29(1):65-68.
[11]Soygür T,Küpeli B,Aydos K,et al.Effect of obesity on prostatic hyperplasia:its relation to sex steroid levels[J].Int Urol Nephrol,1996,28(1):55-59.
[12]郭利君,张祥华,李培军,等.良性前列腺增生与原发性高血压的相关性研究[J].中华外科杂志,2005,43(2):108-111.
[13]Parsons JK,Bergstrom J,Barrett-Connor E.Lipids,lipoproteins and the risk of benign prostatic hyperplasia in community-dwelling men[J].BJU Int,2008,101(3):313-318.
[14]Furukawa S,Fujita T,Shimabukuro M,et al.Increased oxidative stress in obesity and its impact on metabolic syndrome[J].J Clin Invest,2004,114(12):1752-1761.
[15]St Sauver JL,Jacobson DJ,McGree ME,et al.Protective association between nonsteroidal antiinflammatory drug use and measures of benign prostatic hyperplasia[J].Am J Epidemiol,2006,164(8):760-768.
[16]Parsons JK,Sarma AV,McVary K,et al.Obesity and benign prostatic hyperplasia:clinical connections,emerging etiological paradigms and future directions[J].J Urol,2009,182(6 Suppl):S27-S31.
[17]Meigs JB,Mohr B,Barry MJ,et al.Risk factors for clinical benign prostatic hyperplasia in a community-based population of healthy aging men[J].J Clin Epidemiol,2001,54(9):935-944.