低温电解质[K3AlF6/Na3AlF6]-AlF3-Al2O3熔体中TiB2-C复合阴极的耐腐蚀性能
张 凯,方 钊,吕晓军,赖延清,李 劼
(中南大学 冶金科学与工程学院,湖南 长沙,410083)
我国是全球最大的原铝生产与消费国,铝电解工业已经成为我国国民经济的重要支柱产业之一。但目前工业中唯一的炼铝方法即 Hall-Heroult法存在着能耗高、优质碳素消耗量大、温室气体排放量大、单位生产面积产能低和成本高等弊端,严重制约着铝电解工业的进一步发展[1-2]。基于惰性电极的铝电解新工艺将有望变革铝电解工业,实现电解过程温室气体零排放和大幅度节能。惰性电极系统的研发主要包括3个方面的内容:惰性阳极、低温电解工艺和可润湿阴极[3-4]。研究表明:在现行电解工艺条件下,惰性阳极的耐高温熔盐腐蚀性能和抗热震性能还难以满足要求,不能获取高品质原铝。此外,使用惰性阳极电解时,Al2O3的理论分解电压比使用碳素阳极电解时高1.03 V,这将直接导致铝电解生产能耗上升[5-6]。可见:惰性阳极必须与低温铝电解工艺和可润湿性阴极配合使用才能真正实现节能减排的目的。由于[K3AlF6/Na3AlF6]-AlF3-Al2O3熔体具有电解温度低、Al2O3溶解度高、运行稳定性良好等优点,已成为低温铝电解工艺的研究热点和关注焦点[7-8]。然而,与普通电解质体系中的Na相比,该体系中所含K的离子势更低,在电解过程中更加容易渗透进入阴极内部,形成相应的CxK插层化合物,对阴极产生强烈的破坏作用,严重影响铝电解槽的使用寿命和正常的工业生产。因此,针对含钾低温电解质体系,迫切需要开发出一种具有高耐腐蚀性能的铝电解阴极。研究结果表明:TiB2基可润湿性阴极由于具有良好的铝液润湿性,在电解过程中,铝液可以对阴极起到很好的保护作用,因而成为一种很有潜力的能够抵御含钾低温电解质熔体强腐蚀性的铝电解惰性电极系统用阴极材料[9-11]。然而,就已研究的TiB2基可润湿性阴极而言,其使用寿命短的问题仍未得到根本解决,不能满足惰性电极系统对阴极材料性能的要求。因此,有必要深入研究低温电解质[K3AlF6/Na3AlF6]-AlF3-Al2O3熔体中 TiB2基可润湿性阴极的耐腐蚀性能。Lü等[12]测试了以改性沥青为黏结剂所制备的 TiB2-C复合阴极的电解膨胀性能。结果表明:以改性沥青为黏结剂,可以在一定程度上有效降低 TiB2-C复合阴极的电解膨胀率。Ibrahiem等[13]的研究表明:与沥青基TiB2-C复合阴极涂层相比,呋喃基TiB2-C复合阴极涂层有着更强的抗碱金属渗透侵蚀能力。可见,黏结剂的性能对TiB2基可润湿性阴极的耐腐蚀性能有着显著的影响。在此,本文作者分别采用沥青、呋喃、酚醛和环氧为黏结剂,制备不同种类的TiB2-C复合阴极,考察其在低温电解质[K3AlF6/Na3AlF6]-AlF3- Al2O3熔体中的耐腐蚀性能,并对电解后阴极剖面不同区域对元素微区进行分析。
1 实验
1.1 实验原料
TiB2-C复合阴极配方(质量分数)如表1所示。TiB2粉末平均粒径为12 μm;碳质骨料平均粒径为10 μm;黏结剂分别为沥青、呋喃、酚醛和环氧。
电解实验所用的化学试剂为:K3AlF6(分析纯)、Na3AlF6(分析纯)、Al2O3(分析纯)和 AlF3(工业纯)。电解质的分子比(ρCR)为 1.6,钾冰晶石含量(质量分数,下同)与钾冰晶石和钠冰晶石总含量之比(ρKR)为0.3。

表1 沥青、呋喃、酚醛和环氧基TiB2-C复合阴极配方Table1 Formula of pitch, funan, phenolic aldehyde based TiB2-C composite cathodes %
1.2 制备方法
将一定配比的TiB2粉末、石墨和碳纤维置于三维运动捏合机内充分混合均匀,再在自制混捏锅内与相应的黏结剂充分混合。原料称量后在万能液压试验机上模压成形,成形压力为150 MPa,所获得的阴极生坯尺寸(直径×高)为100×(40~52) mm。最后将试样装入刚玉坩埚内,采用焦粉填埋,置于程序控制箱式电阻炉内,按图1所示升温制度焙烧,获得相应的TiB2-C复合阴极。

图1 TiB2-C复合阴极焙烧升温曲线Fig.1 Curve of heating-up for baking of TiB2-C composite cathode
1.3 性能测试与分析方法
TiB2-C复合阴极耐腐蚀性能测试装置如图 2所示。整个装置置于井式电阻炉内,实验前加入一定质量的原铝,在电解过程中,采用Pt/Pt-10%Rh热电偶和TCE-Ⅱ型程序控温仪对电解槽温度进行监控,利用恒电位仪(Model 273A/10, Perkin-Elmer Instruments)提供恒定电流。实验用氧化铝的浓度为相应电解质的饱和氧化铝浓度,电解质的初晶温度tL为873 ℃,过热度tS为50 ℃,电流密度ρCD为0.8 A/cm2,电解时间为2.5 h,实际电解温度等于电解质的初晶温度与过热度之和。

图2 耐腐蚀性能测试装置Fig.2 Testing device for performance of corrosion resistance
本文采用Philips8424 TW2424型X线荧光光谱(XRF)对电解前后阴极铝中的 Ti含量进行分析(分析误差为±5%),通过测定电解前后阴极铝中 Ti含量的变化来确定阴极腐蚀率,计算公式为:
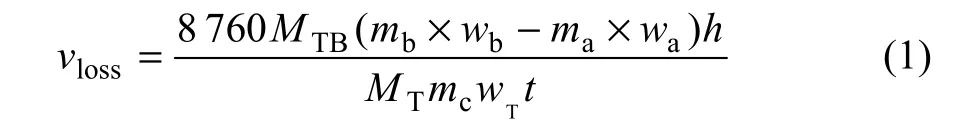
式中:vloss为阴极腐蚀率,mm/a;mb为电解后阴极铝的质量,g;wb为电解后阴极铝中Ti质量分数,10-6;ma为电解前阴极铝的质量分数,g;wa为电解前阴极铝中 Ti含量,10-6;h为阴极试样的高度,mm;MT为TiB2的摩尔质量,69.49 g/mol;MT为Ti的摩尔质量,47.867 g/mol;mc为阴极总质量,1 kg;wT为阴极中TiB2含量,75%;t为电解时间,2.5 h。因此,式(1)也可以改写为:

此外,还采用酚酞测试法测定了不同黏结剂基TiB2-C复合阴极中碱金属的渗透深度和渗透速率。采用NORAN VANTAGE4105型X线能谱仪对试样断面不同区域进行元素微区分析。
2 结果与讨论
2.1 TiB2-C复合阴极耐腐蚀性能分析
2.1.1 不同黏结剂基 TiB2-C复合阴极抗碱金属渗透性能
在电解过程中,由于阴极的极化作用,金属K和Na在阴极表面析出。这部分碱金属会渗透进入阴极内部,与阴极当中的碳质组分发生反应,生成碱金属插层化合物[CxM(K, Na)]。这种化合物很不稳定,极易与空气中的水分反应生成氢氧化钠。因此,可以采用酚酞测试法来测定碱金属的渗透前沿,并计算相应的碱金属渗透速率[14]。图3所示为沥青,呋喃,酚醛和环氧基TiB2-C复合阴极剖面碱金属渗透前沿像。
表2所示为沥青、呋喃、酚醛和环氧基TiB2-C复合阴极中碱金属的渗透深度和渗透速率。从表2可以看出:碱金属的渗透深度和渗透速率从小到大依次为酚醛树脂、环氧树脂、呋喃树脂和沥青。树脂基TiB2-C复合阴极中碱金属的渗透深度和渗透速率均小于沥青基TiB2-C复合阴极中碱金属的渗透深度和渗透速率,说明树脂基 TiB2-C复合阴极的抗碱金属渗透性能均优于沥青基TiB2-C复合阴极。此外,就树脂基TiB2-C复合阴极而言,碱金属在酚醛基TiB2-C复合阴极中的渗透深度及渗透速率最小,与沥青基TiB2-C复合阴极相比,分别下降了59.1%和55.5%,说明酚醛基TiB2-C复合阴极的抗碱金属渗透能力最强。
上述现象主要是不同种类黏结剂碳化后的微观结构不同所致。沥青属于一种软碳材料,由于一开始便具有较高的芳族化合物含量,因此,焙烧过程中,随着温度的升高,其内部逐渐出现了一些层状结构,碳化后内部多为中孔或大孔[15]。这使得电解过程中电解质可以比较容易地渗透进入阴极内部,从而增加了电解质与阴极的接触面积,致使阴极表面生成更多的碱金属K和Na。而呋喃、酚醛和环氧等树脂均属于硬碳材料,随着焙烧温度的升高,其内部出现一种交联现象,形成一种刚性的三维网络结构,碳化后内部多为纳米级的微孔。电解质较难渗透进入阴极内部,这使得其与阴极的接触面积相对较小,阴极表面碱金属K和Na的生成量随之减少。同时,阴极内部的这种三维网络结构也使得碱金属的渗透难度较大,[CxM(K, Na)]的生成量较少,宏观上则表现为电解后树脂基TiB2-C复合阴极有着比沥青基TiB2-C复合阴极更强的抗碱金属渗透能力。其中,又以酚醛基TiB2-C复合阴极的抗碱金属渗透能力最强。渗透速率越大,碱金属对阴极的破坏力就越强。

图3 不同黏结剂基TiB2-C复合阴极剖面碱金属渗透前沿像Fig.3 Image of alkali metal front cross-section of different binder based TiB2-C cathodes

表2 碱金属在不同种类阴极中的渗透深度及渗透速率Table2 Osmotic depth and rate of alkali metal in different cathodes
2.1.2 不同黏结剂基TiB2-C复合阴极的腐蚀率
在电解过程中,铝液和阴极界面处由于发生式(3)所示的反应而生成 Al4C3[16];此外,电解质与铝液界面处所生成的碱金属K和Na经过阴极表面的铝液层,扩散至铝液与阴极界面处,并进一步渗透至阴极当中,这部分碱金属K和Na除部分与阴极当中的碳质组分发生反应生成插层化合物[CxM(K, Na)]之外[17],另一部分则与阴极当中的碳质组分发生式(4)所示的反应,这同样会导致Al4C3的生成[16]。虽然TiB2-C复合阴极与铝液具有良好的润湿性,但在极化条件下,阴极表面的铝液会发生一定程度的波动,致使部分电解质仍然会到达铝液与阴极的界面处,发生反应式(5)所示的反应,造成碳质组分的消耗。阴极各组分中含量最多且最易与碱金属K和Na发生反应的便是黏结剂的结焦碳,当一部分结焦碳发生式(3)所示的反应之后,就会造成一部分TiB2颗粒脱落并进入阴极铝液中,从而引起阴极铝中Ti质量分数上升及复合阴极的冲蚀。这是阴极腐蚀率计算式(1)的理论基础。

表3所示为不同黏结剂基TiB2-C复合阴极的电解腐蚀率及相关参数。从表3可以看出:沥青基TiB2-C复合阴极的腐蚀率最高,达到了8.09 mm/a;而树脂基TiB2-C复合阴极的耐腐蚀性能优于沥青基 TiB2-C复合阴极的耐腐蚀性能,其中又以酚醛基TiB2-C复合阴极的腐蚀率最低,为3.05 mm/a,仅为沥青基TiB2-C复合阴极腐蚀率的37.7%。
在电解过程中,对不同黏结剂基TiB2-C复合阴极而言,其中的碳质组分与铝液接触并发生式(3)所示反应的几率是相等的;同时,各类复合阴极中的碳质骨料完全相同。因而,腐蚀率之间的差异,主要是不同黏结剂结焦碳的抗碱金属渗透能力所引起的。抗碱金属渗透能力越差,阴极所渗入碱金属的含量就越多,与碳反应生成 Al4C3的量也就越大,宏观上则表现为阴极具有较高的腐蚀率。反之,当黏结剂结焦碳的抗碱金属渗透力较强时,阴极所渗入碱金属的含量就越少,与碳反应生成 Al4C3的含量也就越小,宏观上则表现为阴极具有较低的腐蚀率。由2.1.1节的讨论可知:沥青基 TiB2-C复合阴极的抗碱金属渗透能力最弱,而酚醛基TiB2-C复合阴极的抗碱金属渗透能力最强,因而,在腐蚀率上,则表现为沥青基TiB2-C复合阴极的腐蚀率最大,酚醛基TiB2-C复合阴极的腐蚀率最小。

表3 不同黏结剂基TiB2-C复合阴极腐蚀率及其相关参数Table3 Coherent parameter and corrosion rate of different binder based TiB2-C composite cathode
2.2 电解后TiB2-C复合阴极剖面元素微区分析
图4所示为电解后阴极剖面分析部位示意图。图5所示为电解后不同黏结剂基TiB2-C复合阴极剖面由上至下不同区域(a~j点,如图4所示)K和Na的质量分数。其中:a~f点之间,各点的间隔距离为2 mm,f点~j点之间,各点的间隔距离为4 mm。从图5可以看出:无论使用何种黏结剂,K和Na均不同程度地渗透进入了阴极内部,渗入量最大的是沥青基TiB2-C复合阴极,其中Na的平均渗入量(质量分数)为1.36%,K的平均渗入量为2.36%。在树脂基TiB2-C复合阴极中,K和 Na的渗入量普遍较小,其中又以酚醛基TiB2-C复合阴极的渗入量最小,其中Na的平均渗入量为0.211%, K的平均渗入量为0.659%。从上至下,阴极中K和Na的含量逐渐降低,同一区域中处,K的含量大于Na的含量。

图4 电解后阴极剖面分析部位示意图Fig.4 Sketch map for analytical position of cross-section of specimen after electrolysis

图5 电解后各阴极剖面不同区域K和Na的质量分数Fig.5 Mass fraction of K and Na in different sites of cathode cross-section after electrolysis
在电解过程中,K和Na会以2种存在形式渗透进入阴极内部:一种是 NaF,Na3AlF6,K3AlF6和K5Al3F14等形式[18],另一种则是碱金属形式[19]。以碱金属形式存在的K和Na从2个方面综合作用对阴极的耐腐蚀性能产生影响。一方面,碱金属K和Na与复合阴极中的碳质组分反应生成相应的插层化合物[CxM(K, Na)],引起复合阴极的膨胀,当膨胀量达到一定程度时,便会造成阴极的破损;另一方面,碱金属K和Na的渗入会引起复合阴极的冲蚀。这主要是因为碱金属K和Na会与C和K3AlF6或Na3AlF6共同作用生成Al4C3,而Al4C3的不断溶解会引起铝电解阴极的冲蚀。由图5可知:沥青基TiB2-C复合阴极中K和Na的渗入量较多,K和Na对其所造成的影响也较大,说明沥青基TiB2-C复合阴极的耐腐蚀性能较差。而树脂基TiB2-C复合阴极中K和Na的渗入量普遍较少,其中又以酚醛基TiB2-C复合阴极中的K和Na渗入量最少,因而K和Na对其所造成的影响也最小。这说明树脂基TiB2-C复合阴极,尤其是酚醛基TiB2-C复合阴极的耐腐蚀性能较好。此外,由于金属K渗透进入阴极所形成的插层化合物多为低阶,而金属 Na渗透进入阴极所形成的插层化合物多为高阶,这使得在同一区域,K的含量高于Na的含量[20]。
2.3 TiB2-C复合阴极铝液润湿性及阴极-铝液界面分析
图6所示为电解后阴极试样轴向剖面形貌。从图6可以看出:不同黏结剂基TiB2-C复合阴极电解后均能保持完整,表面无破损、无裂纹,内部未见明显的电解质渗透;不同黏结剂基TiB2-C复合阴极表面均紧紧覆盖着一层铝液,铝液和阴极之间相互渗透,与碳质阴极相比,各TiB2-C复合阴极均表现出了良好的铝液润湿性,这一方面降低了电解过程中阴极铝的波动,同时也起到了抵御碱金属和电解质渗透的作用。

图6 电解后阴极剖面形貌Fig.6 Morphologies of cross-section after electrolysis
良好的铝液润湿性是 TiB2基可润湿性阴极所必须具备的基本功能[19]。纯 TiB2与金属铝液完全润湿,因此,根据复合材料的理论[21],只要该复合材料中含有TiB2,其与铝液的润湿性就会得到改善。本实验所制备的阴极在未进行热处理之前,生坯中TiB2的含量均已达到 75%,而在阴极生坯热处理的过程中,不同种类的黏结剂均存在着一定的热分解,这使得热处理后的阴极中,TiB2的含量将超过75%;因此,本实验所制备的 TiB2-C复合阴极与铝液均有着良好的润湿性,这与国内外有关学者的研究结果类似[10,22-23]。上述结果同时也说明,在TiB2含量一定的条件下,TiB2-C复合阴极的铝液润湿性与黏结剂的种类无关。
图7所示为电解后TiB2-C复合阴极与铝液之间的界面层。从图7可以看出:不同黏结剂基TiB2-C复合阴极与铝液之间的界面层均出现了少量的黄色物质Al4C3。生成Al4C3的反应见式(3)和(4)[16]。
由上述分析可知:无论使用何种黏结剂,Al4C3的生成都是不可避免的。然而,相对于碳质阴极,TiB2-C复合阴极表面所生成的这部分碳化铝,并不会对阴极的耐腐蚀性能产生极端的影响。这主要得益于TiB2-C复合阴极所具有的良好的铝液润湿性。
Al4C3对阴极耐腐蚀性能所产生的影响,主要是由于其不断地溶解。对于碳素阴极,由于其与铝液的润湿性较差,在电解过程中,部分电解质到达阴极与铝液的界面层,这部分电解质当中的一些组分与 Al4C3发生反应(见式(5)),造成Al4C3的溶解[16]。
Al4C3的不断溶解会使反应式(3)和(4)向右移动,生成更多的Al4C3,周而复始,便会引起TiB2-C复合阴极中碳质黏结剂及骨料的蚀损,导致阴极耐腐蚀性能下降。
对于沥青、呋喃、酚醛和环氧基TiB2-C复合阴极,由于其具有良好的铝液润湿性,在电解过程中,虽然不可避免地生成了Al4C3,但这部分Al4C3并不会溶解至铝液之中,也不会与铝液发生反应。同时,良好的铝液润湿性也使得到达铝液与阴极界面层间的电解质非常有限。当界面层间生成的 Al4C3积累达到一定含量时,反应方程式(3)和(4)即达到平衡,不再会生成更多Al4C3。因而,对于沥青、呋喃、酚醛和环氧基TiB2-C复合阴极,Al4C3的生成对其耐腐蚀性能的影响是非常有限的。

图7 电解后金属铝与阴极界面层Fig.7 Interface layer between molten aluminum and cathode after electrolysis
3 结论
(1) 黏结剂种类对TiB2-C复合阴极中碱金属的渗透速率影响明显。在黏结剂含量为 14%时,沥青基TiB2-C复合阴极中碱金属的渗透速率较大,达到10.6 mm/h,而呋喃、酚醛、环氧基 TiB2-C复合阴极中碱金属的渗透速率较小,其中又以酚醛基TiB2-C复合阴极中碱金属的渗透速率最小,为4.72 mm/h。
(2) 不同黏结剂基TiB2-C复合阴极的耐腐蚀性能不同。在黏结剂含量为14%时,沥青基TiB2-C复合阴极的腐蚀率最高,为8.09 mm/a,而呋喃、酚醛、环氧基 TiB2-C复合阴极的腐蚀率较低,其中又以酚醛基TiB2-C复合阴极的腐蚀率最低,为3.05 mm/a。
(3) 在电解过程中,元素K和Na由上至下渗透进入沥青、呋喃、酚醛和环氧基TiB2-C复合阴极中,并对阴极的耐腐蚀性能产生影响,K比Na有着更强的渗透能力。
(4) 不同黏结剂基TiB2-C复合阴极与铝液的润湿性良好,这使得在其与铝液界面处所生成的 Al4C3对阴极耐腐蚀性能的影响有限。
(5) 在低温电解质[K3AlF6/Na3AlF6]-AlF3-Al2O3熔体中电解时,树脂基TiB2-C复合阴极表现出较好的耐腐蚀性能,以树脂为黏结剂对现有黏结剂体系进行改性是十分必要的。
[1] James W E, Halvor K. Sustainability, climate change, and greenhouse gas emissions reduction: Responsibility, key challenges, and opportunities for the aluminum industry[J]. JOM,2008, 60(8): 25-31.
[2] James W E. The evolution of technology for light metals over the last 50 years: Al, Mg, and Li[J]. JOM, 2007, 59(2): 30-38.
[3] Kvande H. Inert electrodes in aluminum electrolysis cells[J].Light Metals, 1999(1): 369-376.
[4] Welch B J. Aluminum production paths in the new millennium[J].JOM, 1999, 51(5): 24-28.
[5] Pawlek R P. Inert anodes: An update[J]. Light Metals, 2002(1):449-456.
[6] Kvande H, Haupin W. Inert anodes for Al smelters: Energy balances and environmental impact[J]. JOM, 2001, 53(5):29-33.
[7] Jacobs T B, Brooks R. Electrolytic reduction of aluminum:United States, 5279715[P]. 1994-01-18.
[8] 高炳亮. 低温铝电解新研究[D]. 沈阳: 东北大学材料与冶金学院, 2003: 3-10.
GAO Bing-liang. New studies on low-temperature aluminum electrolysis[D]. Shenyang: Northeastern University. School of Material and Metallurgy, 2003: 3-10.
[9] Morten S, Oye H A. Cathodes in aluminum electrolysis[M].Düsseldorf: Aluminium-Verlag, 1994: 66-73.
[10] Mcminn C J. Review of RHM cathode development[J]. Light Metals, 1992(1): 419-425.
[11] PAWLEK R P. Cathodes wettable by molten aluminum for aluminum electrolysis cells[J]. Aluminum, 1990, 66(8):573-582.
[12] LÜ Xiao-jun, XU Jian, Lai Yan-qing, et al. Effects of pitches modification on properties of TiB2-C composite cathodes[J].Light Metals, 2009(1): 1145-1149.
[13] Ibrahiem M O, Foosnaes T, Oye H A. Stability of TiB2-C composite coatings[J]. Light Metals, 2006: 691-696.
[14] Oye H A, Nora V D, Duruz J J. Properties of a colloidal alumina-bonded TiB2coating on cathode carbon materials[J].Light Metals, 1997: 279-286.
[15] Stevens D A, Dahn J R. The mechanisms of lithium and sodium insertion in carbon materials[J]. Journal of The Electrochemical Society, 2001, 148(8): 803-811.
[16] Vasshaug K, Foosnaes T, Haarberg G M, et al. Formation and dissolution of aluminum carbide in cathode blocks[J]. Light Metals, 2009(1): 1111-1116.
[17] Claire H, Albert H, Philippe L. Ternary graphite intercalation compounds associating an alkali metal and an electronegative element or radical[J]. Solid State Sciences, 2004, 6(1): 125-138.
[18] Brilloit P, Lossius L P, Oye H A. Melt penetration and chemical reactions in carbon cathodes during aluminum electrolysis (Ⅰ):Laboratory experiments[J]. Publ Transp Int, 1994, 42(2):1237-1246.
[19] 刘业翔, 李劼. 现代铝电解[M]. 北京: 冶金工业出版社, 2008:241-248.
LIU Ye-xiang, LI Jie. Modern aluminum electrolysis[M]. Beijing:Metallurgical Industry Press, 2008: 241-248.
[20] Claire H, Albert H, Philippe L. Ternary graphite intercalation compounds associating an alkali metal and an electronegative element or radical[J]. Solid State Sciences, 2004, 6(1): 125-138.
[21] 冯小明, 张崇才. 复合材料[M]. 重庆: 重庆大学出版社, 2007:12-23.
FENG Xiao-ming, ZHANG Cong-cai. Composite material[M].Chongqing: Chongqing University Press, 2007: 12-23.
[22] Ibrahiem M O, Foosnaes T, Oye H A. Chemical stability of pitch-based TiB2-C coatings on carbon cathodes[J]. Light Metals,2007(1): 1041-1046.
[23] 李庆余. 铝电解用惰性可润湿性 TiB2复合阴极涂层的研制与工业应用[D]. 长沙: 中南大学冶金科学与工程学院, 2003:39-46.
LI Qing-yu. Development and industrial application of wettable inert TiB2cathodic composite coating for aluminum electrolysis[D]. Changsha: Central South University. School of Metallurgical Science and Engineering, 2003: 39-46.

