改性活性炭催化水解羰基硫
王红妍,易红宏,唐晓龙,于丽丽,杨丽娜
(昆明理工大学 环境科学与工程学院,云南 昆明,650093)
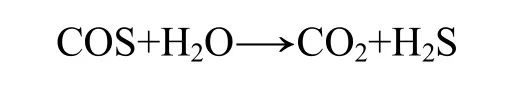
随着现代化学工业迅速发展和人民生活的日益提高,天然气、石油气、焦炉气、水煤气和半水煤气等被广泛地应用于各种化工过程和人民日常生活中。而这些气体中都含有硫化物。磷化工产业是云南省的支柱产业之一,磷化工行业的尾气中除含大量的一氧化碳(CO)之外,还含有硫化氢(H2S)和羰基硫(COS)等有毒有害气体成分。COS很容易引起催化剂中毒失活,对工业生产的设备有腐蚀作用。此外,不经处理排放到大气中的 COS能形成二氧化硫,促进光化学反应,并最终转化为硫酸盐气溶胶,带来严重的环境问题[1-7];因此,进行COS脱除研究对CO资源化利用具有重要的意义。COS的化学活性比H2S的化学活性小得多,其酸性和极性均比H2S的弱。一般用于脱除H2S的方法不能有效地完全脱除COS[8]。目前,主要的脱除技术有还原法、水解法、吸收法、吸附法、光解法及氧化法等。近年来,用水解法脱除工业气流中的COS受到越来越多的重视,因为水解产物H2S和CO2比COS更易去除[9]。COS的催化水解的反应方程为:
目前,人们对COS水解的研究主要集中在金属氧化物如Al2O3, ZrO2, TiO2和它们的混合物[10]。最近,活性炭由于其具有大量的孔结构和低成本而成为水解催化剂载体研究的热点。已有文献报道通过铁锰共沉淀以及添加铈等稀土元素得到的铁锰系催化剂对COS具有较好的去除效果[11-12],但将以活性炭为载体,以锰为活性组分的催化剂应用于COS的去除还未见报道。为此,本文作者以浸渍法制备锰改性活性炭催化剂,对催化剂在低温条件下脱除COS的性能进行研究。
1 实验
1.1 催化剂制备
1.1.1 载体预处理
催化剂载体选用煤质活性炭(LJ-40)其表面积为606.06 m2/g,将其磨碎筛分成粒径为250~380 μm。分别用自来水和蒸馏水洗3~4次,然后,在1 mol/L的KOH溶液煮沸1.5 h,再用蒸馏水洗至pH=6.0左右;放入烘箱中在120 ℃干燥3~4 h,烘干后备用。
1.1.2 Mn/AC 催化剂制备
称取一定量的前驱体KMnO4,溶解于蒸馏水中,称取定量活性炭,使锰氧化物与活性炭质量比为3%,搅拌均匀后置于超声洗涤器浸渍30 min;浸渍后的活性炭置于干燥箱在120 ℃干燥3 h;干燥后的活性炭置于马弗炉中在300 ℃焙烧3 h;称取KOH(KOH与活性炭质量比为8%)并溶解,加入焙烧后的催化剂,搅拌均匀后置于超声洗涤器浸渍30 min;浸渍后的活性炭再置于干燥箱在130 ℃干燥3 h干燥即得Mn/AC催化剂。
1.2 催化剂活性评价
1.2.1 评价装置
催化剂活性评价实验装置如图1所示。实验采用钢瓶气(99.99% N2,1% COS,99.999% O2和 99.5%CO,体积分数),经质量流量计2进入混合罐3,充分混合后经过干燥器4和水饱和器5对实验气体进行湿度恒定,在套管式反应器6进行反应,其中,带循环水的水浴装置7用来将水循环使得反应器温度恒定,反应后气体通过尾气吸收后排空。
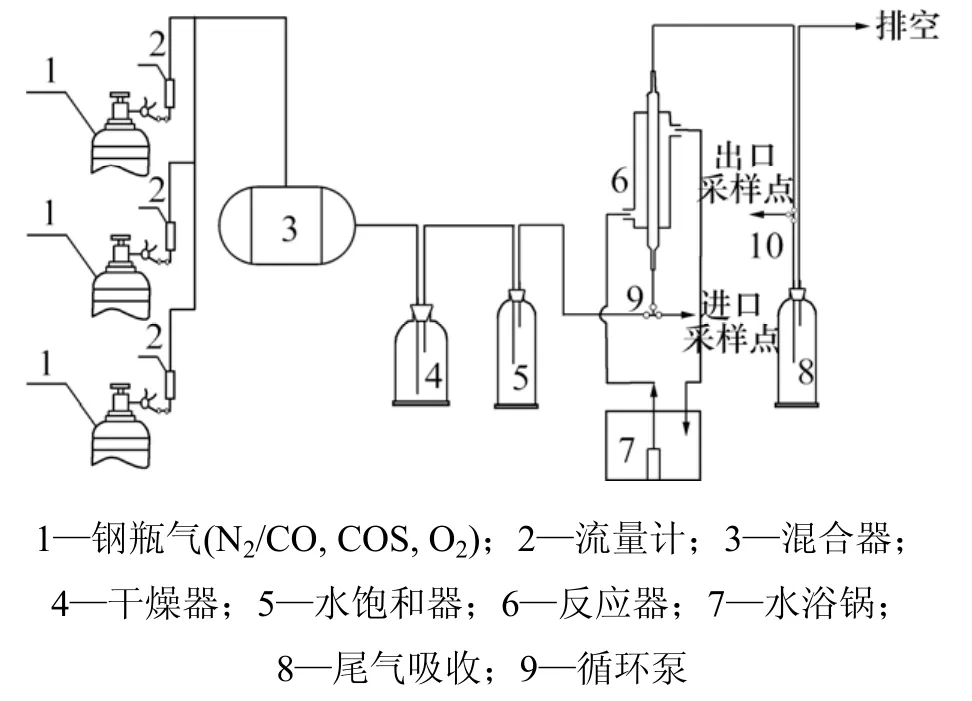
图1 催化剂活性评价实验装置图Fig.1 Experimental apparatus of experimental system
1.2.2 评价条件
反应器规格为8 mm×200 mm(直径×高度)的固定床石英反应器;实验所用 COS的质量浓度为 0.9~2.5 g/m3,催化剂用量为1.00 g,空速为1 000~2 500 h-1,反应温度为40~70 ℃,相对湿度为2.40%~6.20%,进出口COS的浓度采用GC-508气相色谱仪测定。
1.2.3 评价指标
根据不同的实验要求调整反应温度、空速及COS浓度等参数,用针筒注射器采样,用 GC-508气相色谱仪测进出口浓度。当测得的COS去除效率达到90%时,认为催化剂已穿透。
去除效率计算公式为:
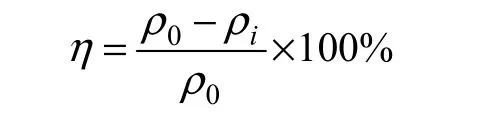
其中:η为COS去除效率,%;0ρ为进口平均质量浓度,mg/m3;iρ为出口质量浓度(i=1, 2, 3, …),mg/m3。
2 结果与讨论
2.1 反应温度对改性催化剂性能的影响
反应温度是影响催化剂脱硫性能的主要因素,因此,有必要对温度进行考察。催化剂在不同温度下COS去除效率随时间变化曲线如图2所示。从图2可以看到:该 Mn/AC催化剂有较好的脱硫性能。这是由于金属氧化物中的离子外层电子的未充满结构使其具有较大的有效核电荷,对配体具有较强的吸引力,在反应中与产物有很强的形成配体化合物的倾向,作为中间产物起配位催化作用,并可提供适宜的表面反应,因此,对COS转化成H2S起到催化作用[11]。
从不同温度下脱硫情况来看,随着温度的升高,COS水解去除效率升高,尤其是当温度从40 ℃升高到50 ℃时,COS去除效率增加幅度较大;在40 ℃时,反应1 h后COS的去除效率已下降至90%,而在50 ℃反应6 h后,去除效率仍保持在90%以上。从图2可看到,在70 ℃持续99%以上效率时间较长,但一旦出口检测到COS,去除效率就迅速下降,这可能是因为催化剂有特定的硫容,一旦达到很快穿透。当温度高于50 ℃后,COS去除效率增加的趋势减缓,尤其是当温度从50 ℃升高到60 ℃时,COS去除率增加最缓慢。当前,人们对COS水解的研究工作主要集中在200 ℃以上,此外,能源危机已引起全球范围的关注,因此,选择较低的反应温度具有非常重要的意义。实验结果表明:温度是影响COS水解的重要因素。
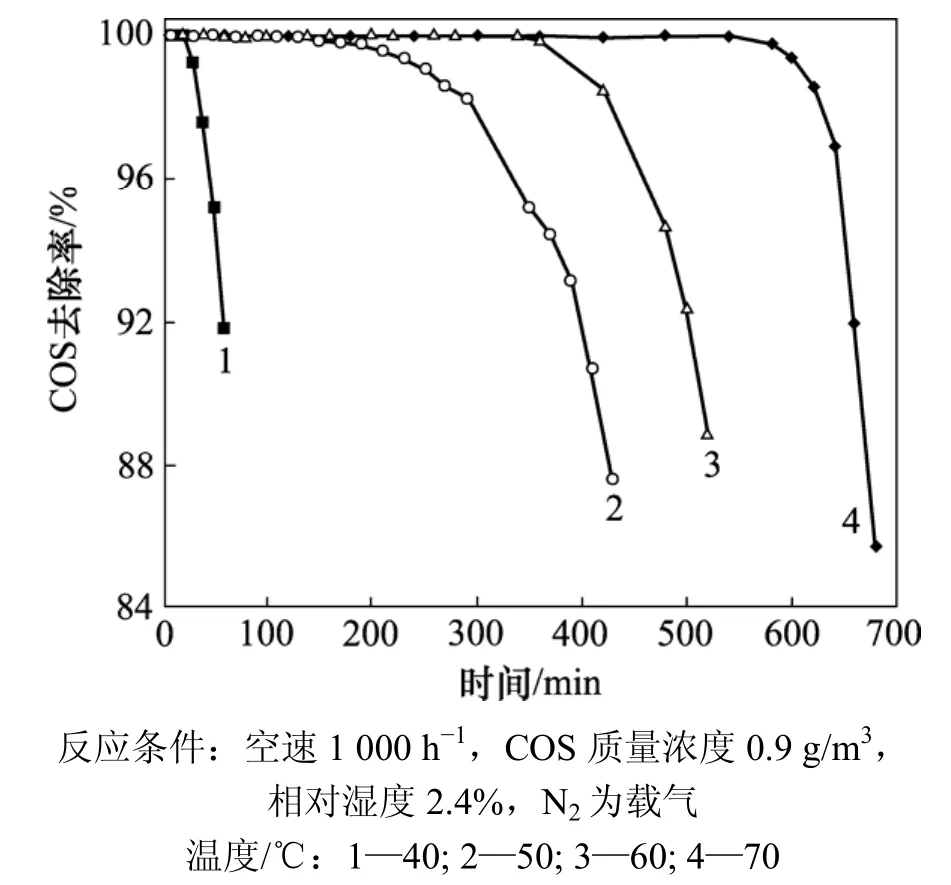
图2 反应温度对COS催化水解的影响Fig.2 Effect of reaction temperature on catalytic hydrolysis of COS
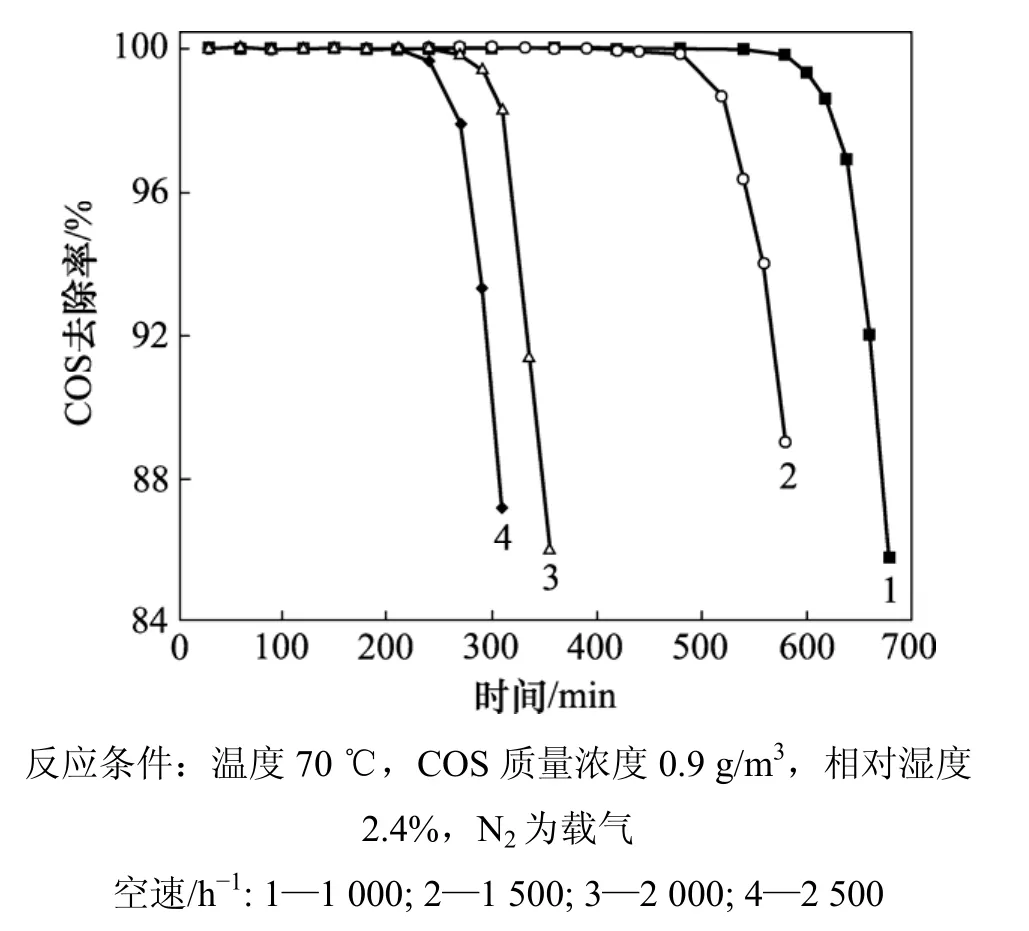
图3 反应空速对COS催化水解的影响Fig.3 Effect of gas hourly space velocity on catalytic hydrolysis of COS
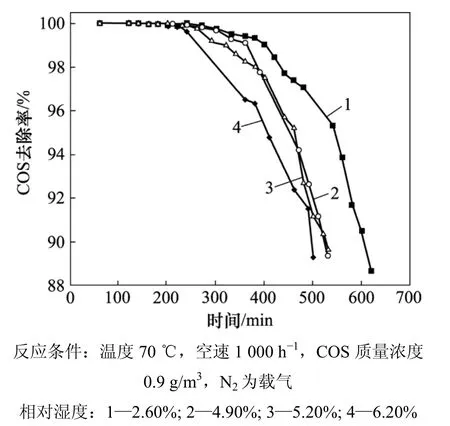
图4 相对湿度对COS催化水解的影响Fig.4 Effect of relative humidity on catalytic hydrolysis of COS
2.2 反应空速对改性催化剂性能的影响
反应空速也是影响催化剂脱硫性能的一个主要因素。不同空速条件对催化剂脱硫性能的影响结果如图3所示。从图3可以看出:随着空速的增加,催化剂的脱硫性能下降。这可能是因为:空速增加,气体分子透过界面的速率提高,气体分子在催化剂活性表面或活性中心单位体积停留时间缩短,催化剂的平均吸附速率下降,影响转化和水解反应的进行,从而使COS去除效率下降[13]。但是,当空速从1 000 h-1升高到1 500 h-1,从2 000 h-1升高到2 500 h-1时,下降趋势并不显著。
2.3 相对湿度对改性催化剂性能的影响
催化剂在不同水汽含量下 COS去除效率随时间变化曲线如图4所示。从图4可以看到:COS去除效率随原料气水汽含量的增加而降低;当水汽含量从3.60% 增加到 4.90%,从 5.20%增加到 6.20%时,去除效率迅速下降。原料气中的水汽含量对改性催化剂的脱硫性能有一定影响,当水汽含量较低时,硫容会有一定的提高,这是因为在水解反应中水是一种反应物,水汽含量增多会促进反应向水解的正方向进行;但随着水汽含量的继续上升,催化剂的活性反而下降。这主要是由于过量的水吸附在碱性位上,阻止了COS分子与碱性活性中心的吸附结合而造成的[14]。还有另一种解释是:水汽凝结在催化剂微孔中,因此,在实际应用中,采用脱水或提高操作温度的措施使床层温度高于操作压力下气体露点温度20~30 ℃[15]。
2.4 原料气COS质量浓度对改性催化剂性能的影响
图5所示为不同进口COS质量浓度下COS去除效率随时间变化曲线。从图 5可以看出:随着 COS进口质量浓度的增加,COS的去除效率下降,尤其当质量浓度从0.9 g/m3增加到1.5 g/m3,从2.1 g/m3增加到2.5 g/m3,去除效率下降迅速;但当质量浓度从1.5 g/m3增加到2.1 g/m3时,去除效率下降幅度缓慢。可能的原因是:催化剂有特定的硫容,当质量浓度增加时,催化剂去除COS的负荷加大,去除效率下降。实验结果也表明:该催化剂能耐受高硫的冲击并能适应高硫含量工况条件。
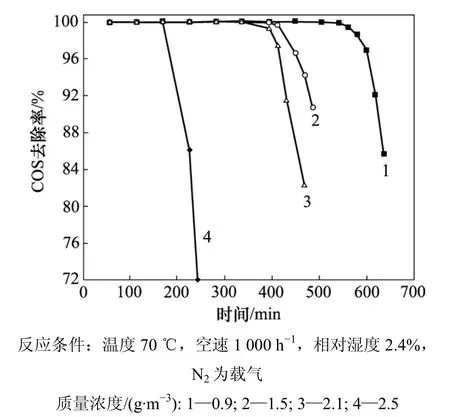
图5 COS质量浓度对COS催化水解的影响Fig.5 Effect of COS concentration on catalytic hydrolysis of COS
2.5 改性催化剂稳定性
黄磷尾气除了含有微量的COS,主要成分是CO,含量占 85%左右,同时还有微量 O2及其他杂质。分别在3种气源条件下研究改性催化剂的稳定性对COS去除效率的影响,结果如图6所示。从图6可以看到:当原料气中含有 O2时,COS的去除效率下降;不含O2时,反应进行300 min时COS去除效率仍为90%,而当原料气中含有1% O2时,COS反应200 min时去除效率已下降到90%。可能的原因是:COS与催化剂表面的—OH在常温下反应生成表面中间体,在无氧的条件下,物种发生催化水解生成H2S和CO2。有氧时,在表面氧和—OH的作用下转化为表面和,进一步氧化生成表面。H2S可与表面氧物种反应生成活性很高的单质硫,H2S或单质硫在表面氧物种的作用下转化为硫酸盐[16]。
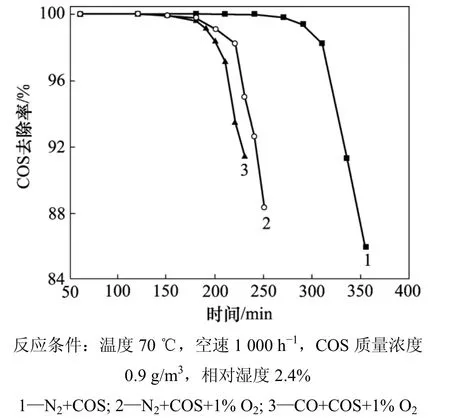
图6 催化剂稳定性对COS催化水解的影响Fig.6 Effect of catalyst stability on catalytic hydrolysis of COS
此外,从图6可以看到:当以CO为载气且在有氧条件下时,COS去除效率变化不大,说明该催化剂适用于黄磷尾气中微量COS的去除。本实验也表明该催化剂具有较稳定的催化性能。
3 结论
(1) 该Mn/AC催化剂在温度为40~70 ℃,空速为1 000~2 500 h-1,水汽含量为2.40%~6.20%,COS质量浓度为 0.9~2.5 g/m3下具有较高的脱硫精度和稳定性。
(2) 该 Mn/AC催化剂适用于黄磷尾气中微量COS的脱除。催化剂中毒的机理可能是:COS在脱除过程中氧化生成的硫酸盐毒化了表面碱性羟基活性位。
[1] Svoronos P D N, Bruno T J. Carbonyl sulfide: A review of its chemistry and properties[J]. Industrial and Engineering Chemistry Research, 2002, 41(22): 5321-5336.
[2] Rhodes C, Riddel S A, West J, et al. The low-temperature hydrolysis of carbonyl sulfide and carbon disulfide: A review[J].Catalysis Today, 2000, 59(3/4): 443-464.
[3] 梁丽彤. 改性氧化铝基高浓度羰基硫水解催化剂研究[D]. 太原: 太原理工大学煤化工研究所, 2005: 1-3.
LIANG Li-tong. The study on modified alumina based catalyst for high concentration carbonyl sulfide hydrolysis[D]. Taiyuan:Taiyuan University of Technology. Research Institute for Chemical Engineering of Coal, 2005: 1-3.
[4] Sparks D E, Morgan T, Patterson P M, et al. New sulfur adsorbents derived from layered double hydroxides Ⅰ:Synthesis and COS adsorption[J]. Applied Catalysis B:Environmental, 2008, 82(3/4): 190-198.
[5] Toops T J, Crocker M. New sulfur adsorbents derived from layered double hydroxides Ⅱ: DRIFTS study of COS and H2S adsorption[J]. Applied Catalysis B: Environmental, 2008(82):199-207.
[6] ZHANG Yi-qun, XIAO Zhong-bin, MA Jian-xin. Hydrolysis of carbonyl sulfide over rare earth oxysulfides[J]. Applied Catalysis B: Environmental, 2004, 48: 57-63.
[7] SHANGGUAN Ju, LI Chun-hu, GUO Han-xian. Hydrolysis of carbonyl sulfide and carbon disulfide over alumina based catalysts Ⅰ: Study on activities of COS and CS2hydrolysis[J].Journal of Natural Gas Chemistry, 2008, 7(1): 16-23.
[8] Sakanishi K, WU Zhi-heng, Matsumura A, et al. Simultaneous removal of H2S and COS using activated carbons and their supported catalysts[J]. Catalysis Today, 2000, 104(1): 94-100.
[9] LI Xin-xue, LIU Ying-xin, WEI Xiong-hui. Hydrolysis of carbonyl sulfide in binary mixture of diethylene glycol diethyl ether and water[J]. Chinese J Chem Eng, 2005, 13(2): 234-238.
[10] Laperdrix E, Justin I, Costentin G, et al. Comparative study of CS2hydrolysis catalyzed by alumina and titania[J]. Applied Catalysis B: Environmental, 1998, 17: 167-173.
[11] 赵海, 王芳芳, 伍星亮, 等. 复合金属氧化物脱除羰基硫的研究[J]. 煤炭转化, 2007, 30(2): 31-35.
ZHAO Hai, WANG Fang-fang, WU Xing-liang, et al Research on COS removal by compound-metal oxide desulfurizer[J]. Coal Conversion, 2007, 30(2): 31-35.
[12] ZHAO Hai, ZHANG De-xiang, WANG Fang-fang, et al.Modification of Fe-Mn mixed oxide COS removal sorbent by rare-earth oxides addition[J]. Process Safety and Environmental Protection, 2009, 87: 274-280.
[13] 钱红辉, 曾丹林, 王光辉, 等. 改性氧化铁脱硫剂脱除羰基硫性能的研究[J]. 化学与生物工程, 2008, 25(9): 16-19.
QIAN Hong-hui, ZENG Dan-lin, WANG Guang-hui, et al. Study on carbonyl sulfide removal performance of modified iron oxide desulfurizer[J]. Chemistry and Bioengineering, 2008, 25(9):16-19.
[14] 梁美生, 李春虎, 郭汉贤, 等. 低温条件下羰基硫催化水解反应本征动力学的研究[J]. 催化学报, 2002, 23(4): 357-362.
LIANG Mei-sheng, LI Chun-hu, GUO Han-xian, et al. Study on reaction kinetics of COS hydrolysis at lower temperature[J].Chinese Journal of Catalysis, 2002, 23(4): 357-362.
[15] 王国兴, 孔渝华. EH-1Q常温COS水解催化剂的性能及工业应用[J]. 氮肥设计, 1994, 32(1): 34-38.
WANG Guo-xing, KONG Yu-hua. Properties of room temperature EH-1Q COS hydrolysis catalyst and its application in industry[J]. Nitrogen Design, 1994, 32(1): 34-38.
[16] 刘俊锋, 刘永春, 薛莉, 等. A12O3上羰基硫常温催化水解的氧中毒机理[J]. 物理化学学报, 2007, 23(7): 997-1002.
LIU Jun-feng, LIU Yong-chun, Xue Li, et al. Oxygen poisoning mechanism of catalytic hydrolysis of COS over Al2O3at room temperature[J]. Acta Phys-Chim Sin, 2007, 23(7): 997-1002.

