消痰化瘀抗纤方药物血清对HSC增殖的影响
兰咏梅 韩 涛 王佳蕾
(西北民族大学医学院,甘肃 兰州 730030)
肝星状细胞(Hepatic stellate cells,HSC)是目前研究肝纤维化(HF)发生机制中最受重视的细胞。目前认为,肝细胞坏死能激活HSC并使之增殖。HSC活化是HF最终的共同通路,是HF发生的细胞学基础。消痰化瘀抗纤方(简称“抗纤方”)在临床应用10余年,收到良好效果。本课题组在以往临床应用基础上,用细胞分子生物学方法探讨抗纤方防治HF的作用机制,为中医药防治HF的临床研究提供实验依据。
1 材料与方法
1.1 材料
1.1.1 细胞株 肝星状细胞株HSC-T6,购于首都医科大学附属北京友谊医院肝病研究中心,为SV40转染SD大鼠HSC。
1.1.2 动物 SD大鼠,30只,180~220 g,SPF级,雌雄各半,由甘肃中医学院科研实验中心提供,实验动物质量合格证许可证号:SCXK(甘)2004-0006。
1.1.3 药物 抗纤方由瓦楞子、当归、茵陈、青皮等七味中药组成,购自甘肃中医学院附属医院中药房。复方鳖甲软肝片(福瑞中蒙药科技股份有限公司,批准文号:Z19991011)。
1.1.4 主要试剂与仪器 DMEM培养基干粉(美国,Gibco公司),胰蛋白酶(美国,Amresco公司),胎牛血清(杭州四季青生物制品公司),L-谷氨酰胺、MTT、DMSO(美国,Sigma公司)。CO2培养箱(日本,SANYO公司),净化工作台(上海新苗医疗器械制造有限公司),荧光倒置生物显微镜(麦克奥迪),酶标仪(美国,BIO-RAD公司),凝胶成像分析仪(上海天美科学仪器有限公司),紫外分光光度计、TC-512型 PCR仪(英国TECHNE公司)。
1.2 方法
1.2.1 药物血清制备
1.2.1.1 抗纤方水煎液制备 根据人与大鼠间的体表面积换算法〔1〕得到大鼠抗纤方水煎液所需高浓度(11.542 g/ml),相当于成人(70 kg)每日1剂服用量的13.5倍。将中药材用三级水清洗2遍,加入三级水1 400 ml,浸泡30 min,加热沸腾后煎煮30 min,煎煮2次;第二煎加水700 ml,两次煎液过滤合并共900 ml〔2〕浓缩至11.542 g/ml。将此液体分别用一级水稀释到相当于成人每日1剂服用量的1.5、4.5倍,分别含生药1.282、3.848 g/ml。
1.2.1.2 复方鳖甲软肝片水溶液制备 将药物研磨为极细粉末,与成人正常服用剂量相当,一级水溶解,制成混悬液,浓度54 mg/ml。
1.2.1.3 含药血清制备〔3〕取SD大鼠30只,采用随机数字法分为5组,每组6只,雌雄各半。分别为正常血清组、复方鳖甲软肝片组(软肝片组)、抗纤方高剂量(13.5倍)组、中剂量(4.5倍)组、低剂量(1.5倍)组。除正常血清组灌胃等量0.9%NaCl注射液,其余各组灌胃相应浓度的药物,分2次灌服,连续6 d。第6天晚,开始禁食,不禁水,第7天按常规量灌胃1次,2 h后,腹腔注射麻醉,股动脉采血,室温静置4 h,3 000 r/min,15 min,离心分离血清。将同一组动物相同条件下所采血清混合,56℃水浴中灭活30 min,0.22μm微孔滤膜过滤,密封后-20℃冷藏保存备用。临用前加入DMEM培养液,配成含10%药物血清的培养液。
1.2.2 细胞基本实验
1.2.2.1 细胞培养和传代 采用含10%胎牛血清的DMEM培养液,在37℃,5%CO2及饱和湿度下培养。5~7 d后,当细胞相互接近呈单层致密状时,倒掉培养瓶中的培养液,用PBS清洗细胞,去除残留含血清培养液〔4〕。加入0.125%胰蛋白酶2 ml消化,静置5 min,在显微镜下观察。当细胞的形状模糊趋向于球形,倒掉胰蛋白酶,加入含血清的DMEM培养液10 ml终止消化,吹打瓶壁上的细胞成悬液,1 000 r/min,5 min,离心,去除上清液,收集细胞沉淀,加入新的含10%胎牛血清的培养液,用吸管吹打使之重新形成细胞悬液,接种传代。
1.2.2.2 细胞冻存和复苏 用胰蛋白酶把单层生长的对数生长期细胞消化下来,依据传代的方法把消化好的细胞收集于离心管离心。收集细胞沉淀,加入配制好的细胞冻存液,吹打均匀,分装入无菌冻存管中,每管1 ml。将用封口膜封好的冻存管液氮冻存。复苏时将冻存管迅速从液氮中取出,直接投入37℃水浴中,轻轻摇动使其尽快融化。开启冻存管,加入培养液与细胞悬液混合,低速离心,去除含DMSO的上清液,用生长培养液稀释,接种于培养瓶,放入CO2培养箱中培养。
1.2.2.3 细胞计数 首先用吸管吹打形成单细胞悬液,在血细胞计数板上盖玻片一侧加微量的细胞悬液,在显微镜下观察计数板四角大方格中的细胞数。细胞压中线时,只计左侧和上方者,不计右侧和下方者。根据公式计算得出细胞密度:细胞密度(个/ml原液)=(4个大格细胞数之和/4)×104。
1.2.3 细胞增殖实验 以MTT比色法〔5,6〕检测HSC的增殖。传代培养的HSC,取处于对数生长期细胞,消化为单细胞悬液,通过细胞计数,向细胞中加入含10%胎牛血清的DMEM培养液调整细胞浓度为1×105个/ml。细胞接种于96孔培养板中,每孔100μl,培养24 h后弃上清,换为10%含药血清培养液培养细胞,进行以下分组实验,每组设6个复孔。1组:正常血清组;2组:软肝片组;3组:抗纤方高剂量组;4组:抗纤方中剂量组;5组:抗纤方低剂量组。分别在培养箱中培养24、48、72 h后,在显微镜下观察细胞生长情况,每孔加入MTT溶液10μl,置37℃培养箱中继续孵育4 h,终止培养,小心弃去孔内培养上清液,每孔加入100μl DMSO,10 min振荡混匀,使结晶充分溶解。选择490 nm波长,以空白对照孔调零,在酶标仪上测定各孔光吸收度(A)值。抑制率=(对照孔A490-实验孔A490)/对照孔A490×100%。
1.3 统计学分析 统计数据均用x±s表示,采用 SPSS16.0软件处理,多组间单因素比较采用方差分析,应用最小显著差法(LSD)进行两两比较。
2 结果
2.1 各组药物血清作用于HSC不同时间对HSC增殖抑制率的影响比较 结果显示,药物血清干预24 h后,软肝片组与正常血清组相比更能抑制HSC体外生长(P<0.05),增殖抑制率为3.32%。抗纤方药物血清高、中、低剂量组干预HSC 24 h后与正常血清组相比,对其体外生长抑制作用均有显著性差异(P<0.05),增殖抑制率依次为15.65%,11.91%,7.62%。
药物血清干预48 h后与正常组相比,软肝片组、抗纤方高剂量组、中剂量组、低剂量组对HSC的体外生长抑制作用均有非常显著的差异(P<0.05),增殖抑制率依次为7.06%、18.27% ,13.64% ,9.01% 。
药物血清干预72 h后与正常血清组相比,软肝片组、抗纤方高剂量组、中剂量组、低剂量组对HSC的体外生长抑制作用均有非常显著的差异(P<0.05),增殖抑制率依次为10.20%、21.73%,15.19%,11.42%。抗纤方低剂量组与软肝片组比较,对HSC体外生长的抑制无显著性差异(P>0.05)。可见,与正常血清组相比抗纤方药物血清对HSC的增殖有一定的量-效关系。见图1。
图1 HSC培养及加入药物血清后的HSC(×400)
2.2 各组药物血清对HSC作用不同时间490 nm波长OD值比较 正常大鼠血清干预HSC后,随着时间的延长,细胞的增殖呈增长趋势,HSC细胞活力旺盛,促进HSC的生长。见表1。
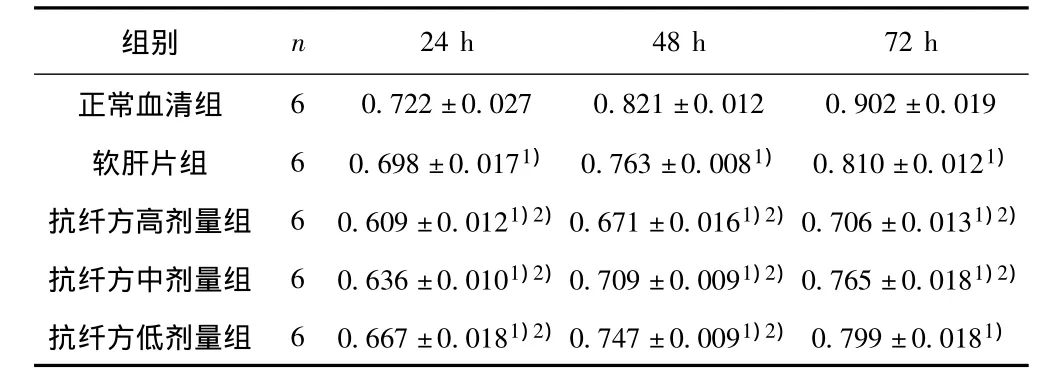
表1 各组药物血清对HSC作用不同时间的OD值(x±s)
3 讨论
HF的形成和发生是一个多因素相互促进、相互制约的结果。目前认为HSC在HF发生和发展过程中起着重要作用,也是目前研究HF发生机制中最受重视的细胞。肝细胞坏死能激活HSC并使之增殖〔7〕,HSC活化是HF最终的共同通路,是HF发生的细胞学基础。对于HF的治疗,目前尚无理想药物。已报道的秋水仙碱、青霉胺等十几种药物虽可抑制HF,但毒副作用较大,故临床上应用受到限制。近年来广泛开展了中药抗纤维化实验与临床研究,为临床治疗提供了许多经验。中医传统上的治则是活血化瘀、软坚消癥。本院韩涛副教授从“痰瘀互结”机制自拟“消痰化瘀抗纤方”,由瓦楞子、茵陈、当归、青皮等中药组成,其特点在于不仅活血化瘀,更为重要的是治痰。该方临床应用已有十余年,疗效较好,有效率为91%。本实验采用MTT比色法检测抗纤方药物血清对HSC生长增殖的影响,旨在从细胞分子生物学水平探讨抗纤方防治HF的作用机制,为中医药防治HF的临床研究提供实验依据。
结果表明,抗纤方药物血清可以显著抑制HSC增殖,与正常血清组比较有显著性差异,并呈现时效和量效关系;当抗纤方高剂量作用HSC 72 h时,抑制作用最为明显(增殖抑制率为21.73%),与文献中的趋势相当〔8~10〕。加入正常大鼠血清培养的HSC,随着时间的延长OD值逐渐增加,且72 h组显著高于24 h组,提示在大鼠血清中含有可直接或间接促进HSC增殖的物质。单纯从OD值分析,抗纤方药物血清干预HSC后,随时间延长细胞增殖趋势上升,但是由于增殖抑制率是通过与对照组对比得出相对比值,正常血清组的OD值上升趋势更大,所以增殖抑制率总体上是上升的。因此,抗纤方药物血清可显著抑制HSC的体外增殖,当高剂量组作用72 h时,抑制作用最强,而且无明显的细胞毒性作用。
1 杜冠华.实验药理学〔M〕.北京:中国协和医科大学出版社,2004:64.
2 高学敏.中药学〔M〕.北京:中国中医药出版社,2002:43.
3 罗焕敏.“血清药理学”与“血浆药理学”〔J〕.中国药理学通报,2003;19(9):1075-6.
4 Riccalton-Banks L,Bhandari R,Fry J,et al.A simple method for the simultaneous isolation of stellate cells and hepatocytes from rat liver tissue〔J〕.Mol Cell Biochem,2003;248(1-2):97-102.
5 马金霞,潘世扬,张 卫,等.MTT比色法用于肿瘤细胞体外药物敏感性试验的检测〔J〕.临床检验杂志,2002;20(2):104.
6 赵宏贤,陈 霞,李昌平,等.粉防己碱对大鼠肝星状细胞增殖及细胞周期的调控〔J〕.现代预防医学,2007;34(23):4437-9.
7 程明亮,杨长青.肝纤维化的基础研究及临床〔M〕.第2版.北京:人民卫生出版社,2002:1-6.
8 刘 成,刘成海,刘 平,等.扶正化瘀方抑制大鼠贮脂细胞增殖的研究〔J〕.中国中医药科技,1997;4(2):97-9.
9 刘成海,刘 成,刘 平,等.扶正化瘀复方药物血清对大鼠肝贮脂细胞增殖及胶原合成的影响〔J〕.中国实验方剂学杂志,1996;2(2):16-9.
10 贺宇彤,刘殿武,李 青,等.抗纤Ⅰ号和硒药物血清对肝星状细胞增殖和凋亡的影响〔J〕.中华中医药杂志,2006;21(4):219-22.

