维泰醇和紫杉醇抗肿瘤转移作用比较
陈 姬,陈 娜,陈小宇,张 波,田 卉,郑秋生
(石河子大学药学院,新疆特种植物药资源教育部重点实验室,新疆石河子 832002)
恶性肿瘤在生长过程中会侵润周围组织或转移到身体的其他部位,这种侵润和转移是恶性肿瘤的一个重要特征,也是肿瘤病人致死和治疗失败的主要原因[1]。小鼠黑色素瘤B16F1细胞因其来源及基因背景清楚,已广泛地用于研究肿瘤发生、转移过程及影响肿瘤发展、转移的相关参数[2]。
紫杉醇(paclitaxel,Fig 2)是目前全世界公认治疗肿瘤的有效药物。维泰醇(alternol,Fig 1)是广东汕头双骏生物有限公司利用红豆杉树皮中的一种微生物菌诱变株,经发酵纯化等工艺生产出的一种新型化合物。由于维泰醇与紫杉醇具有相同的来源,因此我们推测维泰醇有可能同样具有抗肿瘤的活性。本实验比较维泰醇与紫杉醇的抗肿瘤转移及抗血管新生作用。探讨维泰醇是否也同紫杉醇一样具有抗肿瘤转移及抗血管新生的能力。
1 材料与方法
1.1细胞和试剂维泰醇由广东汕头双骏生物有限公司提供,紫杉醇购于Sigma公司。RPMI 1640细胞培养基购于Gibco BRL公司,新生牛血清,胎牛血清购于北京四季青生物工程有限公司。Matrigel购于美国BD公司。MMP-2 ELSAE试剂盒购于武汉博士德生物工程有限公司。
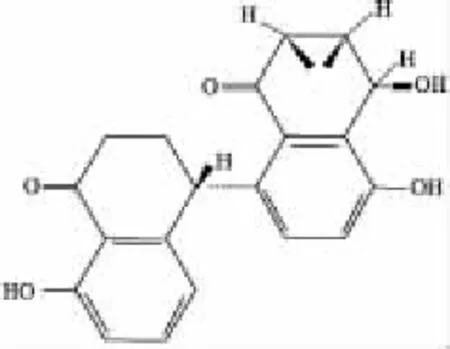
Fig 1 Chemical structure of alternol
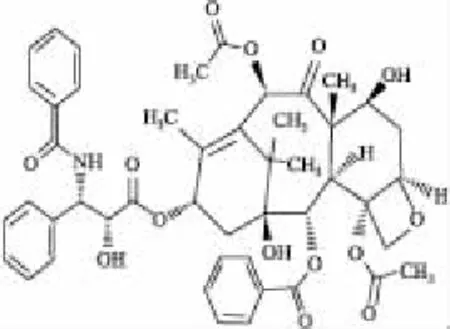
Fig 2 Chemical structure of paclitaxel
1.2SRB法测定药物对B16F1细胞的抑制率取B16F1细胞,加入不同浓度的维泰醇和紫杉醇,终浓度为 5、10、20、40、80、160 nmol·L-1,每个浓度设 6个平行空,酶标仪在波长490 nm处检测各孔OD值。
1.3台盼蓝染色法测定致死率用血球计数板计数细胞,计算细胞死亡率。
1.4B16F1划痕试验按照 Fishman等[3]的试验方法,取细胞于48孔板,细胞至0.9融合度时,以200 μl Tip头均匀划痕,用含0.001的小牛血清的培养液轻轻洗去脱落细胞,各组分别加入不同浓度维泰醇和紫杉醇的无血清培养基,于培养箱孵育48 h至空白组划痕基本愈合。拍照并分析,采用Photoshop 6.0软件计算划痕愈合率。
1.5明胶酶谱实验明胶酶活性测定按照Lalu等[4]的方法。收集细胞上清,明胶酶电泳,结束后,复性,孵育。最后以考马斯亮蓝染色液染色30 min,脱色液脱色至胶条呈蓝色均一背景,亮白色条带。拍照,并进行分析。
1.6MMP-2表达的测定MMP-2表达的测定使用MMP-2(总)ELISA试剂盒。按照试剂盒操作,酶标仪在450 nm测定OD值。
1.7SRB法测定血管内皮细胞活力取ECV304细胞,加入不同浓度维泰醇与紫杉醇,每个浓度设6个平行空,酶标仪在波长490 nm处检测个孔OD值。
1.8吖啶橙/溴化乙锭荧光染色法观察细胞形态取ECV304细胞,加入不同浓度维泰醇与紫杉醇,培养48 h,染色,荧光显微镜下观察、拍照。
1.9血管内皮细胞划痕试验取ECV304细胞,划痕后加入不同浓度维泰醇与紫杉醇的无血清培养基,于培养箱孵育48h至空白组划痕基本愈合。拍照并分析,用Photoshop 6.0软件计算划痕愈合率。1.10管腔样结构实验参照Mezentsev等[5]的方法,将Matrigel胶4℃过夜溶解,加入到24孔培养板,37℃培养箱促凝30 min,用含0.005胎牛血清的RPMI 1640培养基调整ECV304细胞浓度,接种于Matrigel胶上,37℃ 孵育1 h后,洗涤除去未贴壁的细胞,每空分别加入含不同浓度维泰醇与紫杉醇的培养基共同孵育20 h。显微镜观察并拍照。
1.11数据分析所有试验设3个平行组或重复3次,结果以±s表示,以t检验进行组间统计学差异比较。
2 结果
2.1B16F1细胞抑制率比较本试验浓度范围内,维泰醇和紫杉醇对B16F1细胞的增殖均有一定抑制作用,但维泰醇的增殖抑制作用较弱(Fig 3)。在显微镜下观察,80 nmol·L-1的维泰醇和紫杉醇处理后的细胞贴壁仍比较牢固,培养液中未见大量脱落细胞,选择此浓度,在低毒条件下进行维泰醇与紫杉醇的抗肿瘤转移作用的比较。
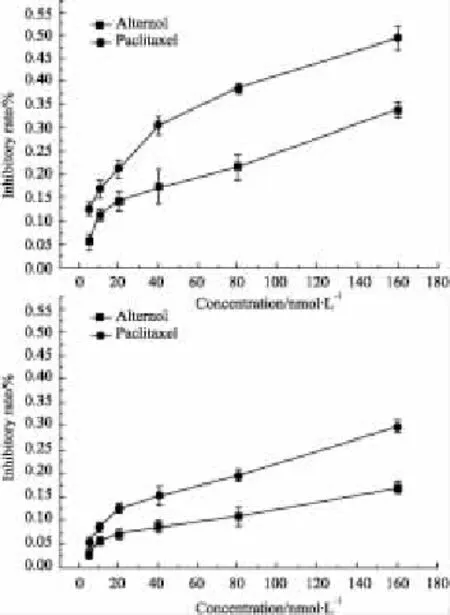
Fig 3 Effects of alternol and paclitaxel on B16F1 cell proliferation and survival
2.2B16F1划痕实验比较划痕后培养基中不含血清,细胞基本不会增殖,划痕愈合完全靠细胞的迁移运动,愈合面积代表肿瘤细胞的迁移运动能力[6]。与空白组相比,80 nmol·L-1维泰醇和紫杉醇均能降低B16F1细胞的运动能力(Fig 4),同浓度时,维泰醇抑制细胞迁移的能力略弱于紫杉醇。
2.3明胶酶谱实验MMP-2降解蛋白出现负染条带的面积和亮度表现细胞分泌MMP-2活力的强弱。与空白相比(Fig 5),80 nmol·L-1的维泰醇和紫杉醇处理后的条带的面积和亮度都有所降低,紫杉醇的条带明显弱于维泰醇,说明维泰醇抑制B16F1细胞分泌MMP-2的能力弱于紫杉醇。
2.4MMP-2表达影响的比较结果显示(Fig 6),与对照比较,80 nmol·L-1的维泰醇和紫杉醇均能降低B16F1细胞的MMP-2表达,且维泰醇的作用略弱于紫杉醇。
2.5血管内皮细胞增殖抑制的比较维泰醇和紫杉醇均能抑制血管内皮细胞ECV304的增殖(Fig 7)。维泰醇和紫杉醇药物浓度均为80 nmol·L-1时,对ECV304细胞的生长抑制率分别为0.33和0.57。
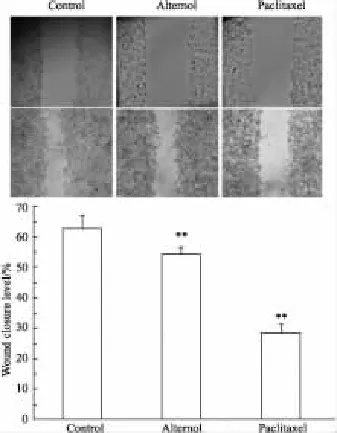
Fig 4 Alternol and paclitaxel inhibited the migration of B16F1 cell in vitro

Fig 5 Effects of alternol and paclitaxel on MMP-2 activity of B16F1 cells detected by gelatin zymography assay
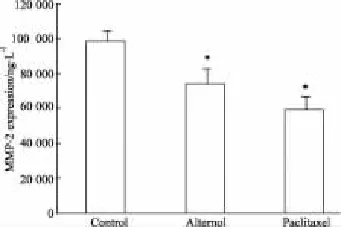
Fig 6 Effects of alternol and paclitaxel on MMP-2 expression of B16F1 cells
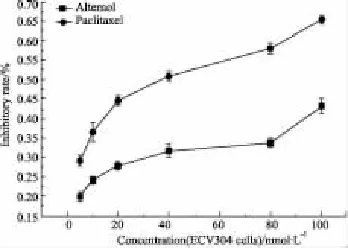
Fig 7 Effects of alternol and paclitaxel on ECV304 cell proliferation Data are presented as±s from six independent experiments.
2.6诱导血管内皮细胞凋亡作用的比较80 nmol·L-1的维泰醇和紫杉醇作用于ECV304细胞48 h后即能够引起明显的细胞凋亡现象(Fig 8),维泰醇组为早期凋亡,紫杉醇组为晚期凋亡。

Fig 8 Effects of alternol and paclitaxel on ECV304 cell survival
2.7血管内皮细胞划痕实验的比较划痕48 h后,空白组细胞基本愈合(Fig 9),维泰醇与紫杉醇处理后的细胞伤痕的愈合程度均降低于空白组,二者均能抑制 ECV304细胞的迁移,浓度为 80 nmol·L-1,维泰醇抑制ECV304细胞迁移的能力弱于紫杉醇。
2.8内皮细胞管腔形成实验的比较肿瘤的生长、侵袭和转移都需要新血管的生成[7-9]。抑制血管生成从而抑制肿瘤在体内的生长和转移是一个重要的研究热点[10]。本实验(Fig 10)中,空白组细胞在matrigel胶重建的基底膜上形成完整的血管网状结构;80 nmol·L-1的维泰醇处理后,血管内皮细胞拉伸程度降低,彼此间连接缝隙变大,部分血管网状结构的完整性发生破坏;80 nmol·L-1的紫杉醇处理后,血管内皮细胞连接处已经逐渐变圆,血管网状结构已经完全被破坏。说明二者均能有效抑制血管内皮细胞管腔样结构的形成,从而对肿瘤内部血管新生产生抑制作用。
3 讨论
癌症治疗的目的在于彻底治愈肿瘤或延长患者生存期或改善患者生活质量。当前主要治疗手段为手术切除、放疗或化疗,尽管手术切除作为早期恶性肿瘤最佳治疗选择,许多肿瘤根治切除后仍会发生转移,一方面局限于目前的诊断手段,不能发现微转移灶,另一方面在于手术切除原发灶促进了肿瘤转移及已有转移灶的生长,大多恶性肿瘤患者最终不是死于肿瘤而是死于肿瘤的转移以及转移引发的并发症。因此,开发一类具有预防恶性肿瘤术后复发或转移作用,无严重不良反应,适于患者长期应用的恶性肿瘤术后的辅助治疗药物势在必行。
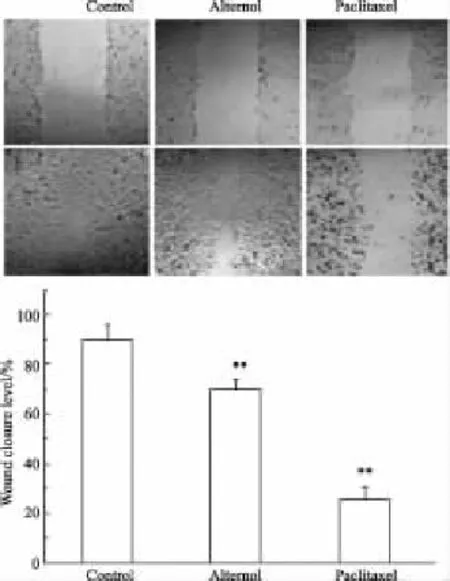
Fig 9 Alternol and paclitaxel inhibited the migration of ECV304 cells in vitro

Fig 10 Tube formation of ECV304 cells inhibited in vitro by alternol and paclitaxel
恶性肿瘤的侵袭和转移是肿瘤细胞和宿主细胞之间相互作用的连续过程,在这个过程中肿瘤细胞必须破坏细胞间质和基底膜组成的细胞外基质(ECM)屏障,这是肿瘤侵袭转移的关键一步[11],在这个过程中细胞会分泌基质金属蛋白酶(MMPs),MMPs的表达能促进细胞株的侵袭能力[12]。研究发现[13],肿瘤侵袭转移的能力与其产生或诱导产生金属蛋白酶的能力呈正相关。肿瘤的转移,不单单是肿瘤细胞自身特性发生变化,还依赖于肿瘤细胞与间质细胞以及细胞微环境之间的相互作用。越来越多的研究表明[14-15],血管形成是肿瘤转化,生长和转移的基础,肿瘤持续生长和转移依赖新生血管,因此抑制血管新生无论对原发肿瘤,还是肿瘤扩散转移都具有重要意义[16]。
本试验结果表明,与紫杉醇相比较,维泰醇具有较低的细胞毒活性,同时具有较好抑制肿瘤细胞和血管内皮细胞的迁移能力。这提示维泰醇具有潜在的抗肿瘤活性,具体的机制需要进一步研究发现。维泰醇致死率和SRB数据说明其毒性相对较低,通过MMP-2和划痕实验发现其可能的作用机制在于抑制了肿瘤细胞某些迁移分子的表达,另一方面,其对血管内皮细胞管腔形成有抑制,说明该化合物从两个方面来抑制肿瘤细胞的转移。虽然维泰醇抗转移能力略弱于紫杉醇,但其低细胞毒特性依然有望成为新的抗肿瘤转移化合物。
[1]Sporn M B.The war on cancer[J].Lancet,1996,347:1377 - 81.
[2]Zhao J,Qi Q,Yang Y,et al.Inhibition of alpha(4)integrin mediated adhesion was involved in t he reduction of B16F10 melanoma cells lung colonization in C57BL/6 mice treated with Gambogic acid[J].Eur J Pharmacol,2008,589(1 -3):127 -31.
[3]Fishman D A,Kearns A,Chilukuri K,et al.Metastatic dissemination of human ovarian epithelial carcinoma is promoted by alpha2 beta1-integrin-mediated interaction with type I collagen[J].Invasion Metastasis,1998,18(1):15 -26.
[4]Lalu M M,Csonka C,Giricz Z,et al.Preconditioning decreases ischemia/reperfusion-induced release and activation of matrix metalloproteinase-2[J].Biochem Biophys Res Commun,2002,296(4):937-41.
[5]Mezentsev A,Seta F,Dunn M W,et al.Eicosanoid regulation of vascular endothelial growth factor expression and angiogenesis in microvessel endothelial cells[J].J Biol Chem,2002,277(21):18670-6.
[6]Li Z,Zhan W,Wang Z,et al.Inhibition of PRL-3 gene expression in gastric cancer cell line SGC7901 via microRNA suppressed reduces peritoneal metastasis[J].Biochem Biophys Res Commun,2006,348:229 -37.
[7]Guidolin D,Vacca A,Nussdorfer G G,et al.A new image analysis method based on topological and fractal parameters to evaluate the angiostatic activity of docetaxel by using theMatrigel assayin vitro[J].Microvasc Res,2004,67(2):117 -24.
[8]施有琴,王 荣,谢 华.沙立度胺抗肿瘤作用机制与临床应用研究进展[J].中国药理学通报,2010,26(8):993-4.
[8]Shi Y Q,Wang R,Xie H.Progress in the research of anti tumor mechanism and clinical application of thalidomide[J].Chin Pharmacol Bull,2010,26(8):993 -4.
[9]李玉娟,刘建勋.HIF-1活性调节及其在缺血后血管新生中的作用[J].中国药理学通报,2009,25(1):19-20.
[9]Li Y J,Liu J X.Key regulators of HIF-1 and its action in angiogenesis after ischemia[J].Chin Pharmacol Bull,2009,25(1):19 -20.
[10]Gasparini G,Longo R,Toi M,Ferrara N.Angiogenic inhibitors:a new therapeutic strategy in oncology[J].Nat Clin Pract Oncol,2005,2(11):562-77.
[11]Egeblad M,Werb Z.New functions for the matrix metalloproteinase in cancer progression[J].Nat Rev Cancer,2002,2(3);161.
[12]Hoyhtya M,Hujanen E,Turpeenniemi-Hujanen T,et al.Modulation of type-Ⅳcollagenase activity and invasive behavior of metastatic human melanoma(A2058)cellsin vitroby monoclonal antibodies to type-Ⅳ collagenase[J].Int J Cancer,1990,46(2):282 -6.
[13]Chiang A C,Massague J.Molecular basis of metastasis[J].N Eng Med,2008,359(26):2814
[14]Saaristo A,Karpanen T,Alitalo K.Mechanisms of angiogenesis and their use in the inhibition of tumor growth and metastasis[J].Oncogene,2000,19(53):6122-9.
[15]Edwards J G,Cox G,Andi A,et al.Angiogenesis is an independent prognostic factor in malignant mesothelioma[J].Br J Cancer,2001,85(6):863-8.
[16]Bamias A,Dimopoulos M A.Angiogenesis in human cancer:implications in cancer therapy[J].Eur J Intern Med,2003,14(8):459-69.

