全反式维甲酸对骨肉瘤细胞143B生长的影响
牟钰钦,周龙洋,杨秋珺,周岐新,何百成
(重庆医科大学药理教研室,重庆 400016)
骨肉瘤是儿童和成人中常见的一种非血液系统性恶性肿瘤,多由分化程度较低的成骨细胞所致,且具有很高的肺转移特性[1]。越来越多的证据表明,成骨分化缺陷可导致骨肉瘤的发生[2],成骨祖细胞成骨分化早期出现调控异常,可致恶性程度很高的骨肉瘤,反之骨肉瘤的恶性程度会有所降低。骨肉瘤的临床治疗面临多种挑战,如:常规化疗的副作用、肿瘤细胞的耐药性及骨肉瘤细胞肺转移[2]。为克服或防止这些情况的发生,采用分化治疗或分化治疗合并传统的化疗来治疗这类疾病的方法越来越受到人们的重视。研究表明一些核受体激动剂能明显促进肿瘤细胞分化而抑制肿瘤生长,其中全反式维甲酸(all-trans retinoic acid,ATRA)已成功用于治疗急性早幼粒细胞白血病[3]。文献报道,ATRA能抑制骨肉瘤细胞生长,但其作用机制还不是很清楚;本研究对ATRA抑制骨肉瘤细胞生长的机制作进一步探讨。结果显示,ATRA抑制骨肉瘤细胞增殖作用至少与促进骨肉瘤细胞成骨分化有关。
1 材料及方法
1.1试剂及细胞培养人骨肉瘤细胞143B和MG63购自 ATCC(American Type Culture Collection)。全反式维甲酸购自BIOMOL,用DMSO溶解。实验所用抗体均购自 Santa Cruz。细胞培养用DMEM培养基含10%胎牛血清和1%的青、链霉素,培养条件为5%的CO2及37℃。
1.2RT-PCR及Western blot检测将细胞铺于T25培养瓶中,提取总RNA前24 h将完全培养基换为含1%胎牛血清的完全培养基。利用TRIzol法提取总RNA。通过RT-PCR制备cDNA,进行PCR检测维甲酸受体在骨肉瘤细胞143B和MG63中的内源性表达。
实验所用PCR引物如下,RARα引物:上游5'-CAGCGACTCCTTGGACAGA-3',下 游 5'-GGCAGAGG GGTGTCTTGAT-3';RARβ引物:上游 5'-GGTTTC ACTGGCTTGACCAT-3',下游 5'-AAGGCCGTCTGAG AAAGTCA-3';RARγ引物:上游5'-AACAAGGTGAC CAGGAATCG-3',下 游 5'-TGTCAGGTGACCCTTCTTC C-3';RXRα引物:上游5'-GCTTCCTTCACCAAGCA CA-3',下游5'-CGCTTGTCAATCAGGCAGT-3';RXRβ引物:上游5'-CAGGGCAGAACCAAGAACAT-3',下游5'-GAAATCACCCCAAATCATGG-3';RXRγ引物:上游5'-TGTGGTCAACAGTGTCAGCA-3',下游5'-GTC TCCACAGATGGCACAGA-3'。
另将指数生长的细胞铺于6孔板中,待细胞贴壁后进行相应的处理。于不同检测时间点,提取各组总蛋白并用BCA法测定总蛋白浓度。按常规Western blot方法进行,最后用ECL化学发光显色,并用凝胶成像仪成像。每组实验重复3次。
1.3细胞增殖实验将指数生长的细胞铺于24孔板,用不同浓度的ATRA处理细胞。分别在24、48和72 h将细胞用胰酶消化进行计数(用台盼蓝染色区别坏死细胞)。每组实验重复3次,结果取平均值。
1.4凋亡检测实验将指数生长的细胞铺于6孔板,用 20 μmol·L-1的 ATRA 处理 143B 细胞,分别于第12和24 h提取总蛋白,然后按前述方法进行Western blot检测Caspase-3的蛋白水平变化情况。另用 20 μmol·L-1ATRA 处理 143B 细胞,24 h 后进行凋亡染色,按试剂盒说明书进行操作(Vybrant Apoptosis Assay kit,V-23201),每组实验重复3次。
1.5萤光素酶报告质粒实验将指数生长状态的细胞铺于24孔板中,待细胞贴壁后,每孔利用lipofectamine(购自 Invitrogen)转染0.25 μg报告质粒,6 h后终止转染并换用正常培养基。加入不同浓度的ATRA,24 h后裂解细胞,按照试剂盒说明进行萤光素酶活性测定。BCA法测定裂解液总蛋白浓度,用于对萤光素酶活性进行校正。每组实验重复3次,结果取平均值。
1.6骨桥素、骨钙素蛋白表达检测实验将指数生长的细胞铺于6孔板,待细胞贴壁后用相应浓度的ATRA处理,分别于D9和D11提取总蛋白,通过Western blot检测骨桥素(osteopontin,OPN)和骨钙素(osteocalcin,OCN)蛋白表达水平。
1.7统计学分析实验数据以±s表示,t-test进行组间比较。
2 实验结果
2.1维甲酸受体与视黄醇X受体在143B骨肉瘤细胞中的内源性表达143B和MG63骨肉瘤细胞中维甲酸受体(RAR)及视黄醇X受体(RXR)的内源性表达如Fig 1所示。RT-PCR结果显示:RAR及RXR各型受体的mRNA在143B和MG63骨肉瘤细胞中均有表达,并且 Western blot也能够检测到RARα和RXRα的蛋白表达。提示,143B和MG63骨肉瘤细胞中存在维甲酸信号通路。
2.2ATRA呈现浓度依赖性抑制143B骨肉瘤细胞增殖ATRA对143B细胞的增殖抑制如Fig 2所示。结果显示,ATRA能明显抑制143B细胞增殖,并且这种抑制作用呈浓度依赖性增强。
2.3ATRA诱导143B骨肉瘤细胞凋亡ATRA诱导143B细胞凋亡结果如Fig 3所示。Western blot检测Caspase-3蛋白水平结果显示,ATRA处理143B细胞12 h后,处理组Caspase-3蛋白水平明显高于对照组,而24 h无变化。凋亡染色结果显示,ATRA处理后,凋亡及死亡细胞阳性染色明显增多。提示,ATRA能够诱导143B骨肉瘤细胞凋亡。

Fig 1 Endogenous nuclear receptor expression in osteosarcoma

Fig 2 Inhibitory effect of ATRA on 143B osteosarcoma cells(±s,n=3)
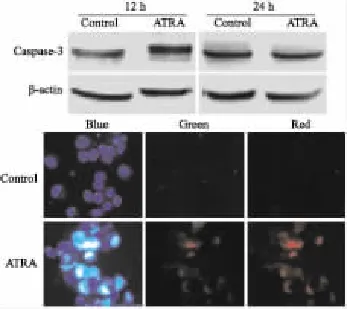
Fig 3 Effect of ATRA on apoptosis of 143B osteosarcoma cells
2.4ATRA诱导143B骨肉瘤细胞骨向分化ATRA诱导143B细胞成骨分化检测结果如Fig 4、5所示。结果显示,ATRA处理后,Runx2报告质粒萤光素酶活性明显升高,表明Runx2转录活性增强(Fig 4);Western blot结果示,OPN及OCN表达增加(Fig 5)。提示,ATRA能够促进143B骨肉瘤细胞骨向分化。
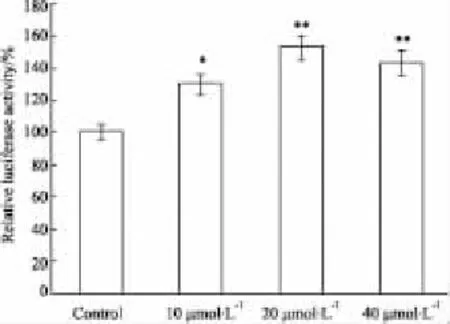
Fig 4 ATRA promote Runx2 induced transcription activity in 143B osteosarcoma cells(±s,n=3)

Fig 5 ATRA induced OPN and OCN expression in 143B osteosarcoma cells(n=3)
3 讨论
骨肉瘤是一种恶性肿瘤,其特征是成骨祖细胞处于不同的分化状态[4]。目前临床对于骨肉瘤的治疗面临两个主要的问题:其一是常规化疗给患者带来的严重不良反应和毒副作用。第二个问题是难于对骨肉瘤肺转移作早期诊断。因此,临床上急需一种低毒高效的方法治疗骨肉瘤这类疾病。
诱导肿瘤细胞终末分化可以使一些恶性肿瘤得到治疗,比如:用全反式维甲酸治疗急性早幼粒细胞白 血 病 (acute promyelocytic leukemia,APL)[3],PPARγ激动剂能抑制人乳腺癌、结肠癌和脂肪肉瘤等肿瘤细胞的生长[5]。目前对肿瘤的化疗主要是用细胞毒性药物杀死增殖迅速的肿瘤细胞,这类药物多具有严重的不良反应。与传统化疗药物相反,促进肿瘤细胞分化的药物不仅具有较少的不良反应,而且能明显降低肿瘤的恶性程度。
成骨祖细胞因为一些遗传因素或突变使成骨分化过程受到干扰,最终导致骨肉瘤发生。这种分化缺陷的观点可从以下事实得到证实:骨肉瘤细胞具有末分化成骨细胞的特点[1,2,6],成骨分化转录调节因子Runx2并不能有效促进骨肉瘤细胞成骨分化;成骨性骨形态蛋白(bone morphogenetic protein,BMP)不能诱导人骨肉瘤细胞成骨分化,而是表现出促进骨肉瘤生长[7];我们的实验也显示:多种骨肉瘤细胞株和原代骨肉瘤细胞其碱性磷酸酶表达程度存在明显差别(资料未附)。
ATRA能与核受体RAR(Retinoic Acid Receptor)和RXR(Retinoids X Receptor)受体结合形成杂合二聚体,最终与DNA靶基因的调节位点结合,调节下游目的基因表达[8]。ATRA已被用于临床治疗APL,并取得了巨大的成功,其机制就是ATRA促进急性早幼粒细胞白血病细胞进行正常分化。文献报道[9],ATRA能够抑制骨肉瘤细胞的生长,其机制可能涉及CyclinD2和CDK4表达的下调从而导致低磷酸化pRb积累;ATRA不但能够抑制MG-63细胞生长,也能抑制 MG-63细胞的侵袭转移能力[10];ATRA还可以促进人骨肉瘤细胞一定程度良性分化[11]。ATRA能够明显增强BMP9(bone morphogenetic protein 9)诱导的间充质干细胞成骨分化[12],BMP9是目前已知BMPs成员中诱导间充质干细胞成骨分化能力最强的因子。以上研究表明,ATRA对可能是通过促进分化抑制骨肉瘤生长,但其具体机制还不清楚。
我们的研究表明,ATRA能够使143B骨肉瘤细胞生长受到抑制并促进凋亡,这种作用与ATRA促进骨肉瘤细胞分化有关。ATRA能促进成骨分化不同时期的成骨标志物在143B骨肉瘤细胞中表达:早期可以促进成骨分化转录调节因子Runx2表达,中晚期可促使OPN及OCN表达,且晚期可促进钙盐沉积(资料未附)。提示:ATRA能在不同分化阶段促进骨肉瘤细胞骨向分化,从而抑制骨肉瘤细胞生长。虽然ATRA单独使用或许并不能有效的治疗骨肉瘤,但可以作用一种辅助治疗方式,与常规治疗方式联合运用,提高对骨肉瘤的治疗效果,同时降低常规治疗方式带来的严重不良反应。
[1]Sandberg A A,Bridge J A.Updates on the cytogenetics and molecular genetics of bone and soft tissue tumors:osteosarcoma and related tumors[J].Cancer Genet Cytogenet,2003,145:1 -30.
[2]Tang N,Song W X,Luo J,et al.Osteosarcoma development and stem cell differentiation[J].Clin Orthop Relat Res,2008,466:2114-30
[3]Kambhampati S,Verma A,Li Y,et al.Signalling pathways activated by all-trans-retinoic acid in acute promyelocytic leukemia cells[J].Leukemia Lymphoma,2004,45(11):2175 -85.
[4]Dorfman H D,Weiss S W.Borderline osteoblastic tumors:problems in the differential diagnosis of aggressive osteoblastoma and low-grade osteosarcoma[J].Semin Diagn Pathol,1984,1:215 -34.
[5]Park B H,Breyer B,He T C.Peroxisome proliferator-activated receptors:roles in tumorigenesis and chemoprevention in human cancer[J].Curr Opin Oncol,2001,13:78 - 83.
[6]Thomas D M,Johnson S A,Sims N A,et al.Terminal osteoblast differentiation,mediated by runx2 and p27KIP1,is disrupted in osteosarcoma[J].J Cell Biol,2004,167:925 -34.
[7]Luo X,Chen J,Song W X,et al.Osteogenic BMPs promote tumor growth of human osteosarcomas that harbor differentiation defects[J].Lab Invest,2008,88:1264 -77.
[8]Germain P,Chambon P,Eichele G,et al.International Union of Pharmacology LX Retinoic acid receptors[J].Pharmacol Rev,2006,58(4):712 -25.
[9]李 扬,丘钜世,邓家德,等.全反式维甲酸对骨肉瘤细胞OS732生长的影响[J].中国现代医学杂志,2005,15(15):2271-2.
[9〛.Li Y,Qiu J S,Deng J D,et al.Effect of retinoic acid on growth of osteosarcoma cell line OS732[J].Chin J Mod Med,2005,15(15):2271-2.
[10]张 岩,姜 侃,夏仁云.全反式维甲酸体外诱导分化对人骨肉瘤MG-63细胞侵袭转移的影响[J].华中科技大学学报,2006,35(5):616.
[10]Zhang Y,Jiang K,Xia R Y.Effect of ATRA on Invasion and Metastasis of human osteosarcoma MG-63 cell during differentiation inductionin vitro[J].J Huazhong Univ Sci Technol,2006,35(5):616.
[11]张 强,范清宇,张殿忠,等.全反式维甲酸对人骨肉瘤细胞抑制增殖和诱导分化的实验[J].中国临床康复,2005,9(22):150-2.
[11]Zhang Q,Fan Q Y,Zhang D Z,et al.All-trans retinoic acid in inhibiting the proliferation and inducing the differentiation of human osteogenia sarcome cells[J].Chin J Chin Rehab,2005,9(22):150-2.
[12]Zhang W,Deng Z L,Chen L,et al.Retinoic acids potentiate BMP9-induced osteogenic differentiation of mesenchymal progenitor cells[J].PLos One,2010,5(7):e11917.

