旱柳根系蛋白质双向电泳体系的建立
张小果, 乔桂荣, 李翠云,3, 刘明英, 蒋 晶, 李海营, 邱文敏, 卓仁英
(1.浙江中医药大学 生命科学学院,浙江 杭州 310052;2.中国林业科学研究院 亚热带林业研究所,浙江 富阳 311400;3.新疆大学 生命科学与技术学院,新疆 乌鲁木齐 830046)
旱柳Salix matsudana,又称柳树、河柳、江柳,是中国北方平原地区最常见的乡土树种之一,较耐寒,耐干旱,稍耐盐碱,在含盐量为2.50 g·kg-1的轻度盐碱地上仍可生长[1]。目前,国内外关于植物耐盐性的研究主要集中在粮食作物(水稻Oryza sativa,小麦Triticum aestivum,玉米Zea mays等)和经济作物(大豆Glycine max,烟草Nicotiana tabacum,马铃薯Salanum tuberosum等),与草本植物相比,对木本植物的研究工作尚未得到充分展开[2]。20世纪90年代初,林木研究进入基因组时代;90年代末,许多林木研究实验室建立了功能基因组学工具,这使得研究工作者可以同时分析大量的转录本或蛋白质,从而为理解蛋白功能、基因调节等提供了机会[3]。蛋白质是基因功能的最终执行者,而转录水平所获得的基因表达信息并不足以阐明基因的功能。因此,从翻译水平上来研究蛋白质的表达与功能模式是生命科学发展的必然趋势[4]。双向电泳是研究蛋白质表达变化最有效的工具之一。它利用等电点和分子量2个性质对蛋白质进行分离,可以使得样品中数千种蛋白得到有效分离[5]。双向电泳技术面临的挑战是高分辨率和重复性[6]。只有具备了高分辨率和高重复性才能适用于接下来的凝胶图片分析,蛋白点配对,找出差异蛋白。为建立旱柳根系双向电泳体系,本研究从蛋白提取、染色及双向电泳中蛋白上样量、平衡时间、等电聚焦等方面对旱柳根部总蛋白双向电泳体系进行分析比较,以建立优化的试验体系。
1 材料与方法
1.1 试剂
尿素(电泳级),安福灵(Ampholine)pH 3~10和碘乙酰胺购自GE医疗集团(美国);丙烯酰胺(Acr),甲叉双丙烯酰胺(Bis),十二烷基硫酸钠(SDS),二硫苏糖醇(DTT)购自默克(Merck,德国);苯甲基磺酰氟(PMSF), 3-[3-(胆酰氨丙基)二甲氨基]丙磺酸内盐(CHAPS), 考马斯亮蓝 G-250(CBB G-250)和甘氨酸购自Sigma(USA),β-巯基乙醇,聚乙烯吡咯烷酮(PVPP),三羟甲基氨基甲烷(Tris),乙二胺四乙酸二钠盐(EDTA-Na2),pH 8.0 Tris-饱和酚,曲拉通(Triton X-100),过硫酸铵和四甲基乙二胺 (TEMED) 等购自中国上海生工;丙酮,乙酸铵,甲醇,乙醇,磷酸,甘油,硫酸铵。均为分析纯,购自中国上海生工。
1.2 植物材料
将从旱柳I-23无性系上剪下来的枝条剪成长为20.0 cm,径为0.5~1.0 cm的规格插入泡沫板,置于水培箱用自来水进行水培生根。日间温度为25~30℃,夜间为18~20℃,相对湿度为60%~80%,光照16 h·d-1。1个月后加入1/4倍的Hoagland营养液[7]。其后2周换1次营养液,期间不断增加营养液强度直到1倍。3个月后,取水培苗根系提取总蛋白。
1.3 采用酚抽法提取蛋白
参照Wang[8]的方法。约1.0 g旱柳根置液氮中充分磨碎,加0.1 g聚乙烯吡咯烷酮继续研磨,向研钵加入5 mL提取液(300mmol·L-1三羟甲基氨基甲烷,50mmol·L-1乙二胺四乙酸二钠盐,50mmol·L-1硼砂, 50mmol·L-1维生素 C, 10.0 g·kg-1曲拉通, 20.0 g·kg-1β-巯基乙醇, 0.7 mol·L-1蔗糖, 1mmol·L-1苯甲基磺酰氟),待其融化后继续研磨,转移到50 mL离心管;4℃,15000×g离心50 min,将上清液转移到一干净的50 mL离心管,加等体积的三羟甲基氨基甲烷-酚(pH 8.0)漩涡10 min,4℃,15000×g离心30 min;用1 mL枪小心吸取上层酚相至100 mL离心管中,加入5倍体积的-20℃预冷乙酸铵饱和甲醇,在-20℃冰箱放置6 h;15000×g,4℃,离心15 min,沉淀用预冷乙酸铵饱和甲醇冲洗1次,-80℃静置5 min,取出后15000×g离心15 min,沉淀用体积分数为80%冷丙酮洗2遍,15 min·次-1。室温干燥,所得干粉置-80℃保存待用。
1.4 蛋白质的定量
双向电泳时蛋白质样品的上样量应该尽量一致。因此,蛋白质样品的准确定量非常关键。本实验采用经典的 Bradford法[21-22]进行定量。
1.5 双向电泳条件的建立
第一向等电聚焦使用pH 3~10 IPG(固定pH梯度)胶条(美国GE医疗集团)在 Ettan IPGphor电泳仪(Ettan IPGphor 3,美国GE医疗集团)上完成,一向采用胶内水化方式上样,二向采用125.0 g·kg-1的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)胶进行分离。
1.5.1 蛋白上样量的比较 蛋白质样品的上样量大小是影响凝胶图谱的重要因素。本实验采用24 cm,pH 3~10的线性IPG胶条,设计 600,900,1200 μg·胶条-1。采用的聚焦程序为500 V(1 h)→1000 V(3 h)→3000 V(4 h)→3000~8000 V (2 h)→维持电压 8000 V, 使总聚焦伏特小时数为 11 万 V·h, 以确定最佳上样量。蛋白样品用水化液补足至450 μL,沿着水化盘槽的边缘从左至右线性加入样品[9]。去除预制IPG胶条上的保护层,轻轻地将IPG胶条胶面朝下置于水化盘中的样品溶液上,1 h后,用矿物油覆盖,胶条泡胀14 h后,将IPG胶条转移至Ettan IPGphor 3胶条槽。用去离子水将预制好的电极滤纸片湿润,置于IPG胶条的末端,安装电极,设定程序参数并开始运行。
1.5.2 平衡时间的比较 平衡的目的是使蛋白质与十二烷基硫酸钠充分相互结合,以确保第二向蛋白质的分离。为了把握最佳的平衡时间及胶条中蛋白质随时间变化而丢失的情况,本研究采用两步法,分别在含有二硫苏糖醇和碘乙酰胺的平衡液中平衡 10,15,20和50 min来确定最佳平衡时间。采用的胶条为7 cm,pH 3~10线性胶条,上样量为250 μg。 聚焦程序为250 V (30 min)500 V (1 h)1000 V(3 h)5000 V (9 h)500 V (30 min)。 配制平衡液 A:50mmol·L-1三羟甲基氨基甲烷盐酸盐 (pH 8.8), 6 mol·L-1尿素,300 g·kg-1甘油,20 g·kg-1十二烷基硫酸钠,0.02 g·L-1溴酚蓝和 10 g·kg-1二硫苏糖醇。 配制平衡液 B:50mmol·L-1三羟甲基氨基甲烷盐酸盐 (pH 8.8),6 mol·L-1尿素,300 g·kg-1甘油,20 g·kg-1十二烷基硫酸钠,0.02 g·L-1溴酚蓝和 25 g·kg-1碘乙酰胺。
1.5.3 最佳聚焦伏特小时 高电压是等电聚焦过程中蛋白质能否充分泳动到等电点的重要前提,直接关系到等电聚焦的效果。采用24 cm,pH 3~10的线性IPG胶条,上样量为900 μg。设置的电泳程序为500 V(1 h)1000 V(3 h)3000 V(4 h)3000~8000V (2 h)维持电压8000 V, 使总聚焦伏特小时数分别达到 6万V·h,8万V·h,10万V·h后,断开电源,取出胶条。
1.6 染色
采用改进的 “Blue Silver”考马斯亮蓝染色法[10,13]将凝胶立即置于固定液(体积分数为10%乙酸与体积分数为40%乙醇混合)固定1 h;再用超纯水漂洗3次,10 min·次-1;然后将凝胶置于考马斯亮蓝染色液 (100.00 g·kg-1磷酸,体积分数为20%乙醇,100.00 g·kg-1硫酸铵,1.25 g·kg-1考马斯亮蓝 G-250)中染色14 h。用超纯水脱色至背景清晰为止。
2 结果与分析
2.1 不同染色方法的比较
考马斯亮蓝染色法、银染法是较为常用的蛋白染色方法[11]。本研究对Candiano等[10]发明的 “Blue Silver”考马斯亮蓝染色法进行改进,具体就是将 “Blue Silver”考马斯亮蓝染色法中的甲醇用乙醇代替。通过跑单向的方法来鉴定其灵敏度。如图1,所提蛋白从右向左对比稀释,第1个泳道的量为10 μg,当到达第6个泳道时,银染和改进的考染检测效果均较低,说明采用改进的考马斯亮蓝染色方法灵敏度很高[14]。因此,在本双向电泳体系中,染色方法采用改进的 “Blue Silver”考马斯亮蓝染色法。

图1 不同染色方法的比较Figure 1 Comparison of different staining methods
2.2 双向电泳条件对双向电泳结果的影响

图2 不同上样量的双向蛋白质电泳图谱Figure2 2-DE gel of different loading quantity
2.2.1 不同上样量对蛋白质双向电泳图谱的影响 图2为不同上样量的双向蛋白质电泳图谱,采用的是考染法。研究发现:随着上样量的增加并没有呈现背景很重的现象。从图谱上可以看到,蛋白点基本呈圆形。上样量为 600,900和1200 μg,斑点检测参数Smooth=3,Min Area=5,Saliency=10时,蛋白质斑点数检测结果分别是1241,1562和1599。如图2凝胶图谱中正方形框选区域放大图,随着上样量的增加,获得的低峰度蛋白点数目更多且清晰,但是当上样量从900 μg增加到1200 μg,蛋白点虽然有所增加,但增加不明显,说明上样量增加,高丰度蛋白质的斑点过大,造成交叉、重叠,影响其他蛋白质点的分离和分析。此外,由于上样量增加,横向条纹和纵向条纹明显增加,如箭头所指区域。这是由于上样量过大使样品溶液中的杂质及离子含量增大,聚焦效果较差,影响蛋白点的有效分离,产生了很多假点,不能用于凝胶分析。因此,综合考虑图谱的分辨率和蛋白点的个数,对于24 cm,pH 3~10的线性IPG胶条,900 μg蛋白是其最佳的上样量。
2.2.2 不同平衡时间对蛋白质双向电泳图谱的影响 从本研究看出:平衡10 min时蛋白质斑点的分离效果较好,蛋白点基本成圆形,很少有拖尾现象,蛋白点不发散,说明平衡时间为10 min时,十二烷基硫酸钠已经与蛋白质充分结合。当总平衡时间大于等于30 min,如图3中箭头所示,蛋白点开始弥散,高丰度蛋白点面积变大,一些低分度蛋白点开始丢失,当平衡平衡时间达到50 min(图3 D),蛋白点丢失严重,蛋白点不圆,呈雨滴状。
2.2.3 不同聚焦时间对蛋白质双向电泳图谱的影响 等电聚焦时各蛋白质到达各自的等电点所需要的时间与电泳的伏特小时数有关。因此,对于特定的胶条都有一个最小的聚焦伏特小时数,只有达到这一数值时才能保证各蛋白质到达各自的等电点,当上样量为900 μg,聚焦6万 V·h,8万V·h,电泳图谱存在轻微的横纹,且高丰度蛋白区域蛋白点弥散,蛋白没有充分聚焦;当聚焦时间增加到10万V·h,横向条纹明显减少,且从图4中框选部分的放大图可以看出,蛋白点不弥散,蛋白点成圆形,说明聚焦充分,大部分蛋白质都运动到自身相应的等电点。因此,实验针对24 cm,pH 3~10的胶条,上样量900 μg时,10万V·h是其最佳聚焦伏特小时数。

图3 不同平衡时间的双向蛋白质电泳图谱Figure3 Comparison of different equilibrium time

图4 不同等电聚焦时间的双向蛋白质电泳图谱Figure4 Comparison of different IEF time
2.3 盐碱胁迫对旱柳根蛋白质成分的影响
分离全蛋白质的2个关键参数是其分辨率和可重复性[6]。为了使得双向蛋白质电泳图谱有很高的重复性,便于凝胶与凝胶之间的匹配,就要保证从蛋白提取到二向电泳整个流程中操作的一致性,从而减少实验结果分析时引起的误差。本研究采用24 cm,pH 3~10线性IPG胶条,最佳双向电泳条件:上样量900 μg,平衡时间10 min,聚焦时间10万V·h。对相同材料分次提取蛋白并进行双向电泳的结果进行了比较,结果如图5 A和图5 B。可以看出:同一样品分次提取的双向电泳图谱中蛋白分布及丰度表现出良好的重复性,利用ImageMaster 2D Platinum 6.0软件分析凝胶上蛋白点数量和丰度基本一致,当斑点检测参数Smooth=3,Min Area=5,Saliency=10时,图5 A图5 B的蛋白点数分别为1464,1448,匹配率达83.035%,说明本研究建立的蛋白提取及双向电泳体系重复性、稳定性强,分辨率也很高。
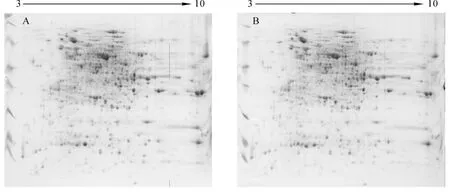
图5 同一样品的2次双向蛋白质电泳图谱Figure5 Reproducibility of 2-DE for the same sample

图6 对照及盐胁迫24 h后双向电泳图Figure6 2-DE maps of the control and salt-stress after 24 h
水培3个月的旱柳,当苗根长10 cm左右时,用于盐处理,即向1/4 Hoagland营养液中加入最终浓度为100mmol·L-1的氯化钠做为盐胁迫组。同时,选择生长状况一致的旱柳置于1/4 Hoagland营养液作为对照。在盐胁迫24 h后,提取旱柳根总蛋白,采用如上建立的双向电泳体系进行试验,经过双向电泳,考染,获得蛋白质图谱(图6)。从图6中可以看出碱性端蛋白点较少,大部分蛋白集中在酸性端。说明旱柳根部蛋白质大部分属于酸性蛋白。采用ImageMaster 2D Platinum 6.0软件结合肉眼对图谱进行分析可以看出:盐胁迫条件下蛋白图谱与对照条件下蛋白图谱具有一定相似性,但也存在差异性。在盐胁迫后,所表达的蛋白点数有所增加,且存在一些表达量上的差异(图7~9),通过软件自动匹配及数据分析。当斑点倍率关系系数大于1.5时,显示92个差异点,对每一个点进一步手动筛选,假点及错配蛋白点不予考虑,结果显著差异的点有39个,其中15个下调,24个上调(11个新诱导表达)。
3 讨论
蛋白质双向电泳分离技术是一个受多种因素影响的多步骤实验,只有处理好蛋白质的分离纯化、溶解和变性、杂质的去除、胶条的水化、蛋白质的等电聚焦、胶条的平衡、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳、染色,才有可能获得较高重现性、可比性和稳定性的图谱,蛋白质双向电泳分离的实验条件才算成功建立[15]。
蛋白质样品制备是双向电泳的关键步骤,它的好坏直接决定着双向电泳的分辨率、重复性。如何去除影响蛋白质可溶性和双向电泳重复性的物质(如核酸、脂类和多糖等生物大分子以及盐类小分子)很重要。不同植物材料所含的糖类、脂肪、色素等物质可能有所不同,因此,要对蛋白提取方法进行适当的调整才能达到好的分离效果[16]。饱和酚-甲醇醋酸铵法通过不同相选择性溶解,能有效去除有机物杂质。在样品制备过程中,蛋白质和脂类溶于酚相,盐、核酸、多酚和多糖等可溶性物质进入水相。由于酚的脂溶性,酚提取法非常有利于膜蛋白的提取,而膜蛋白往往与植物的耐盐性密切相关[17]。由于纯丙酮沉淀的蛋白复溶性差,最后一定要用体积分数为80%的冷丙酮去清洗蛋白。从电泳图中可以看出用酚抽法提取的蛋白质稳定,几乎没有条纹和拖尾等纹理现象,得到了清晰的电泳图谱,说明此方法适于旱柳根部蛋白质的提取。
考马斯亮蓝染色可以说是目前使用最为广泛的一种方法。考马斯亮蓝染色主要具有以下一些优点:一是线性范围宽,适于进行定量分析;二是操作步骤简单;三是显色时间好掌握;四是与质谱的兼容性好[23]。银染法虽然可以检测纳克级水平上的蛋白,但蛋白质的量和染色强度之间线性关系范围很窄,使得银染并非一种非常可靠的蛋白质定量方法;并且由于其实验步骤复杂,与质谱配伍性较差,不利蛋白点的成功鉴定[12]。由于考染法突出的优点,而银染法弊端多,因此,在对这2种染色方法的单向电泳染色结果简单比较后,本实验体系染色方法选择了改进的 “Blue Silver”考马斯亮蓝染色法。在秦慧[13]的文章中也提到,用乙醇代替甲醇,检测效率没有降低,可检测达几纳克水平的蛋白。
上样量的大小直接影响双向电泳的分辨率。上样量过低,丰度较低的蛋白无法显现,上样量过高,蛋白无法有效分离。上样量的大小因上样方式、IPG胶条的pH梯度及胶条长度等差异而各不相同,最佳的上样量需根据具体实验的对象来探索确定[3]。窄pH梯度的IPG胶条比宽pH梯度的IPG胶条需更大的上样量,考马斯亮蓝染色比银染需要的上样量大,提高蛋白质的上样量有利于低丰度蛋白的检测,但上样量过高可导致高丰度蛋白斑点掩盖低丰度蛋白斑点。且样品中含有盐离子,上样量越大盐离子浓度也越大,影响电压的上升,达到高电压的时间更长,易产生横向条纹,横条纹是样品中盐离子浓度较高的一个显著特征[18]。

图7 双向电泳分析后的参考胶Figure7 Referance gel afer two-dimensional electrophoresis gel analysis
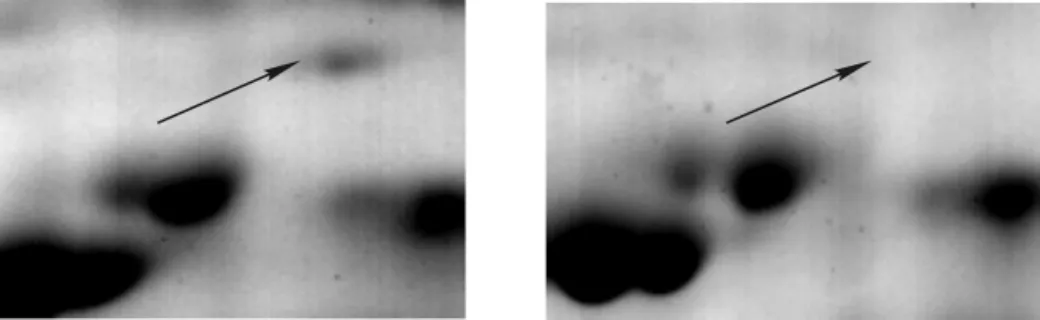
图8 胁迫后表达下调Figure8 Protein expression down-regulate
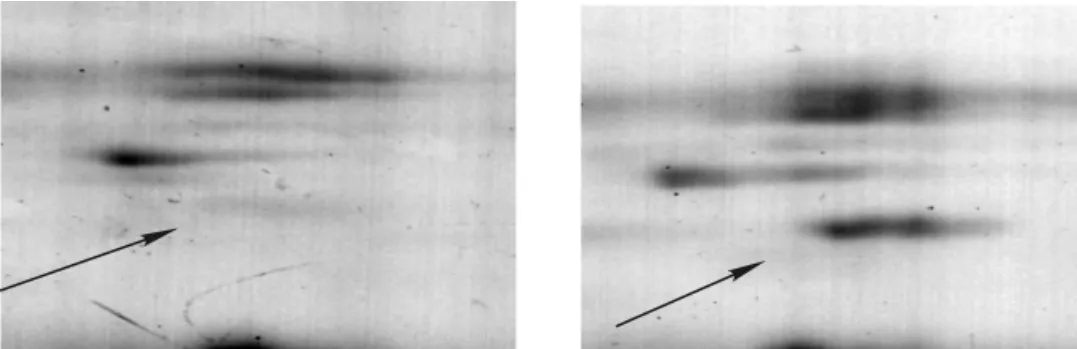
图9 胁迫后蛋白表达上调Figure9 Protein expression up-regulate
在本实验体系中,采用7 cm的胶条验证蛋白随平衡时间变化的丢失情况,根据伯乐双向电泳流程报道,平衡过程导致蛋白丢失约5%~25%,还会使分辨率降低,平衡30 min时,蛋白带变宽40%,所以平衡时间不可过长。平衡时间要充分长(至少2×10 min),但也不要超过(2×15 min),7 cm的胶条双向电泳结果也说明了这一点。
聚焦情况也会对电泳结果有明显的影响,不完全聚焦会造成蛋白水平和垂直方向的拖尾。但聚焦也并不是越长越好,过量的聚焦会导致最终胶图上碱性端横条纹的产生[19-20]。
目前,开展木本植物的蛋白质组研究,确定各蛋白质的功能、蛋白质之间的相互作用研究,对于阐明木本植物的生长发育机制、抗逆机制及遗传育种都具有重要的理论意义和实用价值。本实验采用改进的苯酚法,提高了蛋白质提取质量,再用考染的染色方法,确定了考染的最佳上样量,平衡时间,等电聚焦时间,从而建立了一套较完整的旱柳双向电泳研究体系。本研究以优化的双向电泳体系对盐胁迫处理的旱柳根蛋白分离,获得分辨率较高的双向蛋白质电泳图谱,并获得了39个差异点,目前,我们已经对这些差异蛋白进行了质谱鉴定,有30个蛋白点鉴定成功。其中已知的蛋白有过氧化物酶、乙烯诱导蛋白、激动蛋白等,但大部分蛋白是预测蛋白或未知蛋白。我们正在结合旱柳根系盐碱胁迫的表达谱芯片对这些蛋白做进一步分析,期望阐明旱柳适应盐逆境胁迫的分子机制,分离出旱柳耐盐的关键基因,为林木抗逆性遗传改良提供支撑。
[1]王占武.盐生和中生2种不同环境下加杨和旱柳的演化结构比较研究[D].长春:东北师范大学,2008.WANG Zhanwu.Study of Comparing about Evolved Structure between Populus×canadensis and Salix matsudana under Salt and Mesophytic Environment[D].Changchun:Northeast Normal University,2008.
[2]RENAULT S, LAIT C, ZWIAZEK J J, et al.Effect of high salinity tailings waters produced from gypsum treatment of oil sands tailings on plants of the boreal forest [J].Environ Poll,1998, 102: 177-184.
[3]PLOMION C, RICHARDSON T, MACKAY J.Advances in forest tree genomics [J].New Phytologist,2005, 166:713-717.
[4]钱小红,贺福初.蛋白质组学:理论与方法[M].北京:科学出版社,2003:10-12.
[5]O’FARRELL P H.High resolution two-dimensional electrophoresis of proteins [J].J Biol Chem,1975, 250 (10):4007-4021.
[6]万晶宏,贺福初.蛋白质组技术的研究进展[J].科学通报,1999,44(9):904-909.WAN Jinhong, HE Fuchu.The progress of proteomics research technology [J].Chin Sci Bull, 1999, 44 (9): 904-909.
[7]HOAGLAND D R, ARNON D I.The water culture method for growing plants without soil[J].California Agric Exper Stat Bull, 1938, 347: 36-39.
[8]WANG Xuchu, LI Xiaofang, DENG Xin, et al.A protein extraction method compatible with proteomic analysis for the euhalophyte Salicornia europaea [J].Electrophoresis, 2007, 28 (2): 3976-3987.
[9]黎飞,徐秋芳,臧宪朋,等.番茄子叶总蛋白双向电泳体系的建立[J].园艺学报,2010,37(4):661-668.LI Fei, XU Qiufang, ZANG Xianpeng, et al.Establishment of two-dimensional electrophoresis system of tomato cotyledons[J].Acta Hort Sin, 2010, 37 (4): 661-668.
[10]CANDIANO G, RUSCHI M, GHIGGERI G M, et al.Blue silver: a very sensitive colloidal Coomassie G-250 staining for proteome analysis [J].Electrophoresis, 2004, 25 (9): 1327-1333.
[11]PATTON W F.A thousand points of light:the application of fluorescence detection technologies to two-dimensional gel electrophoresis and proteomics [J].Electrophoresis, 2000, 21 (6): 1123-1144.
[12]王阳梦,董银卯,何聪芬.蛋白质组学核心技术研究进展[J].北京工商大学学报:自然科学版,2006,24(4):9-14.WANG Yangmeng, DONG Yinmao, HE Congfen.Review of main techniques for proteomic research [J].J Beijing Technol Bus Univ Nat Sci Ed, 2006, 24 (4): 9-14.
[13]秦慧,刘霆,柳斌,等.几种双向凝胶电泳蛋白质检测方法的比较[J].中国实验血液学杂志,2006,14(1):168-172.QIN Hui, LIU Ting, LIU Bin, et al.Comparison between protein detection methods for two dimensional gel electrophoresis [J].J Exper Hem, 2006, 14 (1): 168-172.
[14]申永锋.抗枣疯病相关蛋白的双向电泳分析[D].保定:河北农业大学,2008.SHEN Yongfeng.Two-dimensional Eleetrophoresis Analysis of Proteins Related to the Resistance of Jujube Wiethes’Broom Disease[D].Baoding: Agricultural University of Heibei, 2008.
[15]刘健平,陈国华,陈本美,等.蛋白质组双向电泳实验中一些常见失误的分析[J].生命科学研究,2003,7(2):177-180.LIU Jianping, CHEN Guohua, CHEN Benmei, et al.Analysis of troubles in 2-dimensional gels electrophoresis of proteomic studies [J].Life Sci Res, 2003, 7 (2): 177-180.
[16]吴满成,胡海涛,余有见,等.牛奶子果实中蛋白质的提取和双向电泳分析方法的改良[J].植物生理学通讯,2009, 45 (7): 695-698.WU Mancheng, HU Haitao, YU Youjian, et al.Extraction and improvement of two-dimensional electrophoresis analysis of proteins from berries of Elaeagnus umbellate Thunb.[J].Plant Physiol Commun, 2009, 45(7): 695-698.
[17]彭存智.红树耐盐相关蛋白的分离和 MALDI-TQ质谱鉴定[D].儋州:华南热带农业大学,2005.PENG Cunzhi.Isolation of Salt Tolerance Related Protein in Rhizophora apiculata and MALDI-TOF MS Identification[D].Danzhou: South China University of Tropical Agriculture, 2005.
[18]范吉星,邓用川,黄惜,等.红海榄根部总蛋白质提取方法的改进和双向电泳体系的建立[J].湖南农业大学学报:自然科学版,2008,34(5):549-553.FAN Jixing, DENG Yongchuan, HUANG Xi, et al.Improvement of protein extraction method from Rhizophora stylosa root and establishment of two-dimensional electrophoresis [J].J Hunan Agric Univ Nat Sci, 2008, 34 (5): 549-553.
[19]甘露,李殿荣,臧新,等.甘蓝型油菜蛋白质双向电泳体系的建立[J].作物学报,2010,36(4):612-619.GAN Lu, LI Dianrong, ZANG Xin, et al.Construction of protein two-dimensional polyacrylamide gel electrophoresis system for Brassica [J].Acta Agron Sin, 2010, 36(4): 612-619.
[20]GÖRG A, OBERMAIER C, BOGUTH G, et al.The current state of two-dimensional electrophoresis with immobilized pH gradients [J].Electrophoresis, 2000, 21 (6): 1037-1053.
[21]BRADFORD M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein dye binding [J].Anal Biochem, 1976, 72: 248-254.
[22]海广范,张慧,牛秉轩,等.水的酸碱度对Bradford法检测蛋白质含量的影响[J].新乡医学院学报,2009,26(2): 144-146.HAI Guangfan, ZHANG Hui, NIU Bingxuan, et al.Effect of water pH value on protein content with Bradford method [J].J Xinxiang Med Coll, 2009, 26 (2): 144-146.
[23]应天翼.蛋白质组学实验中聚丙烯酰胺凝胶的考马斯亮蓝染色[J].生物产业技术,2008(3):70-72.YING Tianyi.The Coomassie brilliant blue staining within polyacrylamide gel proteomics experiments [J].Biotechnol&Bus, 2008(3): 70-72.

