纤维素酶法提取断血流皂苷的工艺研究
刘丽敏, 年四辉, 吴海振
(1.安徽中医药高等专科学校药学系,安徽芜湖 241000;2.皖南医学院药学系,安徽芜湖 241002)
断血流为唇形科植物荫风轮Clinopodium polycephalum(Vaniot)c.Y.wu et Hsuan或风轮菜Clinopodium chinensis(Benth.)O.Kuntze的干燥地上部分,具有止血之功,常用于崩漏、尿血、鼻衄、牙龈出血、创伤出血、子宫肌瘤出血等的治疗[1],化学成分主要包括皂苷、黄酮、氨基酸、多糖、酚性成分和挥发油等成分[2-3],断血流总皂苷是其发挥止血作用的主要成分,但断血流皂苷在药材中含量较低,因此总皂苷的提取率是影响制剂疗效的重要因素。近年来,纤维素酶逐渐应用于植物药有效成分的提取以促进有效成分的溶出[4]。在本提取工艺中,利用纤维素酶对断血流药材预先进行酶解,破坏药材细胞壁,有助于有效成分溶出,然后用水提取,通过对不同酶解条件下断血流皂苷A定量分析,优选出断血流最佳酶解反应条件,以期对断血流提取工艺创新提供参考。
1 材料与方法
1.1 材料 断血流 (购于安徽省亳州中药材市场,经鉴定为荫风轮的地上部分);纤维素酶(枣庄杰诺生物酶制剂公司,活力单位20000 U/g);断血流皂苷A(中国药品生物制品检定所,批号110782-200301);LC-20A高效液相色谱仪(日本岛津);KQ5200B超声清洗器(昆山市超声仪器有限公司),水为乐百氏纯净水,甲醇为色谱纯。
1.2 实验方法
1.2.1 纤维素酶的配制 取纤维素酶适量,置研钵中研成细粉,精密称取纤维素酶1.005 g至25 mL量瓶中,加纯净水配制成804 U/mL酶制剂,4℃保存,用前摇匀。
1.2.2 样品处理 精密取断血流粗粉10 g,加入甲醇100 mL,超声提取30 min,过滤,滤渣续加100 mL甲醇,超声提取30 min,过滤,合并滤液,回收甲醇至稠膏状,石油醚200 mL分次萃取至萃取液色明显变淡为止,甲醇溶解,定容于50 mL量瓶中,0.45 μm滤膜过滤,按1.2.5项下测定断血流皂苷A含量,测得断血流药材中断血流皂苷A的积分面积为566233,皂苷A在药材中的含量为0.024%。
1.2.3 单因素实验及提取工艺流程 由于酶反应速度受酶用量、温度、酶解时间、体系pH影响较大,实验拟对纤维素酶提取的这4个因素参数进行探讨,按表1设计实验:在pH5.0、温度60℃、酶解30 min、酶加入量15 U/g为基础条件下,分别改变这4个因素进行单因素实验,pH与酶解时间是5个水平,酶解温度与酶用量为6个水平,提取液pH通过醋酸-醋酸钠缓冲溶液调节;酶用量采用每克生药所消耗的酶单位表示(U/g)。
称取断血流粗粉40 g,10倍量水提取,按各设计单因素条件酶解后,微沸加热1 h,过滤,续加400 mL水,微沸加热1 h,过滤,合并滤液,取相当于2 g生药量的药液,减压浓缩至干,甲醇分次溶解定容于10 mL量瓶中,0.45 μm滤膜过滤,按1.2.5项下测定断血流皂苷A含量,以断血流皂苷A含量作为评价指标(下同)。
断血流皂苷A含量=(断血流皂苷A质量/药材质量)×100%
1.2.4 正交实验方法 在单因素实验中固定其他三个因素,只对一个因素进行考察,没有考虑到其他各个因素的相互影响,为对各因素综合考察,故在上述单因素试验的基础上选取酶解pH(A)、酶解温度(B)、酶解时间(C)、酶用量(D)4个因素、每个因素设3个水平进行考察,因素水平见表1。按L9(34)正交表进行试验,1.2.3项下进行工艺提取、含量测定。

表1 正交因素水平
1.2.5 断血流皂苷A标准曲线的制备[5]色谱条件:LichrospherC18柱(4.6 mm × 250 mm,5 μm),测定波长:250 nm,流动相:甲醇-水(80:20),流速:1 mL/min,柱温:25 ℃,进样量:10 μL。
精密称取五氧化二磷中干燥至恒重的断血流皂苷A 5.08 mg,甲醇溶解并定容于25 mL量瓶中,从中分别移取0.1、0.5、1.0、2.0、4.0、8.0 mL 至10 mL 量瓶中,甲醇定容至刻度,分别配制成 2.03、10.16、20.33、40.66、81.31、162.62 μg/mL的标准溶液,分别进样10 μL,于波长250 nm处测定,得线性回归方程Y=11 778X+97.169,R2=0.999 8,断血流皂苷A在2.03~162.62 μg/mL范围内成线性关系。加样回收试验、重复性试验、精密度试验、稳定性试验均符合要求。
2 结果与分析
2.1 pH对断血流皂苷A提取率的影响 由图1可以看出,随着溶液pH增大,断血流皂苷A的提取率逐渐增大,在pH为6.0时断血流皂苷A峰积分面积最大,表明提取率达到最大值,之后随着pH值的继续增加,断血流皂苷A提取率降低,故最佳pH为6.0。
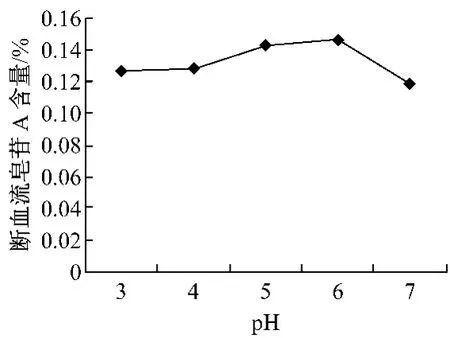
图1 pH对断血流皂苷A溶出的影响
2.2 酶解温度对断血流皂苷A提取率的影响 由图2可以看出,在温度为60℃时断血流皂苷A峰积分面积最大,表明提取率达到最大值,随着温度继续升高,提取率急剧下降,盖因温度升高可以增加纤维素酶的活性,但温度过高会导致酶失活,所以酶解温度在60℃较为适宜。
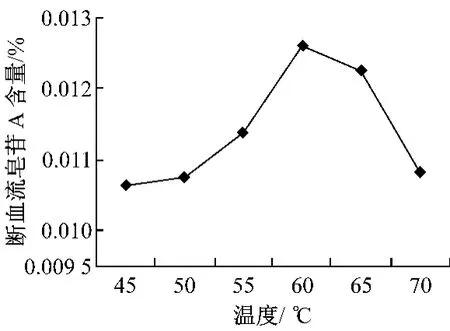
图2 温度对断血流皂苷A溶出的影响
2.3 酶解时间对断血流皂苷A提取率的影响 由图3可以看出,随着酶解时间的增加,断血流皂苷A的提取率也在增加,酶解时间为40 min时断血流皂苷A的提取率达到最大值,随后增加酶解时间反而提取率下降,故酶解时间为40 min。
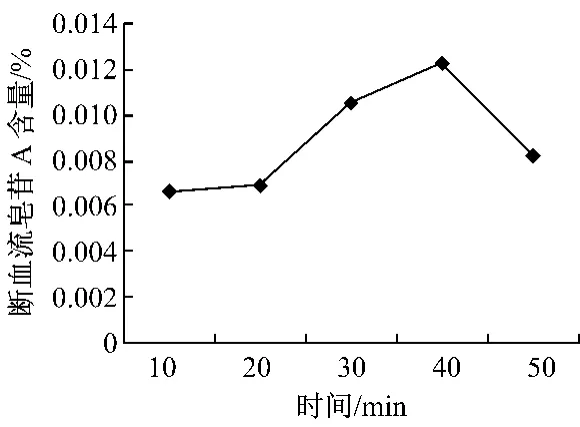
图3 酶解时间对断血流皂苷A溶出的影响
2.4 酶用量对断血流皂苷A提取率的影响 由图4可以看出开始随着酶用量的增加断血流皂苷A的提取率也在增加,在用量为15 U/g时提取率达到最大值,进一步增加酶用量,皂苷A提取率下降明显,故定为酶用量为15 U/g。
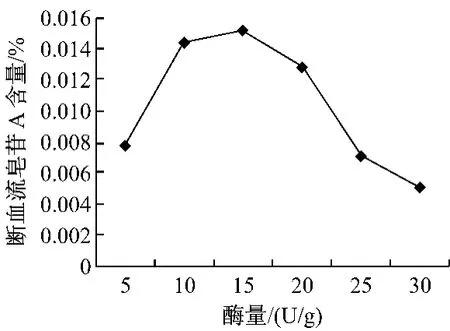
图4 酶用量对断血流皂苷A溶出的影响
2.5 正交实验结果分析 正交实验直观分析表明,断血流皂苷A的提取率极差大小B>A>D>C,较好的工艺组合为A3B2C2D1。方差分析结果表明,因素B酶解温度在α=0.1水平上影响显著,因素A酶解pH在α=0.25水平上影响显著,因素C酶解时间、D酶用量影响较小,所以最佳酶提取条件为:酶解 pH 7、温度60℃、酶用量5 U/g、酶解时间40 min。见表3。

表3 正交实验设计及直观分析

表4 方差分析
2.6 验证性实验 称取断血流粗粉40 g 3份,量取400 mL pH7.0的水,60℃温度下加入5 U/g纤维素酶,酶解40 min后,微沸提取1 h,过滤,续加400 mL水,微沸加热1 h,过滤,合并滤液,取相当于2 g生药量的药液,减压浓缩至干,甲醇分次溶解定容于10 mL量瓶中,0.45 μm滤膜过滤,按1.2.5项下测定断血流皂苷A含量,得断血流皂苷A平均积分面积为514829,断血流皂苷A含量为0.021 8%,提取率为90.92%;另取断血流粉40 g 3份,不经酶解直接提取,得断血流皂苷A平均积分面积为412149,断血流皂苷A含量为0.017 5%,断血流皂苷A平均提取率为72.79%,经过酶解处理断血流皂苷A提取率可以提高18.13%。
3 讨论
本实验主要是以断血流皂苷A作为指标检测酶解的作用效果,研究酶解提取法工艺的目的在于寻求最适的酶作用条件,以发挥酶的最大催化效果,使细胞壁降解形成更疏散的结构,同时还要有效保证药效成分的稳定,达到最高的提取收率。以断血流皂苷A提取率为评价指标能显示出断血流有效成分总皂苷的酶解提取效果。
单因素实验最优条件pH为6.0、酶解温度60℃、酶解时间40 min、酶用量为15 U/g,与正交实验最佳水平pH7.0、酶解温度60℃、酶解40 min、酶用量为5 U/g有所矛盾,但因单因素实验是固定其他因素只对一个因素考察,没有考虑到各个因素间的交互作用,故正交实验结果确定为最佳酶解条件。
纤维素酶通过降解植物细胞壁中纤维素的结构从而促进植物细胞中化学成分的溶出,其机理主要是裂解纤维素单元糖与糖之间的1→6位的连接,但对于苷类成分来说,糖链中的糖与糖、糖与苷元之间的连接有时也会出现1→6位连接,我们在使用纤维素酶的时要慎重,以免对目标成分造成破坏。本实验单因素实验中,随着酶用量的增加,断血流皂苷A提取率降幅较大,是否对断血流皂苷A结构造成破坏还有待进一步研究。
[1]中国药典[S].一部.2005:267.
[2]迟海东,路金才.风轮菜属药用植物研究进展[J].沈阳药科大学学报,2006,23(2):123-128.
[3]程 霞,陈国广,石绍华.止血中草药断血流研究进展[J].安徽医药,2007,11(5):454-456.
[4]王剑文,许云峰,周建芹,等.酶法辅助强化中药提取过程研究进展[J].生物加工过程,2008,6(6):6-11.
[5]陈华国,陈 庆,靳凤云.HPLC法测定断血流中断血流皂苷的含量[J]. 贵阳中医学院学报,2006,28(3):62-63.