3种ELISA试剂盒检测抗牛支原体抗体的比较
刘 洋,陈 维,宋志强,孙文静 ,李 媛,邹小辉,辛九庆*
(1.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/动物细菌病研究室/国家牛传染性胸膜肺炎指定检测实验室,黑龙江 哈尔滨 150001;2.东北农业大学动物医学学院,黑龙江 哈尔滨 150030)
牛支原体(Mycoplasma bovis)属于支原体属,可引起犊牛的肺炎、乳腺炎、角膜炎和关节炎。M.bovis是柔膜体纲中继丝状支原体丝状亚种(Mycoplasma mycoidessubsp.mycoidesSC,MmmSC)对牛致病力最强的支原体[1-2]。该病原呈世界性分布[3],2008年首次从我国某地区牛肺炎病例的牛肺中分离到M.bovis[3]。M.bovis引起的疾病与MmmSC引起的牛传染性胸膜肺炎(Contagious bovine pleuropneumonia,CBPP)具有相似的临床症状和病理剖检变化,不易鉴别诊断[4-6]。因此,迫切需求一种可靠的M.bovis血清学鉴别诊断方法。
国外商品化的检测M.bovis抗体ELISA诊断试剂盒有加拿大生产的检测M.bovis抗体ELISA诊断试剂(简称“Kit 1”)和比利时生产的试剂盒(简称“Kit 2”)。目前,尚未出现国产商品化的检测M.bovis抗体ELISA诊断试剂盒。因此,本实验室建立检测M.bovis抗体ELISA方法并组装成试剂盒(简称“HVRI试剂盒”)。本研究应用以上3种试剂盒对已知血清样品进行检测,统计检测结果与综合检测结果的符合率同时对3种试剂盒进行一致性分析,为HVRI试剂盒的应用提供了实验依据。
1 材料和方法
1.1 病原和血清 M.bovis湖北分离株由本实验室分离并鉴定,按照文献[3]方法培养至108CCU/mL(CCU为颜色变化单位);采自不同地区自然感染发病牛血清样品19份,经血清学和病原学诊断为M.bovis感染;人工感染发病牛血清样品18份;牛传染性胸膜肺炎国际标准血清PS2(用于交叉反应)购自葡萄牙国家兽医实验室——世界动物卫生组织(OIE)指定的牛传染性胸膜肺炎国际参考实验室。所有血清样品进行牛传染性支气管炎病毒(IBRV)、牛病毒性腹泻病毒(BVDV)、牛副流感病毒I型病毒(BPIV1)、牛副流感病毒Ⅲ型病毒(BPIV3)和口蹄疫病毒(FMDV)的血清学检测。对所有临床发病牛进行巴氏杆菌病原学检测,对人工感染和健康牛的鼻拭子做巴氏杆菌(PM)病原学检测。
1.2 主要实验材料 HVRI试剂盒由本实验室开发并研制;Kit 1由加拿大生产的检测M.bovis抗体ELISA诊断试剂盒购自北京兰博瑞生物技术有限公司;Kit 2由比利时生产的检测M.bovis抗体ELISA诊断试剂盒购自北京兰博瑞生物技术有限公司;HRP标记的抗牛IgG抗体和TMB显色底物购自Sigma公司。
1.3 血清样品的制备 断初乳的新生犊牛饲养至35 d~45 d,用Kit 1筛选M.bovis阴性犊牛18头,每头牛接种40 mLM.bovis纯培养物,参照文献[3]的方法监控零周起每周血清抗体和排毒的情况,选取转阳后的血清作为阳性血清样品。阴性血清样品38份,其中20份采自无M.bovis病史的健康牛群;另外18份阴性血清样品采自于用于人工感染前的18头牛。用Kit 1检测血清抗体,用PCR方法检测鼻拭子中有无M.bovis病原体。
1.4 间接ELISA试验 Kit 1和Kit 2按各自说明书所述方法进行。HVRI试剂盒操作顺序如下:以原核表达获得M.bovis抗原(另文发表)作为包被抗原,1∶160倍稀释的待检血清及阴性和阳性对照血清为一抗,37℃孵育,HRP酶标(1∶8000)为二抗,37℃孵育,TMB显色,H2SO4终止,通过OD450nm数值判定结果。
1.5 判定标准 Kit 1和Kit 2按照其附带说明书所述方法对结果进行判定。HVRI试剂盒判断标准为:以公式S/P=(S-N)/(P-N)计算各样品的S/P值(S为样品OD450nm值,N为阴性对照平均OD450nm值,P为阳性对照平均OD450nm值)。S/P≤0.351,判定为阴性;S/P>0.351,判定为阳性。
1.6 检测数据的处理分析
1.6.1 符合率试验 各试剂盒检测结果与综合检测结果的符合率按照公式进行:符合率=(试剂盒检测阳性样品为阳性的样品数+试剂盒检测阴性样品为阴性的样品数)/样品总数
1.6.2 一致性检验 Kappa统计量一致性强度按照文献[7]的方法进行,Kappa值愈高表示一致性愈好,当Kappa值<0时,表明两方法间一致性为极差;当Kappa值在0.0~0.2范围内,一致性为微弱;Kappa值在0.21~0.40范围内,一致性为弱;Kappa值在0.41~0.6范围内,一致性为中度;Kappa值在0.61~0.80范围内,一致性为高度;Kappa值在0.81~1.00范围内,一致性为极强。
2 结果
2.1 综合检测结果 自然感染发病牛均存在发热、咳嗽和消瘦等症状,剖检可见肺脏大面积实变并出现乳糜状结节等,血清学诊断与病原学检测结果诊断为M.bovis感染。18头人工感染牛在接种后2周~4周出现血清阳转(Kit 2检测)。鼻拭子监测结果显示,18头牛均在感染后2周~4周开始排毒。对所有血清样品进行 IBRV、BVDV、BPIV1、BPIV3和FMDV的血清学检测,结果均为阴性。对人工感染和健康牛的鼻拭子进行PM病原学检测,结果均为阴性。
2.2 与综合检测结果符合率的评价 经综合检测,19份自然感染发病样品和18份人工感染样品均为M.bovis阳性,共37份;18份人工感染前的牛血清样品和20份健康牛血清样品均为M.bovis阴性。Kit 1检测结果和HVRI试剂盒检测结果及综合诊断结果符合率分别为96.00%和92.00%,而Kit 2检测结果与综合诊断符合率仅为74.67%(表1)。Kit 2检测18份未食初乳的35 d~45 d健康犊牛样品,出现6份假阳性结果,其他两个试剂盒检测18份健康犊牛血清均呈阴性。

表1 3个试剂盒与综合诊断结果符合率分析Table 1 Analysis of the agreement rate of kits to Integrated diagnosis
2.3 检测试剂盒一致性 用Kappa值对3种试剂盒的检测结果进行一致性检验,HVRI试剂盒与Kit 1 Kappa值=0.812>0.8,有极强的一致性;Kit 1与Kit 2和HVRI试剂盒与Kit 2分别有中度的一致性(表2、表 3和表4)。
2.4 交叉反应 采用购自牛传染性胸膜肺炎国际标准血清PS2对3个ELISA试剂盒进行比较,结果表明,Kit 1和HVRI试剂盒检测判定为阴性,Kit 2检测判定为阳性。
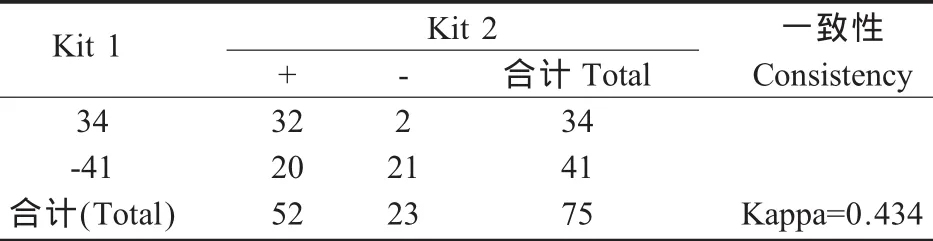
表2 Kit 1与Kit 2一致性分析Table 2 Kappa consistency check of the Kit 1 and Kit 2
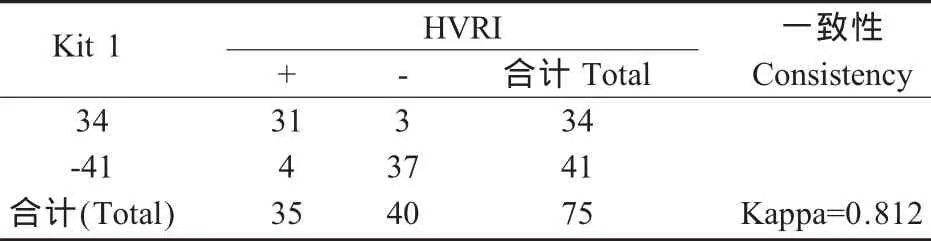
表3 Kit 1与HVRI试剂盒一致性分析Table 3 Kappa consistency check of the Kit 1 and HVRI Kit
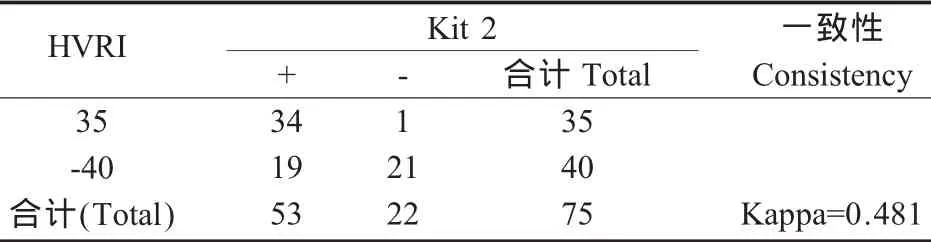
表4 HVRI试剂盒与Kit 2一致性分析Table 4 Kappa consistency check of the HVRI Kit and Kit 2
3 讨论
本实验将临床症状、病理学变化、血清学和病原学诊断结果作为综合诊断依据,保证所选血清具有说服力。选取的37份阳性样品中19份来自于地方送检的自然感染发病牛,这些牛所在牛场在引入新牛后,肺炎病例开始出现或明显增多,抗生素治疗无效[9-10]。病理剖检发现,发病牛肺脏存在大面积实变,有M.bovis典型的乳糜状结节[11-12]。通过病原分离、PCR鉴定,证明为M.bovis阳性[3];18份阳性样品由人工感染制得。剥夺初乳的犊牛经气管接种后,分别在攻毒后2周~4周阳转,经鼻拭子监测18头牛排毒,所以这18头牛诊断为M.bovis阳性;38份阴性样品中有20份来自于无M.bovis既往病史和临床症状小于4月龄的牛,有18份来自于未食初乳的35 d~42 d健康犊牛,经Kit 1检测,这38份血清全部为M.bovis阴性。
3种试剂盒检测样品结果表明,HVRI试剂盒和Kit 1的诊断结果与综合诊断结果符合率较高,分别为92.00%和96.00%,但Kit 2的符合率仅为74.67%,并且存在一定的假阳性率。采用在医学评价诊断方法方面应用广泛的Kappa一致性检验[7-8],对这3种试剂盒一致性进行比较,结果表明HVRI试剂盒和Kit 1有极强的一致性,而Kit 2与其他两种试剂盒的检测结果一致性相对较差。用CBPP国际标准血清PS2对3个ELISA试剂盒的交叉反应评价,HVRI试剂盒和Kit 1均能排除MmmSC抗体的干扰,而用Kit 2检测结果证明Kit 2不能排除Mmm-SC抗体的干扰。通过上述比较发现,HVRI试剂盒的准确性接近于Kit 1而且二者有极高的一致性,二者能够作为开展M.bovis流行病学调查和隔离检疫的有效检测方法。HVRI试剂盒可以填补国产检测M.bovis抗体ELISA诊断试剂盒的空白。
[1]Francois P,Dominique L G,Sandrine P,et al.Efficacy of spectinomycin againstMycoplasma bovisinducedpneumoniain conventionally reared calves[J].Vet Microbiol,2001,80:23-35.
[2]Finoa P.Maunsel.Mycoplasma bovisInfections in young calves[J].Vet Clin Food Anim 2009,25:139-177.
[3]辛九庆,李媛,郭丹,等.国内首次从患肺炎的犊牛肺脏中分离到牛支原体[J].中国预防兽医学报,2008,30(9):661-664.
[4]Adegboye D S,Halbur P G,Cavanaugh D L,et al.Immunohistochemical and pathological study of Mycoplasma bovis-associated lung abscesses in calves[J].Vet Diagn Invest,1995,7:333-337.
[5]Donachie W.Bacteriology of bovine respiratory disease[J].Cattle Pract,2000,8:5-7.
[6]Ayling R D,Baker S E,Peek M L,et al.Comparison of in vitroactivity of danofloxacin,florfenicol,oxytetracycline,spectinomycin and tilmicosin against recent field isolates of Mycoplasma bovis[J].Vet Rec,2000,146:745-749.
[7]夏世邦,吴金华.Kappa一致性检验在检验医学研究中的应用[J].中华检验医学杂志,2006,29:83-84.
[8]华琳,阎岩,张建.关于对诊断一致性Kappa系统的探讨[J].数理医药学杂志,2000,12:228-230.
[9]Langford.Mycoplasma agalactiaesubsp.bovis in pneumonia and arthritis of the bovine[J].Can J Comp Med,1977,41:89-94.
[10]Muenster O A,Ose E,Matsuoka D.The incidence of Mycoplasma dispar,Ureaplasmaand conventional Mycoplasma in the pneumonic calf lung[J].Can J Comp,1979,43:392-398.
[11]Nicholas R A,Ayling R D.Mycoplasma bovis:disease,diagnosis,and control[J].Res Vet Sci,2003,74:105-112.
[12]Gagea M I,Bateman K G,Shanahan R A,et al.Naturally occurringMycoplasma bovis-associated pneumonia and polyarthritis in feedlot beef calves[J].Vet Diagn Invest,2006,18:29-40.

