Smad4基因沉默对胰腺上皮内瘤变细胞基因表达谱影响的初步研究*
朱 兰 柳茂森 杨纯英王 琪蒋 荷姚静静王立夫#
上海交通大学医学院附属瑞金医院消化内科1(200025) 浙江省台州市中心医院消化内科2
近年,胰腺癌前病变胰腺上皮内瘤变(pancreatic intraepithelial neoplasia,PanIN)中的异常分子遗传学事件逐渐受到关注[1]。Kras基因第12位密码子突变是胰腺癌发生、发展中的主要早期事件,而Smad4基因突变是主要晚期事件[2]。Smad4基因属抑癌基因,可抑制胰腺癌细胞增殖[3]。本课题组的前期研究成功构建了 LoxP-Stop-LoxP-KrasG12D;Pdx1-Cre PanIN模型(第l2位甘氨酸突变为天冬氨酸),分离并建立了早期PanIN细胞株[4,5],并以RNA干扰技术成功沉默PanIN细胞的Smad4基因以获取PanIN-S细胞株。本研究以PanIN细胞和PanIN-S细胞为研究对象,应用小鼠全基因表达谱芯片筛查两种细胞的基因表达谱差异,探讨Smad4基因沉默致PanIN细胞增殖和恶性转化的可能分子机制。
材料与方法
一、细胞株、主要试剂、仪器和基因芯片
PanIN细胞株为Kras基因突变小鼠基因打靶胰腺 PanIN 模型(LoxP-Stop-LoxP-KrasG12D;Pdx1-Cre小鼠[4])经体外建株获得,基因突变分析示PanIN细胞可检测到KrasG12D突变,但无p16、p53、Smad4等基因突变或缺失[5]。采用RNA干扰技术,慢病毒介导PanIN细胞内源性Smad4基因沉默以建立PanIN-S细胞株。
Trizol(Invitrogen 公 司 ),RNeasy MiniKit(Qiagen 公司),aa-UTP(Ambion 公司),Cy3 NHS ester(GE Healthcare 公司),PrimeScriptTMRT reagent Kit、SYBR Premix Ex Taq (TaKaRa 公司),Low RNA InputFluorescentLinearAmplification Kit、Gene Expression Hybridization Kit、Gene Expression Wash Buffer Kit、Stabilization and Drying Solution、Microarray GasketSlide Kit、Microarray Hybridization Chamber Kits、2100生物分析仪、G2565BA微阵列扫描仪(Agilent公司)。
Agilent小鼠 4×44 K全基因表达谱芯片由上海伯豪生物技术有限公司提供,每张芯片代表小鼠基因组中所有已知基因和转录本,约含41174个小鼠基因和转录本。PanIN细胞和PanIN-S细胞各使用三张芯片。
二、方法
1.提取并纯化总 RNA:Trizol提取细胞总RNA,260 nm和280 nm处测定吸光度(A)值以确定样品浓度和纯度。1%甲醛变性琼脂糖凝胶电泳,2100生物分析仪行质检,RNeasy Mini Kit纯化总RNA。
2.aa-UTP标记cRNA:采用第一链和第二链一步法逆转录合成cDNA,以cDNA第二链为模板体外转录合成cRNA并行aa-UTP标记。RNeasy Mini Kit纯化cRNA。
3.cRNA样品荧光标记和纯化:测定cRNA浓度,取 4μg cRNA 浓缩至 6.6μl,加入 DMSO 10μl、碳酸氢钠(0.3 mol/L,pH 9.0)3.4μl以制备 cRNA混合液。取20μl混合液加入荧光染料(Cy3 NHS ester)25℃孵育1 h进行标记。加入hydroxylamine(4 mol/L) 9μl混匀,25 ℃孵育 15 min。 RNeasy Mini Kit纯化cRNA。
4.芯片杂交和洗涤:取55μl混合液,60℃温浴30 min 行片段化,加入 55μl缓冲液。取 100μl混合液上芯片,10 r/min 65℃滚动杂交17 h,芯片洗涤。
5.芯片检测和分析:微阵列扫描仪行芯片扫描,GeneSpring GX 10生物芯片数据分析软件行结果分析,并行Quantile均一化处理。标准化后的信号值行差异倍数比较,筛选出差异倍数>2的基因点。
6.实时荧光定量RT-PCR验证差异表达基因:Trizol提取细胞总RNA,逆转录为cDNA。目的基因PCR引物由BioTNT公司合成(见表1)。PCR反应体系为25μl。反应条件:95℃预变性30 s;95℃ 5 s,60℃ 1 min,共40个循环。目的基因表达量的分析采用 2-ΔΔCt法。
三、统计学分析
结 果
一、RNA质量鉴定
总 RNA A260/A280 比值为 1.91~2.02,l%甲醛变性琼脂糖凝胶电泳可观察到清晰的18 S和28 S条带,说明RNA质量良好,无降解。
二、基因芯片筛选结果分析
基因芯片扫描图像背景均一,各点间距均匀相等,所获图像整体背景较低,信噪比较高。变异系数为2.44%~4.10%(变异系数在15%左右表示实验成功,越小表示重复性越好)。基因芯片杂交结果示差异倍数>2的基因共237个,其中148个基因在PanIN-S细胞中表达上调,89个基因表达下调,差异表达基因主要涉及细胞周期、增殖、凋亡、黏附、转录活性等。
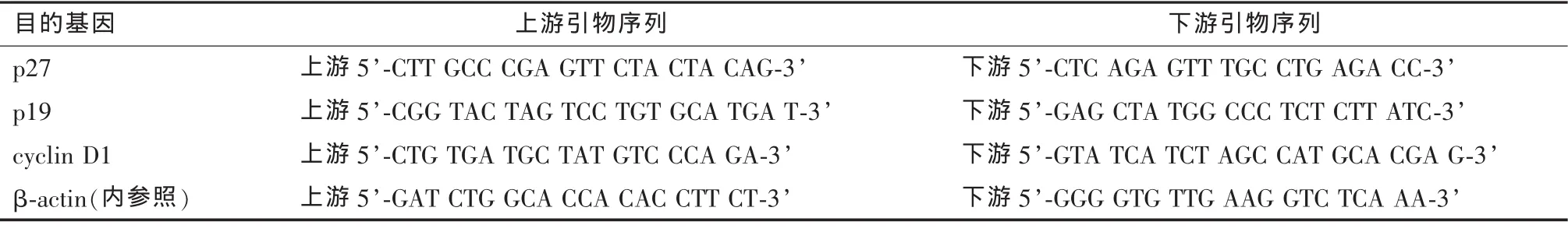
表1 目的基因PCR引物序列和扩增片段大小
进一步对细胞周期相关基因,包括细胞周期蛋白依赖性激酶(CDK)1、CDK2、CDK4、CDK6、细胞周期蛋白(cyclin)A、cyclin B、cyclin D、cyclin E、CDK 抑制剂 p15、p16、p18、p19、p21、p27 等进行筛选,结果示PanIN细胞与PanIN-S细胞的p27、p19、cyclin D1基因表达存在显著差异,差异倍数分别为 0.38、0.36 和 2.11。
三、基因芯片筛选结果验证
实时荧光定量RT-PCR结果示PanIN细胞与PanIN-S细胞间 p27、p19、cyclin D1基因表达存在显著差异(P<0.05),差异倍数均值分别为0.41、0.39和1.82(见图1),与基因芯片筛选结果一致。
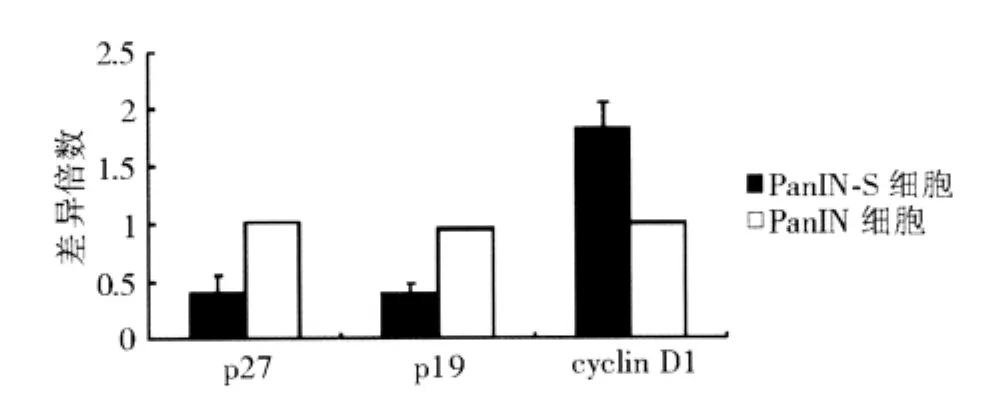
图1 两组细胞p27、p19和cyclin D1相对表达量比较(实时荧光定量RT-PCR)
讨 论
抑癌基因 Smad4是转化生长因子-β(TGF-β)信号转导途径中的关键分子,TGF-β/Smad4信号转导途径可通过阻断细胞周期的G1/S期转换,促进细胞凋亡。文献报道PanIN和胰腺癌的Smad4基因突变率约为50%,而其他肿瘤中的突变率通常<10%,提示Smad4基因是PanIN和胰腺癌较特异的抑癌基因[6]。
本课题组的前期研究采用RNA干扰技术沉默Smad4基因表达,体外实验证实在Kras基因突变启动的PanIN细胞中沉默Smad4基因可促进PanIN细胞的恶性转化,但其具体机制尚未阐明。PanIN-S细胞增殖细胞核抗原(PCNA)阳性表达率显著高于PanIN细胞,提示Smad4基因缺失联合Kras基因突变可显著促进PanIN细胞增殖,且有进展为胰腺导管腺癌的可能[6]。
本研究通过基因芯片技术检测PanIN细胞和PanIN-S细胞的基因表达谱差异,结果示两组细胞涉及细胞周期、增殖、凋亡、黏附、转录活性等的237个基因出现差异表达,其中与细胞周期相关的差异表达基因包括p27、p19、cyclin D1,实时荧光定量RT-PCR验证结果与基因芯片筛选结果一致,由此提示细胞周期相关基因p27、p19、cyclin D1表达异常可能参与了PanIN-S细胞的增殖和恶性转化。
p27基因又称CDKN1B,其编码蛋白属Cip/Kip家族,可与CDK2竞争性结合,致cyclin A-CDK2、cyclin E-CDK2、cyclin B-CDK2等复合体形成受抑,以阻止细胞从G2期进入M期。Shiraso等[7]的研究证实p27kip1过表达可明显抑制胆管癌细胞生长。Chen等[8]的大样本病例对照研究发现,p27基因突变人群发生胰腺癌的概率明显高于普通人群。p19基因又称CDKN2D,其编码的CDK抑制蛋白可通过与CDK4或CDK6竞争性结合抑制cyclin D-CDK4或cyclin D-CDK6复合体形成,从而阻止细胞从G1期进入S期。Ulanet等[9]的研究发现p19基因缺失可经p53依赖和p53非依赖性途径促进肿瘤细胞增殖。本研究结果示PanIN-S细胞的p27、p19表达显著低于PanIN细胞,提示Smad4基因沉默可抑制p27、p19表达,推测前者可能通过促进cyclin B-CDK2复合体形成,使细胞从G2期进入M期;后者可能通过促进cyclin D-CDK4复合体形成,使细胞从G1期进入S期,由此促进肿瘤细胞增殖。
cyclin D1可促进细胞增殖,作为细胞周期中短暂出现的基因表达产物,具有严格的周期顺序性,可与特定CDK结合形成复合体,以促进细胞从G1期进入S期,其过表达可缩短G1期,减少细胞对生长因子的依赖,故可导致细胞持续分裂和增殖。Halilovic等[10]的研究发现PIK3CA基因突变可修复cyclin D1,致肿瘤细胞持续增殖。Radulovich等[11]的研究发现cyclin D3为胰腺癌细胞周期原始启动子,cyclin D1和cyclin D3可协同促进胰腺癌细胞的有丝分裂。本研究结果示PanIN-S细胞cyclin D1表达增加,推测Smad4基因沉默可促进cyclin D1表达,通过与CDK2、CDK4形成复合体,使细胞进入S期,由此促进肿瘤细胞增殖。
综上所述,本研究通过基因芯片技术筛选并经实时荧光定量RT-PCR验证发现Smad4基因沉默可致PanIN细胞的细胞周期相关基因p27、p19和cyclin D1表达发生明显改变,这可能是其参与PanIN-S细胞增殖和恶性转化的机制之一。对差异表达基因的深入研究有助于阐明多基因调控网络在胰腺癌发生中的作用,从而为胰腺癌的诊断和治疗提供新的线索。
1 王琪,王立夫.小鼠胰腺肿瘤模型的研究进展.内科理论与实践,2010,5(6):507-510.
2 Koorstra JB,Feldmann G,Habbe N,et al.Morphogenesis of pancreatic cancer:role of pancreatic intraepithelial neoplasia (PanINs).Langenbecks Arch Surg,2008,393(4):561-570.
3 Yasutome M,Gunn J,Korc M.Restoration of Smad4 in BxPC3 pancreatic cancer cells attenuates proliferation without altering angiogenesis.Clin Exp Metastasis,2005,22(6):461-473.
4 Hingorani SR,Wang L,Multani AS,et al.Trp53R172H and KrasG12D cooperate to promote chromosomal instability and widely metastatic pancreatic ductal adenocarcinoma in mice.Cancer Cell,2005,7(5):469-483.
5 王立夫,Tuveson DA.Kras突变小鼠胰腺癌前病变PanIN细胞的生物学特性.中国癌症杂志,2006,16(8):651-657.
6 齐晓光,慎睿哲,王立夫,等.Smad4基因沉默促进PanlN裸鼠移植瘤增殖和微血管形成的研究.中国癌症杂志,2009,19(7):485-490.
7 Shiraso S, Katayose Y, Yamamoto K, et al.Overexpression of adenovirus-mediated p27kip1 lacking the Jab1-binding region enhances cytotoxicity and inhibits xenografted human cholangiocarcinoma growth.Anticancer Res,2009,29(6):2015-2024.
8 Chen J,Amos CI,Merriman KW,et al.Genetic variants of p21 and p27 and pancreatic cancer risk in non-Hispanic Whites:a case-control study.Pancreas,2010,39(1):1-4.
9 Ulanet DB,Hanahan D.Loss of p19(Arf)facilitates the angiogenic switch and tumor initiation in a multi-stage cancermodelvia p53-dependentand independent mechanisms.PLoS One,2010,5(8):e12454.
10 Halilovic E,She QB,Ye Q,et al.PIK3CA mutation uncouples tumor growth and cyclin D1 regulation from MEK/ERK and mutant KRAS signaling.Cancer Res,2010,70(17):6804-6814.
11 Radulovich N,Pham NA,Strumpf D,et al.Differential roles ofcyclin D1 and D3 in pancreatic ductal adenocarcinoma.Mol Cancer,2010,9:24.

