应变率成像评价孤立性阵发性房颤患者左心房主动泵血功能
黄国倩 舒先红 周京敏 潘翠珍 陈灏珠
孤立性阵发性房颤(paroxysmal atrial fibrillation,PAF)是临床上最常见的心血管疾病之一,经导管射频消融是近年来发展起来的一项新的房颤治疗技术,可使部分房颤(atrial fibrillation,AF)患者达到临床治愈。许多临床研究均显示,该手术可以有效地恢复窦性心律,逆转左心房(left atrial,LA)重构,但对LA主动泵血功能的影响尚不明确。LA的主动泵血功能对于AF的发生及预后具有重要的影响,但受技术限制,一直未得到深入的研究。在组织速度成像(tissue velocity imaging,TVI)基础上衍生的应变率成像(strain rate imaging,SRI)技术可定量研究心肌运动和变形功能,问世后一直用于左心室功能评价,用于LA功能的研究较少。本研究采用SRI技术对PAF射频消融手术前后的LA主动泵血功能进行随访,旨在了解孤立性PAF患者LA泵血功能及导管射频消融的影响,指导临床治疗和预后评价。
1 资料和方法
1.1 研究对象
包括20例成功接受首次经导管射频消融术治疗并维持窦性心律半年以上的孤立性PAF患者(常规超声心动图上无明确的器质性心脏病,无其他器质性心脏病病史)。剔除左室射血分数(left ventricle ejection fraction,LVEF)<55%、随访期间AF复发的患者、因频发早搏或透声条件差等原因影响图像质量的患者。其中男性9例,女性11例,平均年龄(59±11)岁,平均LVEF(65.65%± 5.79%)。选取20例无AF及其他心脏病史,无心脏疾病相关症状体征,常规超声心动图及心电图检查正常的患者作为对照组,其中男性6例,女性14例,平均年龄(58±10)岁,平均LVEF(67.60%± 6.44%)。
1.2 超声心动图检查
患者分别在射频消融术前、术后3个月和半年随访常规超声心动图、LA的TVI及SRI。采用GE Vivid 7彩色多普勒超声成像仪(M4S探头)采集连续3个心动周期的动态图像,数字化存储以供脱机分析。测量LA主动泵血功能指标如下(3个心动周期的平均值):
于心尖四腔观运用Simpson法测量收缩末期(T波结束)的最大LA容积(LAV max)、P波前LAV(LAV-preP)、舒张末期(Q波前)的最小LAV(LAV min); 计算LA主动射血分数AAEF=(LAV-preP - LAV min )/ LAV-preP×100%。测量二尖瓣血流图舒张晚期A波的峰值流速(MV-A)以及肺静脉血流图Ar波的流速 (PV-Ar)。
于心尖四腔观进行TVI及SRI成像,取样门宽(3~5 mm)置于LA侧壁及房间隔中段,记录LA心肌舒张晚期的运动速度(Am)和应变率(SR-A); 心房肌总位移(T total)、总应变(εtotal)及心电图P波前心房收缩产生的主动位移(T-P)和主动应变(ε- P),并计算后者占总位移或应变的百分比(%T-P = T-P/T total ×100%; %ε- P = ε- P/εtotal×100%)。以房间隔及侧壁对应位点各指标的平均值代表LA的测值(图1)。

图1 运用TVI及SRI技术测量正常人心房中部的心肌运动和变形功能A:组织运动曲线; B:组织位移曲线; C:组织应变率曲线; D:组织应变曲线。黄色、绿色及红色分别代表右房侧壁、房间隔、LA侧壁。蓝色箭头指示的是心电图P波时心房主动收缩所产生的舒张晚期速度、主动位移、舒张晚期应变率及主动应变
1.3 统计学处理
采用SPSS 11.5软件进行统计分析。对于正态分布参数采用表示,PAF与正常对照组之间参数比较采用独立样本t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 术前PAF患者的LA重构与功能(表1、2)
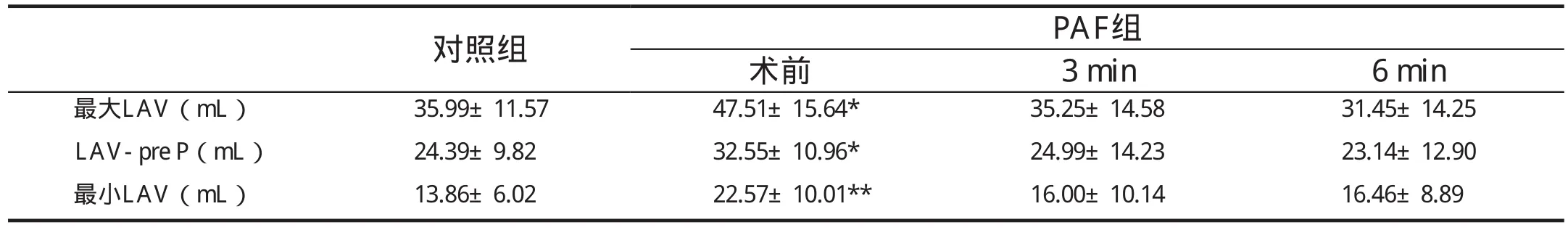
表1 PAF患者射频消融术后LA重构逆转
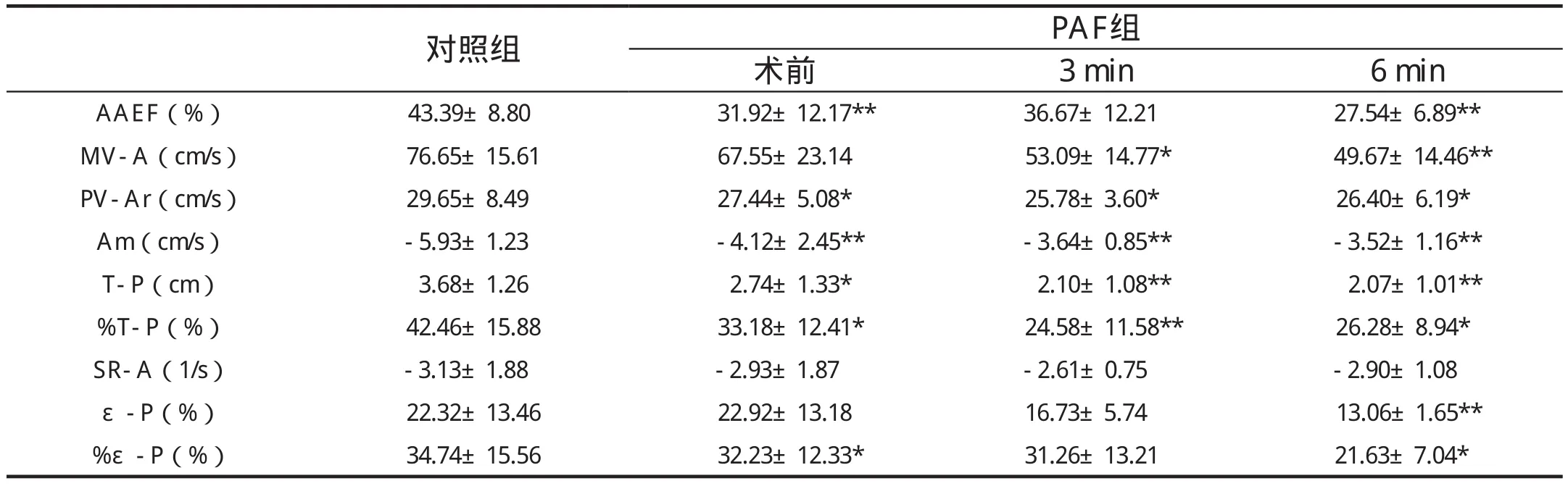
表2 PAF患者心房肌主动收缩功能指标
与正常对照组相比,PAF患者术前LA明显扩大(P均<0.05); LA的主动收缩功能明显降低,AAEF及PV-Ar低于正常组(P分别为0.002、0.037)。
心房肌的运动、位移、应变率和应变呈规律的曲线(图1)。心房肌的运动和位移与心室同向,变形则与心室肌反向。PAF患者舒张晚期心房肌速度、心房肌主动位移及主动位移分数均较正常组降低(P分别为 P=0.006、0.030和0.049),反映了PAF患者LA主动运动功能的减退; 同时,心房肌的主动应变分数较正常组也明显下降(P=0.046),反映了LA主动变形功能的减退。
2.2 射频消融术后LA泵血功能的变化
术后3个月,各时相的LAV较术前显著缩小(与术前相比,P均<0.05),与正常组差异消失。尽管如此,LA主动泵血功能未见明显改善,术后6个月AAEF、二尖瓣血流A峰速度、心房肌舒张晚期速度、主动位移及应变、主动位移及应变分数等指标仍明显低于正常组。
3 讨论
LA功能包括储血、传输及泵血功能,其中泵血功能又称为心脏的助力泵,对于维持正常左室排血具有重要意义,尤其是老年人或左心室功能处于代偿边缘的患者,一旦LA失去主动收缩,可导致心功能的恶化,诱发或加重心衰。LA的主动收缩可以避免LA内血栓形成,降低脑卒中的发生,此外,LA的大小及泵血功能对于预测AF发生或复发具有重要意义[1-3],可帮助临床决定是否需要预防性使用抗心律失常药物及继续抗凝治疗。传统的评价LA泵功能方法主要包括:LA主动面积变化分数和AAEF、二尖瓣血流A波流速、肺静脉血流Ar波速度及左心耳血流的峰值排空速度等。这些传统方法耗时费力,观测者间变异大,易受左室功能以及年龄、心率及前负荷等因素的影响。TVI及衍生的SRI技术可评价局部心肌的运动和变形功能,已被广泛应用于左心室的功能评价,但将其运用到评价心房功能的研究仍然较少。国外的研究显示,心房的应变反映了LA的收缩功能,较少受到心室功能的影响[4]; 慢性AF中,LA的应变及应变率明显降低[5-7]; 心肌梗死患者的心房应变率曲线变钝,峰值延迟[4]; 导管消融后,LA应变和应变率较高的患者术后长期维持SR的可能性更大[8]。本研究发现PAF患者不仅LA明显扩大,LA主动运动和变形功能也受到损害,心房肌舒张晚期运动速度、主动位移,主动位移和应变分数均显著降低。二尖瓣血流图上A峰速度虽有降低,但差异无统计学意义,提示组织速度和应变可能较二尖瓣血流图更加敏感。
恢复窦性心律可以逆转心房重构,但对于LA主动泵血功能是否得到改善,目前存在争议。有研究显示,AF电复律后71%的患者可发生LA顿抑,通常持续28 d后恢复到基础状态; 但也有报道复律6个月后心房功能仍存在不同程度的损害[9]。这些研究大多针对慢性AF,而PAF患者在导管消融术后心房主动功能的改变研究较少。射频消融术本身是否会对心房的功能产生影响也存在争议[9-11]。本研究显示:尽管PAF患者射频消融术后3个月LA即可缩小至正常,但LA主动收缩功能并未得到明显提高,术后6个月大多数反映LA泵血功能的指标仍低于正常,提示主动泵血功能异常持续存在,是否与射频消融损伤有关仍需要进一步研究。
由于AF初发大多隐匿,因此本研究未对既往发作情况进行量化和比较。AF患者常合并高血压、糖尿病、冠心病等基础疾病,尽管本研究选择的病例无明显心脏结构和LVEF异常,但无法排除上述疾病的早期阶段及其对心房肌功能可能造成的影响。尽管如此,本研究显示应变率成像技术可用于定量评价心房的运动和变形功能,对于孤立性的PAF患者,射频消融可有效地改善LA重构,但LA主动泵血功能的异常可能在术后长期存在,提示长期随访的必要。
[1]Fatema K,Barnes ME,Bailey KR,et al.Minimum vs.maximum left atrial volume for prediction of first atrial fibrillation or flutter in an elderly cohort:a prospective study [J].Eur J Echocardiogr,2009,10(2):282-286.
[2]Casaclang-Verzosa G,Barnes ME,Blume G,et al.C-reactive protein,left atrial volume,and atrial fibrillation:a prospective study in high-risk elderly [J].Echocardiogr,2010,27(4):394-399.
[3]Osranek M,Fatema K,Qaddoura F,et al.Left atrial volume predicts the risk of atrial fibrillation after cardiac surgery:a prospective study [J].J Am Coll Cardiol,2006,48(4):779-786.
[4]Donal E,Raud-Raynier P,Racaud A,et al.Quantitative regional analysis of left atrial function by Doppler tissue imagingderived parameters discriminates patients with posterior and anterior myocardial infarction [J].J Am Soc Echocardiogr,2005,18(1):32-38.
[5]Kosior DA,Szulc M,Opolski G,et al.Long-term sinus rhythm maintenance after cardioversion of persistent atrial fibrillation:is the treatment's success predictable? [J].Heart Vessels,2006,21(6):375-381.
[6]Inaba Y,Yuda S,Kobayashi N,et al.Strain rate imaging for noninvasive functional quantification of the left atrium:comparative studies in controls and patients with atrial fibrillation[J].J Am Soc Echocardiogr,2005,18(7):729-736.
[7]Kuppahally SS,Akoum N,Burgon NS,et al.Left atrial strain and strain rate in patients with paroxysmal and persistent atrial fibrillation:relationship to left atrial structural remodeling detected by delayed enhancement-MRI [J].Circ Cardiovasc Imaging,2010,3(3):231-239.
[8]Schneider C,Malisius R,Krause K,et al.Strain rate imaging for functional quantification of the left atrium:atrial deformation predicts the maintenance of sinus rhythm after catheter ablation of atrial fibrillation [J].Eur Heart J,2008,29(11):1397-1409.
[9]Thomas L,Thomas SP,Hoy M,et al.Comparison of left atrial volume and function after linear ablation and after cardioversion for chronic atrial fibrillation [J].Am J Cardiol,2004,93(2):165-170.
[10]Delgado V,Vidal B,Sitges M,et al.Fate of left atrial function as determined by real-time three-dimensional echocardiography study after radiofrequency catheter ablation for the treatment of atrial fibrillation [J].Am J Cardiol,2008,101(9):1285-1290.
[11]Verma A,Kilicaslan F,Adams JR,et al.Extensive ablation during pulmonary vein atrium isolation has no adverse impact on left atrial function:an echocardiography and cine computed tomography analysis [J].J Cardiovasc Electrophysiol,2006,17(7):741-746.

