不同小剂量阿司匹林对缺血性脑血管病患者血小板聚集功能的影响
彭乐 施春花 杜宁 魏辉平
(江西省人民医院 南昌330006)
阿司匹林(ASA)在缺血性脑血管病(ICVD)患者中应用很普遍,其作用的个体差异较大,而血小板聚集功能(PAG)检测可作为一简单的常规实验室方法来确定ASA剂量,从而最大限度地预防ICVD的发作。本文观察了ICVD患者服用不同小剂量ASA后PAG改变及其个体差异情况,并对ICVD患者的相关危险因素与PAG的关系进行了初步探讨。
1 资料与方法
1.1 对象及分组 病例组:ICVD患者197例,均符合1995年全国第四次脑血管病学术会议修订的标准[1],并经CT或MRI证实存在与临床相符的责任病灶。根据检测时服用ASA的剂量将其分为四组:(1)未服用ASA组52例,男36例,女16例,年龄50~81 岁,平均 66 岁;(2)ASA 50 mg·d-1组 46 例,男 34 例,女 12 例,年龄 48~79 岁,平均 65 岁;(3)ASA 75 mg·d-1组51例,男35例,女16例,年龄46~86 岁,平均 67 岁;(4)ASA 100 mg·d-1组 48 例,男37例,女11例,年龄45~90岁,平均64岁。各组检测前连续服用上述剂量ASA至少2周,均于晚餐后服用。近1个月内未服用其他影响血小板功能的药物。各组在年龄、性别及血小板计数方面的差异均无显著性。健康对照组:50例,男36例,女14例,年龄30~73岁,平均58岁。无心脑血管疾病、高血压病、糖尿病、高脂血症、周围血管疾病及出凝血性疾病,入选前1个月内未服用过影响血小板功能的药物。
1.2 血小板聚集功能测定 采用比浊法测定,分别以二磷酸腺苷(ADP,5μmol·L-1)、肾上腺素(EPN,5 μmol·L-1)、胶原 (COL,2 mg·L-1) 和花生四烯酸(AA,500 mg·L-1)为诱导剂,检测血小板最大聚集率(MAR)。仪器与试剂均为北京世帝科学仪器公司产品。
1.3 统计学处理 所得数据采用SPSS12.0 for Windows统计软件进行分析,结果用均数±标准差(±S)表示,采用非参数统计的Wilcoxon秩和检验,计数资料应用χ2检验,P<0.05为差异有显著性意义。
2 结果
2.1 不同剂量ASA使用4种诱导剂诱导的MAR及变异系数 见表1。各ASA组对AA和COL诱导聚集的变异系数较大。
表1 各组不同诱导剂诱导的MAR及其变异系数 (±S)%

表1 各组不同诱导剂诱导的MAR及其变异系数 (±S)%
组别 n 二磷酸腺苷 肾上腺素 胶原 花生四烯酸MAR 86.5±5.4 88.7±4.8 85.6±6.1 91.3±4.9健康对照组 50 变异系数 6.2 5.4 7.1 5.4 MAR 87.1±7.1 90.3±6.4 86.4±7.5 92.3±6.6未服ASA组 52 变异系数 8.2 7.1 8.7 7.2 MAR 67.3±19.3 62.6±28.5 43.8±34.8 36.7±34.8 ASA 50 mg·d-1组 46 变异系数 28.7 45.5 79.5 94.8 MAR 64.1±19.1 53.9±24.8 40.7±31.7 26.6±26.5 ASA 75 mg·d-1组 51 变异系数 29.8 46.0 77.9 99.6 MAR 59.3±17.3 43.3±20.4 36.5±25.8 17.4±17.1 ASA 100 mg·d-1组 48 变异系数 29.2 47.1 70.7 98.3
2.2 不同剂量ASA对AA诱导聚集的影响 服ASA后AA诱导的聚集呈显著抑制(MAR≤30%)或无显著抑制(MAR≥70%)。见表2。

表2 不同剂量ASA对AA诱导聚集的MAR结果 例(%)
2.3 危险因素分布 见表3。三种剂量ASA对AA诱导MAR≥70%组中糖尿病、高血压、冠心病的百分比均显著高于MAR<70%组。
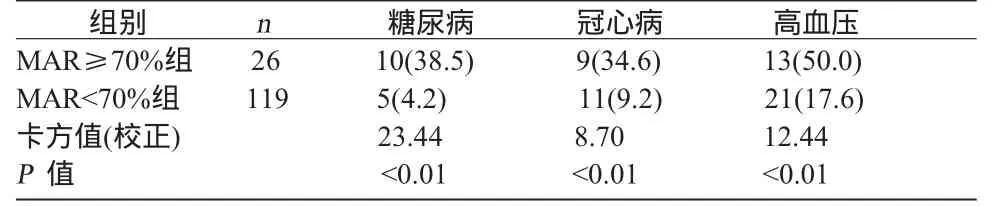
表3 服用ASA组中不同危险因素在AA聚集抑制情况中的分布 例(%)
3 讨论
阿司匹林的最佳剂量一直存在争议,众多临床试验的结果不能完全一致。争议的焦点是:是否应用大剂量的ASA即能达到更多的保护作用,但已知ASA对胃肠道的副作用如出血也呈剂量依赖性。在美国食品与药品管理局和美国胸科医师学院公布的脑卒中二级预防指南中,ASA的剂量为50~325 mg·d-1。本研究表明ASA对AA诱导血小板聚集显著抑制者在50 mg·d-1组为60.9%,75 mg·d-1组为 72.5%,100 mg·d-1组为 91.7%;对 AA 诱导聚集无显著抑制者的比例在小剂量时较多,50 mg·d-1组为30.4%(14/46),即未达到ASA抗栓机制上的基本作用。且ASA组对AA和COL诱导的MAR变异系数较大,说明ASA的个体差异较大。我们认为,由于存在个体差异,临床需要根据血小板聚集率的监测结果而决定用药剂量,力求用ASA的最小剂量而取得最好的抗血小板聚集作用。
缺血性脑血管疾病的血管病变最常见的是动脉粥样硬化和在此基础上发生的血栓形成。在动脉血栓形成中,血小板的作用是重要的。ASA可完全而持久地抑制血小板环氧化酶(COX),导致AA转化成血栓素A2(TXA2)的减少,抑制了TXA2依赖性血小板激活,为目前最明确的ASA抗栓作用的主要机制[2]。本研究发现,ASA组与未治疗组或健康对照组相比,对ADP、EPN、COL和AA诱导聚集的抑制均有显著性。其中对AA的抑制程度最大,对ADP的抑制程度最小,表明不同诱导剂对AA代谢的依赖程度不同,而AA代谢又有赖于COX的完整性。口服ASA后,因ADP诱导聚集主要是通过与ADP受体蛋白相结合,其过程仅部分涉及AA的代谢机制,故其诱导聚集受影响较轻;AA诱导的聚集则完全依赖于完整的COX和继发的TXA2的生成,故其诱导的聚集可被完全抑制[3]。因此AA诱导聚集的抑制在反映ASA的COX抑制作用上有较强的特异性;即或呈显著抑制(MAR≤30%),或无显著抑制(MAR≥70%)。基于ASA作用的机制,AA诱导聚集的显著抑制应为ASA达到其基本抗血小板作用的必要条件。
本研究还发现,ASA治疗组中合并糖尿病、冠心病、高血压病者对AA的聚集抑制差,表明个体差异与患者自身的危险因素相关。提示口服ASA后不完全的MAR除与ASA的剂量有关外,还与缺血危险性高的疾病相关。文献报道糖尿病、冠心病、高血压病患者的血小板黏附性和聚集性是增加的,其中血小板膜复合物生物物理状态的改变,可能是血小板高反应性和高功能性的决定性因素之一[4]。因此,对于部分合并糖尿病、冠心病、高血压病的患者可能需要更大一些的剂量。
[1]中华神经病学会,中华神经外科学会.各类脑血管疾病诊断要点[J].中华神经科杂志,1996,29(6):379-380
[2]Patrono C,Roth GJ.Aspirin in ischemic cerebrovascular disease:how strong is the case for a different dosing regimen[J].Stroke,1996,27:756-760
[3]Helgason CM,Tortorice KL,Winkler SR,et al.Aspirin response and failure in cerebral infarction[J].Stroke,1993,24:345-350
[4]Sobol AB,Watala C.The role of platelets in diabetes-related vascular complications[J].Diabetes Res Clin Pract,2000,50:1-16

