日本薯蓣脱毒培养及离体高效快繁体系的建立
解晓红,陈 丽,裴 蕾,李江辉,李 波,解红娥,武宗信
(山西省农业科学院棉花研究所,山西运城044000)
日本薯蓣(Rhizoma Dioscoreae)为薯蓣科植物,属多年生缠绕草本,我国除少数热带地区外,几乎各地都有种植。薯蓣块茎药用价值很高,被医学家称为“理虚之要药”,“滋补药中的上品”。《本草纲目》认为,薯蓣能“益肾气,健脾胃,止泻痢,化痰涎,润皮毛”。薯蓣营养价值丰富,富含粗蛋白、氨基酸、维生素、淀粉和糖等[1]。日本薯蓣外形粗壮,通体笔直,均匀美观,产量高,我国每年出口到日本、韩国的干、鲜货可达10万t以上,而且供不应求。但由于多年的传统种植,近年来日本薯蓣品种退化、病毒为害严重,表现症状为叶色失绿、花斑叶、叶畸形;地下块茎明显变小、畸形,产量下降,品质不高,严重时整株矮化,生长缓慢,甚至死亡。目前,大田中已发现的病毒有山药坏死花叶病毒(Chineseyam necroticmosaicvirus)、山药绿色斑驳病毒(Yam green-bandingvirus)、日本山药花叶病毒(Japanese yammasaic virus)、马铃薯Y病毒(Potato Virus Y)、马铃薯卷叶病毒(Potato leaf rollvirus)、马铃薯A病毒(Potato Virus A)、马铃薯 M病毒(Potato VirusM)、马铃薯 S病毒(Potato Virus S)和马铃薯X病毒(Potato Virus X)等[2-3]。目前,在无任何特效药剂防治病毒病的情况下,利用组织培养技术建立薯蓣脱毒培养和离体高效快繁技术体系,是日本薯蓣去除病毒、恢复种性、增加产量、提高品质的最佳途径[4-11]。
本研究通过组织培养手段对日本薯蓣进行脱毒及快繁技术研究。
1 材料和方法
1.1 供试材料
日本薯蓣植株由山西省闻喜县中药材种植基地提供。
1.2 试验方法
1.2.1 无菌苗的获得 切1 cm左右日本薯蓣茎段,用75%乙醇浸泡30 s,再用不同消毒剂消毒,筛选合适的消毒剂及用量。消毒茎段接种到MS附加不同激素培养基上进行培养,获取无菌苗。
1.2.2 茎尖培养 在无菌条件下,切取日本薯蓣无菌苗0.2~0.4mm茎尖,每个茎尖带2个叶原基,然后转入MS附加不同外源激素的培养基中进行培养。每瓶接种1个茎尖,接30瓶。90 d后统计结果。
1.2.3 电镜观测法检测脱毒茎尖苗 将待测茎尖苗汁液滴在覆膜铜网上制作样本,电镜观测到病毒质粒的为带毒苗。
1.2.4 多芽体诱导进行快繁 将茎尖形成的丛生小苗,切成带有1个腋芽的茎段,接种到培养基上。40 d后统计多芽体数和生长状况。
1.2.5 试管苗快繁培养 将多芽体切成单芽接种到培养基。40 d后统计苗高、叶片数、生根数。
1.2.6 试管苗移栽 薯蓣试管苗长至5~6片叶时进行移栽。
试验中,琼脂0.7%,pH值为6.0,光强2000~5000 lx,光照时间12h/d,培养温度(28±1)℃。
2 结果与分析
2.1 不同消毒剂对无菌苗培养的影响
取自大田的外植体含有大量的杂菌,消毒后接种才能长出无菌苗。设计不同用量和消毒时间,分别使用HgCl2和NaClO对来自大田的外植体进行消毒比较试验,结果(表1)表明,用0.1%HgCl2消毒6~8min效果好,污染率控制在20%以下,成活率达80%~90%;用0.1%HgCl2消毒时间超过10min时,因HgCl2杀伤力强,消毒后不易消除,容易杀伤植物组织,死亡率增大;用0.1%HgCl2消毒小于 6 min或用 0.05%HgCl2时,茎段苗成活率虽提高,但难以消除顽固性的杂菌,污染率会增加。用NaClO消毒,污染率较高,灭菌效果不理想。消毒好的日本薯蓣茎段苗接种到MS附加不同激素培养基上,可获得无菌苗。
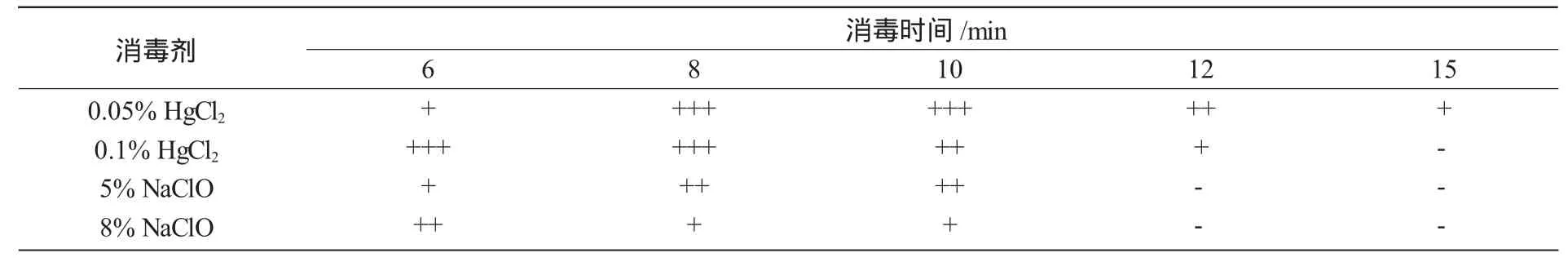
表1 消毒剂用量及消毒时间对茎段苗成活率的影响
2.2 不同外源激素对日本薯蓣茎尖存活率和芽分化的影响
选择生长健壮的薯蓣无菌苗,在4×10 X解剖镜下切取0.2~0.4mm茎尖,分别放入MS附加不同质量浓度6-BA,NAA,IBA培养基中,茎尖均能启动细胞分裂,5~7 d茎尖开始膨大变绿或脱分化形成半透明颗粒状愈伤组织,90 d后诱导出的愈伤组织再分化形成高约0.5 cm小苗(表2)。
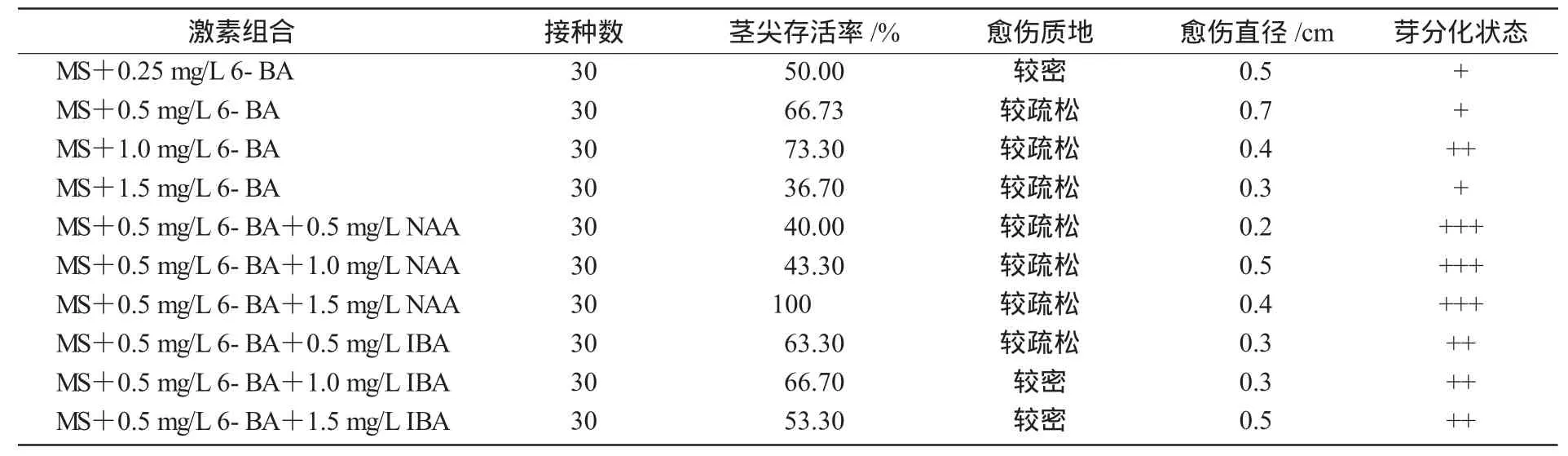
表2 不同外源激素对茎尖分化的影响
由表2可知,(1)单一6-BA就能诱导茎尖成苗,随6-BA质量浓度(0.25~1.0mg/L)增大,茎尖存活率和分化出芽数目增加,但较高质量浓度(1.5mg/L)反而不利于茎尖的成活和芽分化;(2)6-BA配合较高质量浓度的NAA有利于茎尖分化、长出多芽和有利于芽的生长,0.5mg/L 6-BA+1.5mg/LNAA成苗率达到 100%;(3)在6-BA质量浓度一定的情况下,添加不同质量浓度IBA,对茎尖成苗差异不明显,但分化出的芽生长较快,愈伤产生量较小。
2.3 电镜观测法检测脱毒茎尖苗
将待测茎尖苗汁液滴在覆膜铜网上制作样本,在电镜观测到病毒颗粒的为带毒苗。去除检测出的带毒苗,剩余的即为脱毒苗,用于进一步的脱毒快繁。如果茎尖苗的含病毒颗粒较多,可以再次在4×10X解剖镜下切取0.2~0.4mm茎尖,进行培养后检测。如此重复2~3次可以使脱毒的效果提高到90%以上。
2.4 不同激素配比对薯蓣茎段快繁多芽体形成的影响
将脱毒的茎尖苗切成带1个芽的茎段接种在不同培养基中,其均能分化成多芽或苗(表3)。
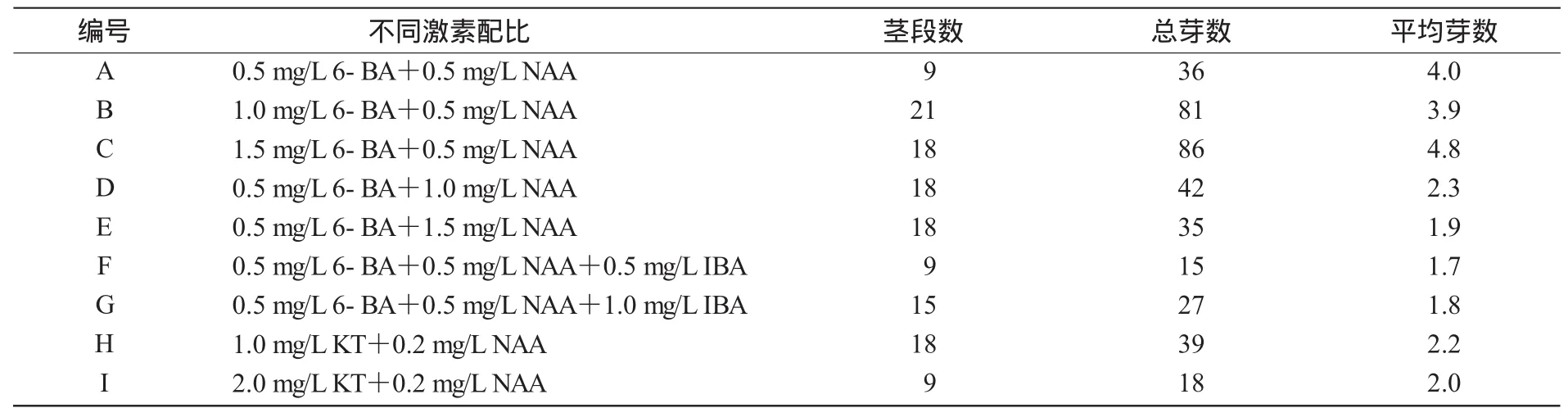
表3 不同激素配比对茎段快繁多芽体形成的影响
接种40 d后的统计结果表明,在茎段诱导多芽体形成过程中,6-BA起着主导作用。在NAA质量浓度一定的情况下,随6-BA浓度增加,多芽体形成增多,如A,B,C培养基中,芽体平均数由4个增加到4.8个,且芽体生长健壮。在6-BA质量浓度一定时,随NAA质量浓度增大,形成芽个体数减少,且芽偏白,不利于后期生长。如A,D,E培养基中,芽体平均数由4.0个降至1.9个。在MS+1.5mg/L 6-BA+0.5mg/LNAA中,形成的多芽体数最多,达到4.8个,芽体呈绿色,芽体高2~4 cm;在MS+2.0mg/LKT+0.2 mg/LNAA中,芽体的分化率虽比较低,但芽体大,苗壮。在MS+0.5mg/L 6-BA+0.5mg/LNAA基础上添加IBA对诱导薯蓣多芽体形成没有太大影响。结果表明,日本薯蓣茎段快繁多芽体诱导以MS+1.5mg/L 6-BA+0.5mg/LNAA为佳,繁殖系数大,芽分化和生长状态良好。
2.5 不同激素配比对薯蓣试管苗生根和生长的影响
将多芽体切成单芽,接种到生根培养基中,40 d后,所有培养基均长出嫩茎,并长出新叶,但能生根且生长势强的只有2种培养基。在试管苗生长过程中,较低质量浓度的NAA明显能促进生根;6-BA和NAA组合对丛生芽的形成和生长有利,而对生根的效果不明显,且极易促进愈伤的形成,其中6-BA的存在明显促进了芽的生长和分化;KT和NAA组合培养基中芽分化较少,但试管苗生长较好,且生根效果明显;KT/NAA的比值越大,试管苗长势越壮,根系发育越好,最终选择MS+2.0mg/L KT+0.02mg/LNAA的效果最好;MS+1.0mg/LKT+0.2mg/LNAA虽然生根条数最多,但试管苗长势不好(表4)。消毒大田茎段产生无菌苗也是接种到这2种培养基上效果较好。
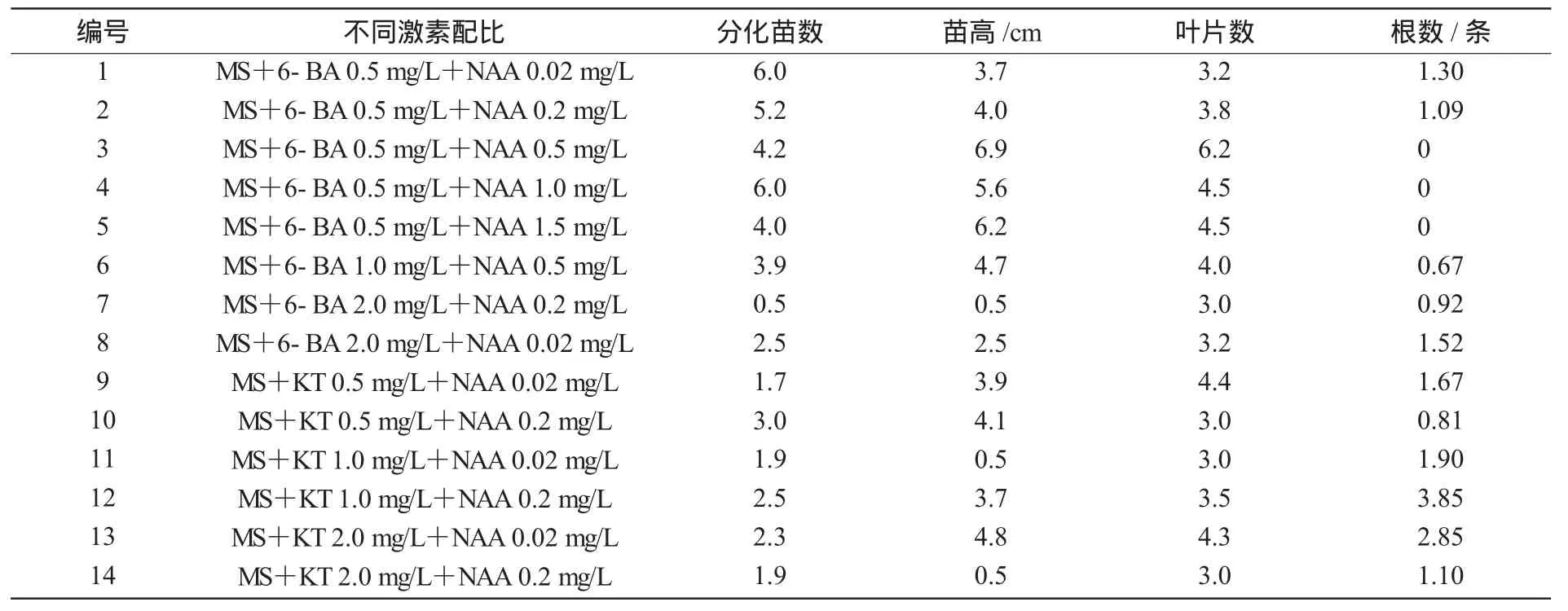
表4 不同激素配比对试管苗生长和生根影响
2.6日本薯蓣试管苗的移栽
当薯蓣试管苗长至5~6片叶时进行移栽,在培养间28℃左右的条件下,打开瓶盖,逐渐降低湿度,进行炼苗,2~3 d后洗净试管苗根部培养基,移栽到装有沙、蛭石、泥炭土混合基质的营养钵或移栽盘中,用800~1 000倍移栽液浇灌,并采取适当的保湿措施,移栽成活率达85.5%。同时,移栽时期以春、秋、冬三季为好,植株成活率高;夏季由于高温高湿,细菌繁殖速度较快,容易造成污染,移栽成活率降低。
3 结论和讨论
本研究得出,标准的脱毒快繁程序为:消毒的茎段在培养上产生无菌苗,切取无菌苗0.2~0.4 mm茎尖接种到MS+0.5 mg/L 6-BA+1.5 mg/LNAA,进行病毒检测并剔除带毒茎尖苗,脱毒茎段接种到MS+1.5 mg/L 6-BA+0.5 mg/L NAA进行诱导多芽体快繁,多芽体分割成单芽在MS+2.0mg/LKT+0.02mg/LNAA上进行诱根和生长,生根的再生植株移栽到大田。
本试验只是确定了脱毒的流程,获得了移栽到大田的脱毒植株,在生产上的应用和表现以及推广工作还有待于进一步研究。
[1] 陈宝儿,陈丙銮.地黄山药高效种植[M].郑州:中原农民出版社,2003:69-77.
[2] 曾军,兰志斌,张志勇,等.闽西山药病毒种类的检测初报[J].武夷科学,2003,12(19):176-178.
[3] 李明军,郑峰,陈明霞,等.怀山药病毒病的研究[J].中草药,2003,34(11):3-5.
[4] 武宗信,解红娥,冯文龙,等.地黄脱毒技术研究[J].中药材,2002,25(6):383-384.
[5] 胡选萍,张晓娟.山药离体脱毒技术探讨[J].安徽农业科学,2008,36(34):14896-14897.
[6] 南怀林,刘建平,王耀琴.山药茎尖繁殖技术的研究[J].作物杂志,2005(6):34-36.
[7] 蔡建荣,曾军,张志勇,等.怀山药茎段组织培养的研究[J].湖北农业科学,2002(1):61-62.
[8] 李明军,刘萍,张嘉宝,等.怀山药微型块茎的离体诱导[J].植物生理学通讯,2000,36(1):41.
[9] 解晓红,李江辉,冯文龙,等.脱毒地黄低成本快繁技术探讨[J].山西农业科学,2004,32(1):49-51.
[10] 张寒霜,赵俊丽,李伟明,等.大蒜茎尖脱毒培养及快繁技术研究[J].华北农学报,2006,21(增刊):117-119.
[11] 王红娟,王天亮,白自伟,等.激素配比对怀山药不同外植体诱导不定芽的影响[J].河南农业科学,2006(12):73-74.

