肠易激综合征大鼠骶髓后角中NMDAR、CGRP表达以及小胶质细胞的变化
崔曼莉, 王景杰, 秦 明, 王旭霞, 杨 琦, 黄裕新 (第四军医大学唐都医院消化内科, 西安710038;通讯作者,E-mail:jingjie@fmmu.edu.cn)
肠易激综合征(irritable bowel syndrome,IBS)是一组以腹痛或腹部不适同时伴有排便习惯及大便性状改变为主要症状的肠道功能性疾病。目前内脏高敏感性被认为是肠易激综合征重要的病理生理机制之一。
通过中枢致敏和由于慢性或反复的内脏刺激引起脊髓背角神经元的生长,使中枢感觉兴奋性增加,从而放大传入中枢神经系统的信号量。研究表明肠道神经系统、中枢神经系统中神经递质(SP、VIP、CGRP、GABA、NO、Ach、NE 等)在IBS 的肠道、脊髓、丘脑中都有改变[1]。慢性内脏痛IBS模型存在外周和中枢敏化机制[2,3],并且其中枢敏化作用可被NMDAR 拮抗剂脊髓给药所阻断[4,5]。另有研究者报道了外周神经损伤可以产生放大的疼痛反应,同时激活了脊髓神经胶质细胞,进一步采用N-甲基-D-天冬氨酸受体(NMDAR)拮抗剂MK801可以抑制产生的痛觉过敏和异常疼痛,同时也抑制了神经胶质细胞。提示胶质细胞激活对病理性痛的产生和维持非常必要[6]。本实验室前期研究提示[7-9],当单纯电针刺激足三里穴位时,调节胃肠运动的神经中枢中的GFAP和OX42的表达明显增高,提示神经胶质细胞被显著激活。给予胶质细胞代谢阻断剂丙戊茶碱(PPF)干预和等量生理盐水对照,发现OX42的表达有显著性的降低。说明OX42表达量的多少反映出小胶质细胞活化程度。
所以,研究IBS发病的神经作用机制,对于临床治疗有着重要意义。本实验通过电生理学和免疫组织化学以及免疫荧光化学方法,在以旋毛虫感染大鼠成功制作IBS大鼠模型基础上,采用直肠气囊充水造成压力感受刺激的方法,研究直肠扩张刺激对IBS大鼠腹直肌肌电的影响和因扩张刺激造成的内脏性疼痛导致IBS大鼠出现的骶髓后联合核中NMDAR和CGRP表达的改变,为研究其发病机制提供理论依据。
1 材料与方法
1.1 主要实验材料及试剂 保虫昆明鼠种鼠(旋毛虫系云黑龙江株)购自河南省疾病预防控制中心,实验大鼠购自第四军医大学实验动物中心,为雄性SD大鼠。兔抗大鼠CGRP单克隆抗体、兔抗大鼠NMDAR单克隆抗体、羊抗兔Texas red均购自于美国Sigma公司;小鼠抗大鼠OX42单克隆抗体购自于Chemical公司;驴抗小鼠FITC购自美国Molecular Probes公司。
1.2 IBS动物模型制作 ①旋毛虫幼虫制备及传代由河南省疾病预防控制中心提供的保虫昆明鼠种鼠(旋毛虫系云黑龙江株)共3只,脊髓脱臼法处死后剔除皮毛及内脏,剔取肌肉。将肌肉剪碎置于300 ml 2.5%胃蛋白酶和0.5%盐酸消化液中,置37℃水浴中消化12-20 h。经筛过滤,滤液用生理盐水反复沉淀洗涤3-5次,收集旋毛虫幼虫胞囊并计数。取昆明鼠20只,25 g左右,灌胃法给予0.1 ml含250-300条幼虫的生理盐水悬液。②感染大鼠后将传代感染的昆明鼠以颈椎脱臼法处死收集旋毛虫(方法同前)。③实验组大鼠灌胃法给予1 ml含4 000条幼虫囊胞的生理盐水悬液。被感染鼠饲养8周,抽检测定感染情况,确立模型是否制作成功[10]。
1.3 实验分组 选取10只建模成功大鼠随机分为2组:IBS未刺激组和IBS结肠扩张刺激组。另选5只正常大鼠做为正常对照组。
1.4 腹直肌肌电的测量 各实验组大鼠均测量腹直肌肌电。电极置于大鼠腹中线两侧、电极间距3-4 cm,采用RM6280B生物信号采集处理软件记录和分析腹壁肌电活动(成都仪器厂生产)。记录安静无刺激状态下腹直肌放电幅值,维持30 s。间期休息5 min后,对IBS刺激组进行结肠扩张刺激。将气囊缓慢插入大鼠直肠,进入到结肠距离肛门35 mm处固定,记录给予直肠刺激后腹直肌放电幅值,维持30 s。休息5 min后再应用注射器给气囊注入1.0 ml蒸馏水[11]。再次记录给予肠道压力后腹直肌放电幅值。电生理记录仪参数设置:采集频率40 kHz,扫描速度 200 ms/div,灵敏度 500 μV,时间常数 0.001 s,滤波频率 3 kHz。
1.5 切片制备 测量腹直肌肌电后,将各组大鼠于戊巴比妥钠(40 mg/kg)麻醉下,开胸经左心室至升主动脉插管,先以100 ml生理盐水冲洗血液,随后用冷的(4℃)含40 g/L多聚甲醛0.1 mol/L磷酸盐缓冲液(PB,pH7.4)先快后慢灌流固定2 h,取脑组织置于300 g/L蔗糖中(4℃)直至组织沉底,冰冻切片机以延髓做冷冻连续冠状切片,片厚30 μm,切片分套。另外取正常组以及IBS未刺激组大鼠结肠做冰冻切片,片厚10 μm。
1.6 HE染色 取正常对照组以及IBS未刺激组大鼠结肠切片做常规HE染色,中性树脂封片后于光镜下观察二者之间大体结构变化。
1.7 免疫荧光化学标记 取3套切片在0.01 mol/L PBS中漂洗后,入含 0.3%Triton X -100的 0.01 mol/L PBS中浸泡30 min(室温)。然后进行免疫组织化学荧光染色:①3套切片分别入兔抗鼠CGRP单克隆抗体稀释液(1∶500)、兔抗鼠NMDAR单克隆抗体稀释液(1∶500)和小鼠抗OX42单克隆抗体稀释液(1∶300)孵育24 h(室温);②加入结合了荧光素的二抗:其中2套切片加入羊抗兔 Texas red(1∶500)单染CGRP和NMDAR,另一套切片加入驴抗小鼠FITC(1∶500)单染 OX42,避光孵育2 h(室温)。0.01 mol/L PBS洗3次后,80%甘油封片后,将各组的切片各取10张,在confocal激光共聚焦显微镜下观察并采集图像,采用Image J图像分析软件,分析CGRP、NMDAR以及OX42的A值。
2 结果
2.1 正常大鼠与IBS大鼠结肠组织的比较 实验结果显示:正常大鼠的结肠结构完整,腺体组织间隙仅见少许红细胞浸润。IBS大鼠结肠组织切片显示,肠腺体结构完整,组织间隙可见少许红细胞浸润,还可见少许中性粒细胞的浸润,但是未见有显著的淋巴结小结的集落形成(见图1)。
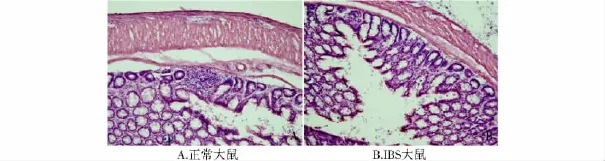
图1 经旋毛虫感染的IBS模型大鼠与正常大鼠结肠组织对比(HE染色,×200)Fig 1 Histology of colon in IBS rats and normal rats(HE,×200)
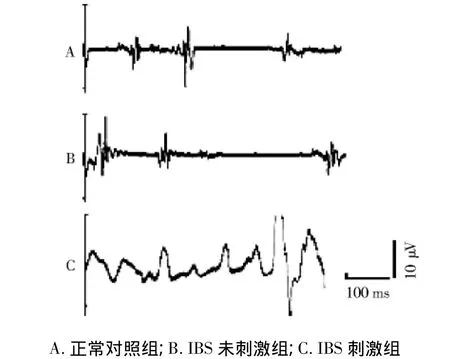
图2 结肠扩张刺激对IBS大鼠腹直肌肌电活动的影响Fig 2 Effect of colon distension on the electro-activity of rectus abdominis in IBS rats
2.2 结肠扩张刺激致IBS大鼠腹直肌肌电的变化本实验结果显示,正常对照组和IBS未刺激组大鼠腹直肌肌电频率的变化较为规律(见图2),二者间比较无统计学差异(P>0.05,见表1)。而给予IBS大鼠以疼痛反应高峰刺激(前期实验测定)后,IBS大鼠腹直肌肌电的频率和波幅产生显著性变化(图2C),与正常对照组和IBS未刺激组大鼠相比差异显著(P <0.05,见表1)。
表1 结肠扩张刺激对大鼠腹直肌肌电的影响(n=5,±s)Tab 1 Electro-activity of the rectus abdominis in 3 groups(n=5,±s)

表1 结肠扩张刺激对大鼠腹直肌肌电的影响(n=5,±s)Tab 1 Electro-activity of the rectus abdominis in 3 groups(n=5,±s)
与正常对照组和IBS未刺激组比较,*P<0.05
?
2.3 结肠扩张刺激引起 IBS大鼠骶髓后角中NMDAR、CGRP以及DCN中小胶质细胞的变化 实验结果显示,正常对照大鼠骶髓后角中NMDAR表达处于一定水平,而IBS大鼠在未给予结肠扩张刺激情况下,其NMDAR的表达水平未见有显著性变化,其荧光光度值未见明显差异(P>0.05,见表2,图3)。在给予IBS大鼠以疼痛行为学高峰值刺激的情况下,IBS大鼠骶髓后角中NMDAR的表达显著性升高,与正常对照组和IBS未刺激组相比存在统计学差异(P <0.01或 P <0.05,见图 3,表2)。另外,CGRP在IBS大鼠骶髓后角中的表达状况与NMDAR的表达情况基本相似(见图4,表2)。我们前期实验已经验证,正常大鼠骶髓DCN中的小胶质细胞活化情况与IBS大鼠的情况相似,二者相比未见统计学差异[10,11]。本研究显示,在给予 IBS大鼠以结肠扩张性刺激的情况下,其DCN中的小胶质细胞的活化情况与未刺激情况相比,二者荧光光度值差异统计学意义(P<0.01,见图5,表2)。
表2 结肠扩张刺激对IBS大鼠骶髓后角中NMDAR、CGRP、OX42表达的影响(A值,n=5,±s)Tab 2Expression of NMDAR,CGRP,OX42 in 3 groups(A value,n=5,±s)

表2 结肠扩张刺激对IBS大鼠骶髓后角中NMDAR、CGRP、OX42表达的影响(A值,n=5,±s)Tab 2Expression of NMDAR,CGRP,OX42 in 3 groups(A value,n=5,±s)
与正常对照组比较,*P<0.01;与IBS未刺激组比较,#P<0.05
?

图3 结肠扩张刺激对IBS大鼠骶髓后角中NMDAR表达的影响(Bar=100 μm)Fig 3 Effect of colon distension on NMDAR expression in sacral dorsal horn of IBS rats(Bar=100 μm)

图4 结肠扩张刺激对IBS大鼠骶髓后角中CGRP表达的影响(Bar=100 μm)Fig 4 Effect of colon distension on CGRP expression in sacral dorsal horn of IBS rats(Bar=100 μm)

图5 结肠扩张刺激对IBS大鼠骶髓DCN中小胶质细胞激活的影响(Bar=100 μm)Fig 5 Effect of colon distension on the activation of microglia cells in DCN of IBS rats(Bar=100 μm)
3 讨论
肠易激综合征的发病机制尚不清楚。已知的一些因素包括肠道动力和肠平滑肌功能障碍、精神心理异常、内脏感觉异常、植物神经功能紊乱、胃肠激素分泌异常、脑-肠轴学说、应激、肠道感染等[12]。内脏高敏感性被认为是IBS重要的病理生理机制。有研究表明IBS患者对肠道气囊扩张的疼痛阈值降低[13]、疼痛强度增加(内脏高敏感),或导致正常的肠道功能状态的敏感性增高(即异常性疼痛),甚至内脏相对应的躯体牵涉痛的范围扩大。脊髓背角作为脑-肠轴的“中继站”,是内脏敏感性调节的关键部位。各种神经纤维组成了脊髓节段性调质的神经网络。对IBS患者的伤害性屈曲反射研究表明,IBS患者脊髓存在着超兴奋性[14]。有研究者研究发现,结肠炎症性的变化可以引起内脏敏感性增高,并观察到脊髓后角中NMDAR中的NMDAR1和NMDAR2/B阳性细胞分布相同,并主要分布在后角深层和中央管背侧的后联合核(DCN)。提示它们的表达变化是结肠的炎症性刺激通过内脏传入神经传导到脊髓的结果。
本研究表明,脊髓背角内NMDAR阳性数显著升高,提示结肠刺激痛可以使NMDAR的阳性表达数升高。给予大鼠的结肠刺激痛能引起伴有外周与中枢敏化的长期功能性内脏超敏反应,脊髓给予NMDAR受体拮抗剂能阻断这种功能性慢性结直肠痛觉过敏,提示体内NMDAR可能参与介导IBS样功能性慢性内脏痛敏。NMDA受体是由 NR1和NR2亚单元组成的离子通道蛋白,是中枢神经系统中兴奋性递质谷氨酸受体的一种类型,属于离子型受体[15]。已被证明在“wind-up”现象(重复刺激 C纤维引起的放电增强)与学习记忆有关的长时程增强、外周感受阈的扩大、中枢过度兴奋以及热敏过程中发挥重大作用[16,17]。Ma 等[18]研究提示 NR2B 蛋白由背根神经节(dorsa root ganglion,DRG)神经元合成,其分布于伤害性初级传入纤维中枢端,即脊髓背角Ⅰ层的突触前膜。DRG神经元外周突末梢接受伤害性刺激,终止在脊髓背角浅层的中枢突末梢,释放神经递质(如谷氨酸、SP、天冬氨酸)和降钙素基因相关肽(calcitonin gene-related peptide,CGRP)等,激活脊髓背角特异性伤害性感受神经元,传递痛觉冲动[19]。Petralia等[20]的研究发现大鼠 DRG 神经元有 NR1的表达,Soliman等[21]也指出 70%的DRG中枢突末梢中同时存在着NR1和谷氨酸。而Ma等[18]研究发现,70%的C纤维和Aδ纤维传入末梢表达NR2B,表明突触前膜的NMDA受体以NR2B型为主。由此推测NR2B在脊髓水平痛觉信息传递中可能起到重要作用。在辣椒素诱导的机械性和热痛敏中,鞘内注射NMDA受体非竞争性拮抗剂MK-801可以明显减轻机械性痛敏和热痛敏[21,22]。肌肉注射NMDA受体竞争性拮抗剂AP-5可以剂量依赖地减弱完全弗氏佐剂(CFA)诱导的肌肉痛觉过敏[23]。由此表明,NMDA受体的激活在痛敏的产生和维持中发挥着重要的作用。
CGRP是一种含有37个氨基酸残基的多肽,广泛分布于中枢和外周神经系统,特别是感觉神经元胞体和末梢以及胃肠道壁内神经丛,具有调节胃肠血流、胃肠分泌及运动功能[24]。从内脏传入神经的外周末梢释放的CGRP曾被认为在内脏痛觉过敏的外周机制中发挥了重要作用[25]。大脑的神经系统调节异常对IBS的肠道敏感性增高有重要的促进作用[12]。研究发现[26],IBS 患者肠黏膜内肥大细胞周围CGRP等阳性神经纤维表达增强,而且在神经肽周围,肥大细胞的数量明显增多。Gschossmann等[27]发现,在鞘内注射 CGRP受 体 拮 抗 剂(h-CGRP8-37)可呈剂量依赖性地减少反复扩张结肠导致的内脏痛觉过敏引起的腹部肌肉收缩的次数。脊髓蛛网膜下隙注射CGRP可使痛阈降低,且CGRP可通过促进P物质(SP)释放而有利于痛觉的传递,可见CGRP与痛觉信号传递密切相关[28]。
另外,小胶质细胞在内脏痛的“启动”中可能占有重要地位。有研究报道了外周神经损伤产生放大的疼痛反应,同时激活了脊髓神经胶质细胞,给予NMDAR拮抗剂MK801可以抑制产生的痛觉过敏和异常疼痛,同时也抑制了神经胶质细胞。提示胶质细胞激活对病理性痛的产生和维持非常必要[2]。本研究发现给予IBS大鼠结肠扩张刺激后,大鼠骶髓DCN中的小胶质细胞的活化显著增高,与NMDAR以及CGRP的增高程度呈现相对应上升关系,故此推测,疼痛活性物质与小胶质细胞在内脏痛以及内脏敏化反应中可能共同参与在其中,但具体神经机制尚未阐明。故阐明IBS疼痛神经机制在指导日后IBS临床治疗具有举足轻重的作用。
[1] Barbara G,De Giorgio R,Stanghellini V,et al.A role for inflammation in irritable bowel syndrome [J]?Gut,2002,51(Suppl 1):i41-i44.
[2] Lin C,Al-Chaer ED.Long-term sensitization of primary afferents in adult rats exposed to neonatal colon pain[J].Brain Res,2003,971(1):73-82.
[3] Lin C,Al-ChaerE D.Differential effects of glutamate receptor antagonists on dorsal horn neurons responding to colorectal distension in a neonatal colon irritation rat model[J].World J Gastroenterol,2005,11(41):6445 -6450.
[4] 林国威,林春,郑伟.脊髓NMDA受体在慢性内脏高敏大鼠中作用研究Ⅰ[J].中国药理学通报,2007,23(10):1342-1345.
[5] 林春,林国威,郑伟,等.NMDA受体NR2B亚单位在慢性内脏痛觉敏化中的作用[J].中国药理学通报,2008,24(8):1015-1018.
[6] 孙怡宁,罗金燕,商澎,等.脊髓背角N-甲基-D-天冬氨酸受体在结肠炎大鼠内脏高敏感性中的作用[J].中南大学学报:医学版,2005,30(5):123 -126.
[7] 夏德雨,王景杰,陆松鹤,等.直肠扩张刺激引起IBS大鼠痛行为学以及骶髓DCN中神经元和胶质细胞的变化[J].胃肠病学和肝病学杂志,2007,16(6):589 -593.
[8] 王景杰,王胜智,夏德雨,等.结肠扩张刺激对P2X4受体在IBS大鼠神经中枢中表达的影响[J].胃肠病学和肝病学杂志,2008,17(10):813 -817.
[9] 黄裕新,王景杰,王胜智,等.胶质细胞参与电针足三里对胃运动的调节作用[J].山西医科大学学报,2007,38(10):886-889.
[10] 夏德雨,王景杰,颜云龙,等.直肠扩张刺激引起IBS大鼠痛行为学以及腹肌电活动的变化[J].胃肠病学和肝病学杂志,2007,16(3):260 -263.
[11] 黄裕新,王景杰,姜惠玲,等.大鼠结肠扩张性刺激引起内脏活动变化的实验研究[J].胃肠病学和肝病学杂志,2006,4(2):119-122.
[12] Drossman DA.The functional gastrointestinal disorders and the Rome Ⅲ process[J].Gastroenterology,2006,130(5):1377 -1390.
[13] 孙刚,杨云生,彭丽华,等.肠易激综合征大鼠内脏敏感性和脊髓背角5-HT和 c-fos的表达[J].世界华人消化杂志,2007,15(25):2718 -2722.
[14] Coffin B,Bouhassira D,Sabate JM,et al.Alteration of the spinal modulation of nociceptive processing in patients with irritable bowel syndrome[J].Gut,2004,53(10):1465 - 1470.
[15] 彭艳,易受乡,李振海,等.毫针不同刺激强度对胃扩张疼痛大鼠脊髓背角NMDA受体和P物质的影响[J].世界华人消化杂志,2009,17(13):1339 -1345.
[16] Kolhekar R,Meller ST,Gebhart GF.Characterization of the role of spinal N-methyl-D-aspartate receptors in thermal nociception in the rat[J].Neuroscience,1993,57(2):385 -395.
[17] 王永洪,孙兰云,张励才,等.内脏痛觉过敏及其中枢敏感化[J].国际麻醉学与复苏杂志,2006,27(4):246 -248.
[18] Ma QP,Hargreaves RJ.Localization of N-methyl-D-aspartate NR2Bsubunits on primary sensory neurons that give rise to smallcaliber sciatic nerve fibers in rats[J].Neuroscience,2000,101(3):699-707.
[19] Zhuo M.Glutamate receptors and persistent pain:targeting forebrain NR2B subunits[J].Drug Discov Today,2002,7(4):259-267.
[20] Petralia RS,Wang YX,Wenthold RJ.The NMDA receptor subunits NR2A and NR2B show histological and ultrastructural localization patterns similar to those of NR1[J].J Neurosci,1994,14:6102-6120.
[21] Soliman AC,Yu JS,Coderre TJ.mGlu and NMDA receptor contributions to capsaicin induced thermal and mechanical hypersensitivity[J].Neuropharmacology,2005,48(3):325 - 332.
[22] 陈菲,方步武.NMDA受体在痛觉过敏中的作用[J].生命科学,2006,18(1):51 -54.
[23] Ro JY,Nies M,Zhang YP.The role of peripheral N-methyl-D-aspartate receptors in muscle hyperalgesia[J].Neuroreport,2005,16(5):485-489.
[24] 牛庆慧,张翠萍,鞠辉,等.肠道黏膜肥大细胞和降钙素基因相关肽在肠易激综合征中的表达[J].世界华人消化杂志,2009,17(2):213 -217.
[25] Disebastiano P,Friess HD,Miola FF,et al.Mechanisms of pain in chronic pancreatitis[J].Ann Ital Chir,2000,71(1):11 -16.
[26] 王利华,方秀才,潘国宗.肠易激综合征患者肠黏膜肥大细胞与神经纤维的关联[J].中华消化杂志,2003,23(6):332-335.
[27] Gschossmann JM,Coutinho SV,Miller JC,et al.Involvement of spinal calcitonin gene-related peptide in the development of acute visceral hyperalgesia in the rat[J].Neurogastroenterol Moti,2001,13(3):229 -236.
[28] Christensen MD,Hulsebosch CE.Spinal cord injury and anti-NGF treatment results in changes in CGRP density and distribution in the dorsal horn in the rat[J].Exp Neurol,1997,147(2):463 -475.

