替米沙坦防治糖尿病大鼠血管内皮损伤的实验研究
吴仕平,陈明
糖尿病是冠状动脉粥样硬化性心脏病(冠心病)等危症[1]。糖尿病大血管病变是2型糖尿病(type 2 diabetes mellitus,T2DM)远期并发症和主要死亡原因。血管内皮损伤已经公认为糖尿病患者动脉粥样硬化的始动环节[2],寻找血管内皮损伤的治疗措施,在心血管疾病的防治上将起着重要作用。血管紧张素Ⅱ受体拮抗剂(ARB)对动脉粥样硬化的防治作用是近年来的研究热点。替米沙坦结构独特,除阻断血管紧张素Ⅱ1型受体(AT1)外,还可使过氧化物酶体增殖物活化受体γ(Peroxisome Proliferator-activated receptor γ,PPARγ)激活[3],在动脉粥样硬化的防治方面,可能有其“独特”作用。本实验用替米沙坦干预糖尿病大鼠,观察其对血管内皮细胞形态、功能的影响,探讨其防治血管内皮损伤的可能机制,为临床更好地防治糖尿病及其大血管病变提供实验依据。
1 材料与方法
1.1 材料 雄性SD大鼠由重庆医科大学动物中心提供,链脲佐菌素购自sigma公司,替米沙坦由勃林格殷格翰公司惠赠,总胆固醇(TC)测定试剂盒购自上海荣盛生物技术有限公司,高密度脂蛋白胆固醇(HDL-C)测定试剂盒购自柏定生物工程(北京)有限公司,低密度脂蛋白胆固醇(LDL-C)测定试剂盒购自浙江东瓯生物工程有限公司,甘油三脂(TG)测定试剂盒购自北京中衫金桥技术生物有限公司,过氧化氢酶(CAT)测定试剂盒、丙二醛(MDA)测定试剂盒以及一氧化氮(NO)测定试剂盒南京建成生物工程研究所,葡萄糖(Glu)测定试剂盒购自上海荣盛生物技术有限公司,Hitachi-7500透射电镜(日本日立公司)。
1.2 方法
1.2.1 建立动物模型 采用实验性T2DM大鼠模型的建立方法:雄性SD大鼠喂以高脂、高糖饲料。4周后,大鼠禁食12 h,以低剂量链脲佐菌素(STZ:30 mg/kg,临用时溶于 pH4.5、浓度0.1 mmol/L 的枸橼酸-枸橼酸钠缓冲液中)单次腹腔注射,72 h后,断尾采血测血糖值,以血糖高于16.7 mmol/L作为糖尿病成模标准。
1.2.2 分组及干预 30只大鼠分为3组:正常对照组(n=10)、糖尿病对照组、(n=10),替米沙坦组(n=10),药物经灌饲法喂给,替米沙坦组给予替米沙坦6.5 mg/(kg.d)灌饲,正常对照组及糖尿病对照组给予等量蒸馏水模拟灌饲,干预时间为8周。
1.2.3 动物血压测定 采用尾部套囊血压分析器测量大鼠收缩压:将清醒状态大鼠置于38℃恒温箱中预热10 min,然后将大鼠固定于测量箱中,待其安静后以RBP-1型大鼠尾动脉血压计测量大鼠尾部收缩压。
1.2.4 标本采集 干预结束后,用3%水合氯醛腹腔注射麻醉大鼠,开胸取血处死大鼠,离心、分离血清,低温冰箱保存备用。摘取主动脉,各组随机选取一个标本立即放入2%戊二醛溶液中固定,送电镜室作透射电镜检查。
1.2.5 指标的检测 血清Glu测定采用葡萄糖氧化酶法,TC测定采用 CHOD-PAP法,TG测定采用GPO-PAP法,HDL-C测定采用直接法,LDL-C测定采用PVS沉淀法,血清一氧化氮(NO)测定采用硝酸还原酶法,CAT测定采用可见光法,MDA测定采用硫代巴比妥酸(TBA)法,以上操作均严格按照试剂盒说明书进行。在Hitachi-7500透射电镜下观察血管内皮细胞的形态。
1.2.6 统计学处理 采用SPSS 13.0软件处理,数据以均数±标准差(±s)表示,多组间差异采用方差分析,组间比较用q检验,P<0.05为差异有统计学意义。
2 结果
2.1 血压、血糖的比较 8周后,与正常对照组比较,糖尿病对照组血压和血糖均较正常组明显升高(P<0.01);与糖尿病对照组比较,替米沙坦组收缩压和血糖均降低(P<0.01)(表1)。
2.2 血脂的比较 干预8周后,与正常对照组比较,糖尿病对照组TC、TG、LDL-C均显著高于正常对照组而HDL-C则明显低于正常对照组(P<0.01);与糖尿病对照组比较,替米沙坦组TC、TG、LDL-C显著降低、HDL-C 显著升高(P <0.05或0.01)(表1)。
2.3 过氧化氢酶(CAT)、丙二醛(MDA)的比较 干预8周后,与正常对照组比较,糖尿病对照组CAT明显低于正常对照组(P<0.01),而MDA则显著高于正常组(P<0.01);与糖尿病对照组比较,替米沙坦组CAT明显升高而MDA则显著降低(P均<0.01)(表2)。
2.4 血清一氧化氮(NO)含量的比较 干预8周后,与正常对照组比较,糖尿病对照组大鼠血清NO水平明显低于正常对照组(P<0.01);与糖尿病对照组比较,替米沙坦组血清NO水平显著升高(P<0.05)(表2)。
表1 三组大鼠收缩压、血糖和血脂水平(±s)
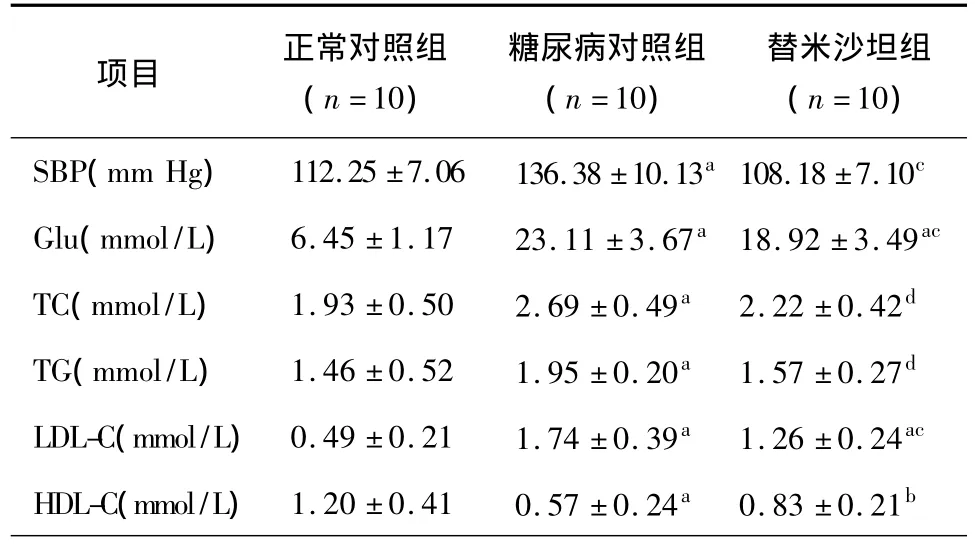
表1 三组大鼠收缩压、血糖和血脂水平(±s)
注:SBP:收缩压;Glu:血糖;TC:总胆固醇;TG:甘油三酯;LDL-C:低密度脂蛋白胆固醇;HDL-C:高密度脂蛋白胆固醇;与正常对照组比较,aP <0.01,bP <0.05;与糖尿病对照组比较,cP <0.01,dP <0.05;1 mm Hg=0.133 kPa
项目 正常对照组(n=10)糖尿病对照组(n=10)替米沙坦组(n=10)SBP(mm Hg) 112.25 ±7.06 136.38 ±10.13a108.18 ±7.10c Glu(mmol/L) 6.45 ±1.17 23.11 ±3.67a18.92 ±3.49ac TC(mmol/L) 1.93 ±0.50 2.69 ±0.49a 2.22 ±0.42d TG(mmol/L) 1.46 ±0.52 1.95 ±0.20a 1.57 ±0.27d LDL-C(mmol/L) 0.49 ±0.21 1.74 ±0.39a 1.26 ±0.24ac HDL-C(mmol/L) 1.20 ±0.41 0.57 ±0.24a 0.83 ±0.21b
表2 三组大鼠血清CAT、MDA和NO的水平(±s)
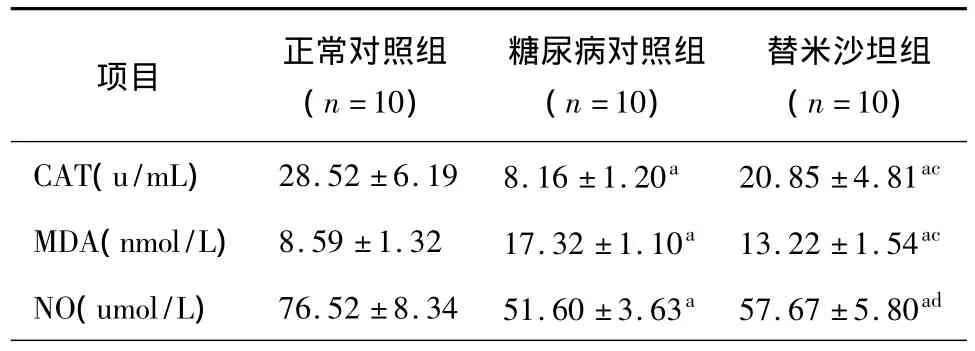
表2 三组大鼠血清CAT、MDA和NO的水平(±s)
注:CAT:过氧化氢酶;MDA:丙二醛;NO:一氧化氮;与正常对照组比较,aP ﹤0.01;与糖尿病对照组比较,cP <0.01,dP <0.05
项目 正常对照组(n=10)糖尿病对照组(n=10)替米沙坦组(n=10)CAT(u/mL) 28.52 ±6.19 8.16 ±1.20a 20.85 ±4.81ac MDA(nmol/L) 8.59 ±1.32 17.32 ±1.10a 13.22 ±1.54ac NO(umol/L) 76.52 ±8.34 51.60 ±3.63a 57.67 ±5.80ad
2.5 透射电镜下血管内皮细胞形态学表现 正常对照组形态:内皮细胞及平滑肌细胞形态完全正常(图1A)。糖尿病对照组形态:内皮细胞肿胀、坏死、脱落,内质网扩张,细胞核凝固、异染色质边集,内弹力膜断裂。平滑肌细胞形态基本正常,无增殖及迁移现象(图1B)。替米沙坦组形态:内皮细胞尚完整,细胞下水肿,与内弹力膜之间形成剥离现象,但内弹力膜无断裂。平滑肌细胞形态正常(图1C)。
3 讨论
糖尿病发病率逐年增加,第17届国际糖尿病大会报道,全球已确诊糖尿病患者1.5亿人,预测2025年将增至3亿。其中T2DM占糖尿病发病率的90%~95%[4],血管内皮损伤已经公认为糖尿病患者动脉粥样硬化的始动环节[5-6],本研究结果显示,与正常对照组相比,糖尿病对照组大鼠血管内皮细胞出现肿胀、坏死、异染色质边集、内弹力膜断裂等电镜下形态学改变,反映内皮细胞功能的重要指标血清NO水平也较正常组明显降低,血管内皮细胞结构、功能都发生了损伤性改变,与既往研究相符。
ARB对动脉粥样硬化的防治作用是最近的研究热点。越来越多的证据表明PPAR-γ激动剂对血管壁细胞具有抗炎、抗氧化、抗增殖作用,从而降低动脉粥样硬化的风险[7-8]。而替米沙坦是目前常规口服剂量下能使PPARγ真正激活的唯一的ARB。本实验用替米沙坦干预糖尿病大鼠,观察它对糖尿病大鼠血管内皮细胞形态、功能的影响,结果发现替米沙坦能降低糖尿病大鼠的血压、血糖水平,改善血脂代谢紊乱,发挥抗氧化作用,电镜下血管内皮细胞的形态较糖尿病组明显改善,血清NO水平也较糖尿病组明显升高,使糖尿病所造成的血管内皮细胞的形态、功能损伤都起到了一定程度的恢复。实验结果显示替米沙坦对糖尿病导致的血管内皮损伤有一定防治作用,同时也证实了其对糖尿病早期动脉粥样硬化的防治作用。
ARB的心血管保护作用已经得到共识,替米沙坦作为独特的ARB能否发挥其独特的作用一直是科研和临床工作者的兴趣点,Yamagishi等[9]认为替米沙坦将成为既针对高血压患者的糖尿病又针对其心血管病变的有希望的“心脏代谢沙坦”。通过动物实验证实了替米沙坦对糖尿病血管内皮损伤的防治作用,为临床更好地防治糖尿病早期动脉粥样硬化提供了确实的实验依据。
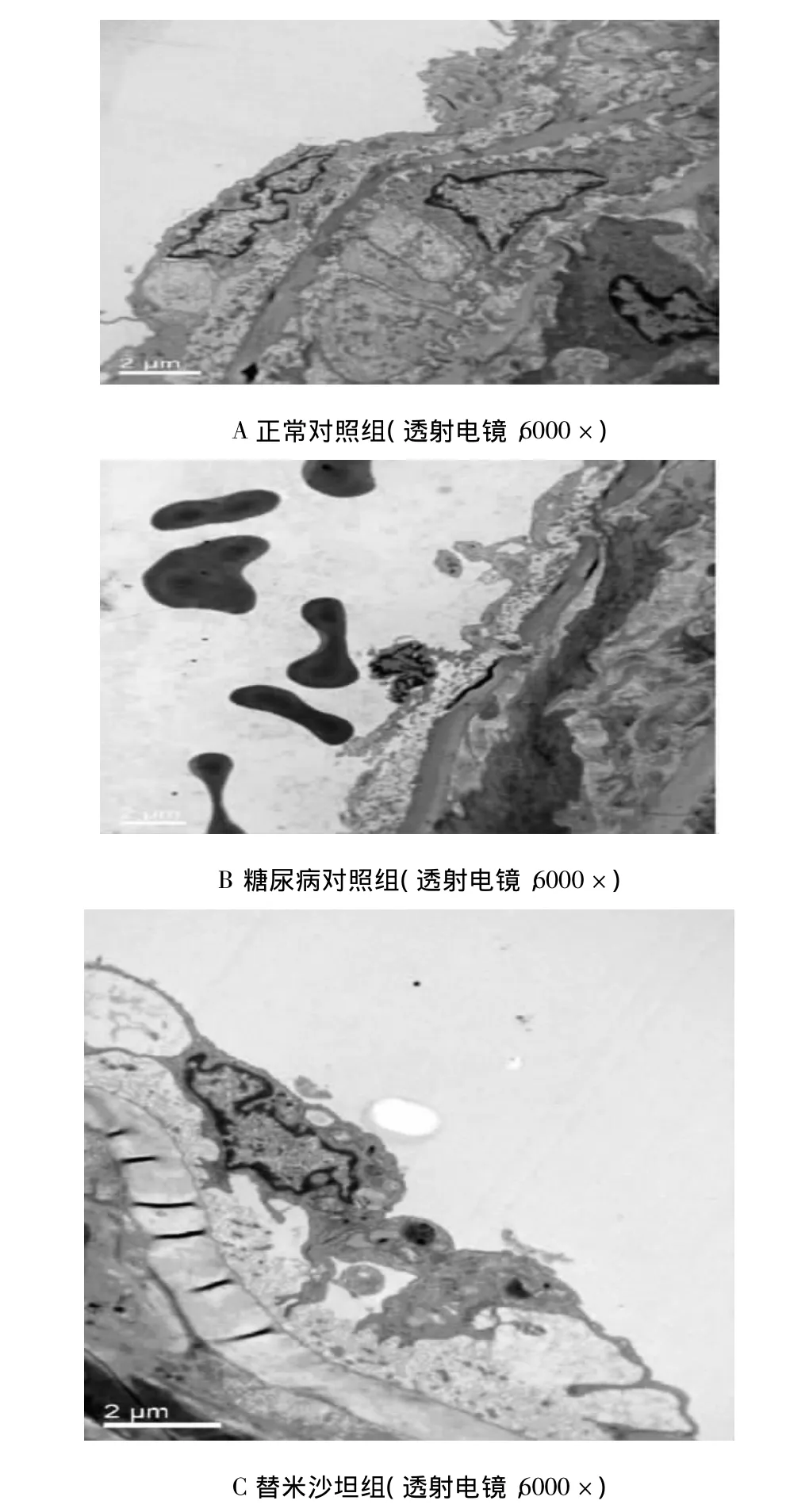
图1 透射电镜下各组血管内皮细胞形态学表现 A:正常对照组B:糖尿病对照组C:替米沙坦组
[1] National Institutes of Health.Third report of the national cholesterol education program(NCEP)expert panel on detection,evaluation,and treatment of High blood cholesterolin adults(adult treatment panelⅢ)final report.NIH 2001.
[2] Nakagami H,Morishita R,Yamamoto K,et al.Hepatocyte growth factor prevents endothelial cell death through inhibition of bax translocation from cytosol to mitochondrial membrane[J].Diabetes,2002,51(8):2604-2611.
[3] Benson,Stephen C,Pershadsingh,et al.Identification of Telmisartan as a Unique AngiotensinII Receptor Antagonist With Selective PPAR[gamma]-Modulating Activity[J].Hypertension,2004,43(5):993-1002.
[4]第十七届国际糖尿病大会简介[J].中华糖尿病杂志,2001,9(1):60-62.
[5] Hsueh WA,Lyon CJ,Quinones MJ.Insulin resistance and the endothelium[J].Am J Med,2004,117(2):109-117.
[6] Morishita,Ryuichi,Nakamura,et al.Potential Role of an Endothelium-Specific Growth Factor,Hepatocyte Growth Factor,on Endothelial Damage in Diabetes[J].Diabetes,1997,46(1):138-142.
[7] Desvergne B,Upanberg A,Devchand PR,et al.The peroxisome proliferator-activated receptors at the cross-road of diet and hormonal signaling[J].J Steroid Biochem Mol Biol,1998,65(1-6):65-74.
[8]李敏,吴学思.替米沙坦改善糖脂代谢的研究进展[J].中国医药,2010,5(1):90-91.
[9] Yamagishi S,Takeuchi M.Telmisartan is a promising cardiometabolic sartan due to its unique PPAR-gamma-inducing property[J].Med Hypotheses,2005,64(3):476-478.

