高寒退化草地恢复中种子包衣对土壤微生物和植株生长的影响
刘迎春,刘志林,向畑恭男
(1.青海畜牧兽医职业技术学院,青海 湟源 812009; 2.高知工科大学物质环境科学系,日本 高知 780-0000)
在高寒退化草地上建植栽培草地,土壤养分直接影响植物生长和栽培草地的建植。高寒草地土壤养分的特点是,有机质含量高,其含量高于4%的土壤占高寒地区的38%;速效养分含量低,速效氮低于93 mg/kg的土壤占高寒地区的54%,速效磷含量低于6 mg/kg的土壤占高寒地区的96%[1]。在高寒气候条件下,土壤微生物的种类和数量较少,而且全年只有近2个月生长较活跃期[2-4]。随着退化草地营养物质量减少,土壤微生物种类和数量更是大大降低[5]。高寒退化草地上建植栽培草地的经验表明,建植的第2-3年,草地生产力持续上升,但自第4年起出现大幅度的下降[6-7]。其原因之一是施化肥不能改良土壤环境使牧草持久增产。所以调控土壤微生物的活性,是改良高寒草地土壤性能、持续提供养分、确保草地持续生产力的关键。
植物根系与土壤微生物之间关系密切,根系分泌物和微生物残体,都为土壤增添有机质,微生物分解有机质为植物生长提供速效养分。提高根际微环境中的微生物的生长和活性,可以促进植物和微生物的生长,同时促进土壤环境可循环的良性发展。退化土地改良中,施用固氮菌和溶磷菌[8]或EM菌肥[9]可改良土壤微生物和根际养分。禾本科作物根际施固氮菌[10]或酵母菌[11],种子产量提高60%~91%。梁宁[12]发现,在贫瘠的土壤表层喷洒脱盐单细胞海洋微藻悬浮液后,土壤各层的微生物活性均提高。用废纸浆、脱盐单细胞海洋微藻粉沫和土壤微生物混合物将林木种子包裹成颗粒,将颗粒置于木桩孔眼中,把木桩打入贫瘠的土壤表层,林木种子的发芽率和树苗的生长都显著改善[13]。
本研究利用植物性吸水材料和微藻粉包衣种子,并接种微生物孢子,分析包衣材料和微藻体是否可以为微生物提供生长必需的养分,使土壤微生物的活性提高,从而促进植物生长;以及包衣材料对土壤微生物活性的促进作用是否可以延续,以期通过种子包衣和接种微生物孢子来改善根际周围的土壤肥力。
1 材料与方法
1.1牧草种 垂穗披碱草(Elymusnutans)和山野豌豆(Viciaamoena),均由青海畜牧兽医职业技术学院种子库提供。
1.2种子包衣材料和包衣方法 包衣材料来源于植物的亲水胶如黄原胶、羧甲基纤维素钠和角叉胶,以及单细胞海洋微藻(Phaeocystissp.neconon-1)粉沫。单细胞海洋微藻采自日本冲绳岛,在添加Eppley’s营养液的人工海水中培养。培养条件为光照1 600 lx、室温、持续充气,培养4周后,离心过滤收集,淡水冲洗脱盐4遍,65℃烘干,研磨成粉末;藻体质量的50%是细胞外多糖包膜,具有很强的吸水性,藻粉的60%为有机物,37%为无机物[14]。为了观察微藻对植株生长的影响,本研究采用两种混合物包衣种子:1号混合物中含有微藻(简称:微藻+),2号混合物中不含微藻(简称:微藻-),混合物成分见表1。用两种包衣混合物手工完成两种牧草的种子包衣。

表1 两种包衣混合物的成分 %
1.3微生物 本研究采用曲霉属曲霉真菌(Aspergillusspp.)和链霉属放线菌(Streptomycesspp.)。用废纸浆和微藻混合物压成2 mm厚的薄片,将湿薄片置于高寒草地土壤表面,每天浇水4~5次,用玻璃罩罩住湿润的薄片。8 d后,薄片上着生了曲霉菌和链霉菌的菌落,分别将曲霉菌黑色的分生孢子和链霉菌白色的孢子从薄片上刮下来,接种在马铃薯(Solanumtuberosum)琼脂培养基上,25℃下培养14 d后,再将曲霉菌分生孢子和链霉菌孢子分别接种在新马铃薯琼脂培养基上,反复分离3次。最后用含有0.01% Triton X-100的0.85% 的盐水,将培养基上黑色和白色的孢子分别冲洗下来,高速离心浓缩孢子悬浮液, -20℃下储存。两种孢子的悬浮液按1∶1的比例混合,孢子浓度为1.7×106孢子/mL(简称为×1孢子),稀释10倍后孢子浓度为1.7×105孢子/mL(简称为×0.1孢子),无孢子悬浮液(简称为×0孢子)。-20℃储存的孢子解冻后,在包衣材料制成的培养基上的萌发率为96%~98%(未显示试验数据)。为了考察微生物孢子的作用,按3个剂量接种孢子:×1、×0.1和×0孢子(对照),将包衣种子在3种孢子剂量的悬浮液中浸泡1 min后马上播种。
1.4土壤呼吸量的测定 土壤取自海拔3 000 m的高寒草地。通过土壤呼吸量的测定确定土壤微生物活性。测定方法如下:两个体积相同的密闭玻璃瓶,用内径为3 mm塑料管连接,塑料管上连接一个电子微压传感器(KYOWA,PDV-10GA),传感器的输出端连接一个记录器。两个玻璃瓶底部都盛有10 mL 4 mol/L的KOH。将盛有5 g土样的小玻璃碗分别放入两个玻璃瓶中,其中给一个玻璃瓶的土样中注入700 mg/mL的葡萄糖溶液5 mL,另一个玻璃瓶的土样注入蒸馏水,4~5 min后,连接的电子微压传感器的记录器上开始显示压力差,因为土壤微生物分解葡萄糖过程中产生的CO2,被瓶底部的KOH吸收生成K2CO3,因而压力降低,两边玻璃瓶的压力出现压力差,显示在记录器上。将高寒草地土壤在120℃下高压灭菌40 min,再与不同比例的高寒草地土壤混合,用这套测量仪测定各种土壤样品的压差,确定测量仪的灵敏度、稳定性和土壤微生物活性的线性关系。可用土壤微生物呼吸产生的CO2(mL/min)表示微生物的呼吸量。
1.5微藻和孢子对牧草生长的影响(试验1) 于2009年5月6日-7月24日在青海省湟源县青海畜牧兽医职业技术学院试验地进行,海拔2 665 m, 36°41′ N,101°15′ E。将100粒包衣并接种微生物孢子的两种种子播种在花盆(直径×高=19.5 cm×20.0 cm)土壤中,不覆土,花盆置于室外屋檐下,以便于控制植物生长过程中的水分。试验期的温度为9~27℃,平均日照时数7.2 h/d。每2 d每花盆浇水300 mL,通过称量烘干(12 h)土壤,测得土壤水分含量为15%~18%,这是模拟高寒草地土壤水分条件[15]。每天早晨观察种子出苗情况,当胚芽鞘的长度为1 mm 时视为种子出苗。每盆中保留10个最早出苗的植株,生长80 d后,挖出植株, 数山野豌豆的根瘤数,60℃烘干2 h,称植株干质量。植株从花盆中收获后,立即测定土壤的呼吸量。试验重复3次。
1.6微藻和孢子对牧草生长和土壤微生物的持续作用(试验2) 试验1花盆中的牧草生长80 d收获后(第1茬),土壤仍留在原花盆中,播撒未包衣、未接种微生物孢子的两种牧草种子。本试验包括4个处理,处理1、2、3分别为微藻粉+包衣,并接种3个不同剂量孢子(×1、×0.1、×0)的第1茬牧草的花盆;处理4为未包衣、未接种孢子的第1茬牧草的花盆;用新土花盆为对照。试验于2009年7月25日-9月26日在青海畜牧兽医职业技术学院试验地进行。试验期内的温度5~32℃,平均日照时数6.6 h/d,每2 d每花盆浇水300 mL,10个最早出苗的植株留在花盆中,生长60 d后,挖出植株,数山野豌豆的根瘤数,60℃烘干2 h,称量植株干质量。植株从花盆中收获后(第2茬),立即测定土壤的呼吸量。试验重复3次。
1.7数据处理和统计分析 用SAS 8.0进行统计分析。用两因素和单因素方差分析法,分析出苗率、植株干质量、根瘤数和土壤呼吸量。种子出苗率数据经过反正弦转换后,用于方差分析。
2 结果与讨论
2.1包衣混合物中的微藻和微生物孢子对牧草生长的影响 包衣种子的出苗率均极显著地高于未包衣种子(P<0.01),不同包衣混合物和接种孢子剂量,也导致了出苗率的极显著差异(P<0.01)(表2)。当包衣混合物中含有藻粉、孢子剂量为×1时,植株的干物质量达到最高值,垂穗披碱草植株为184 mg/株,山野豌豆为156 mg/株(P<0.01);山野豌豆的根瘤数达到最高值(P<0.01),为25个/株,方差分析表明包衣混合物中的微藻与孢子两个因素之间存在互作关系。说明微藻和孢子对两种牧草生长的促进作用缺一不可,可能微藻粉和孢子的互相作用,提高了土壤微生物的活性。另外,不论哪种植物,当混合物含有微藻粉并接种孢子时(微藻+、×1孢子和微藻+、×0.1孢子),土壤的呼吸量极显著地高于其他处理(P<0.01),而且植株的干物质量与土壤呼吸量之间存在着极显著的正相关关系(垂穗披碱草:R2=0.987,P<0.001;山野豌豆:R2=0.942,P<0.001),山野豌豆的根瘤数与土壤呼吸量之间也存在着极显著的正相关关系(R2=0.892,P<0.001)。证明植株生长量的增加是土壤微生物活性提高所致,包衣混合物中微藻粉和微生物孢子的相互作用直接或间接地提高了植株生长量。
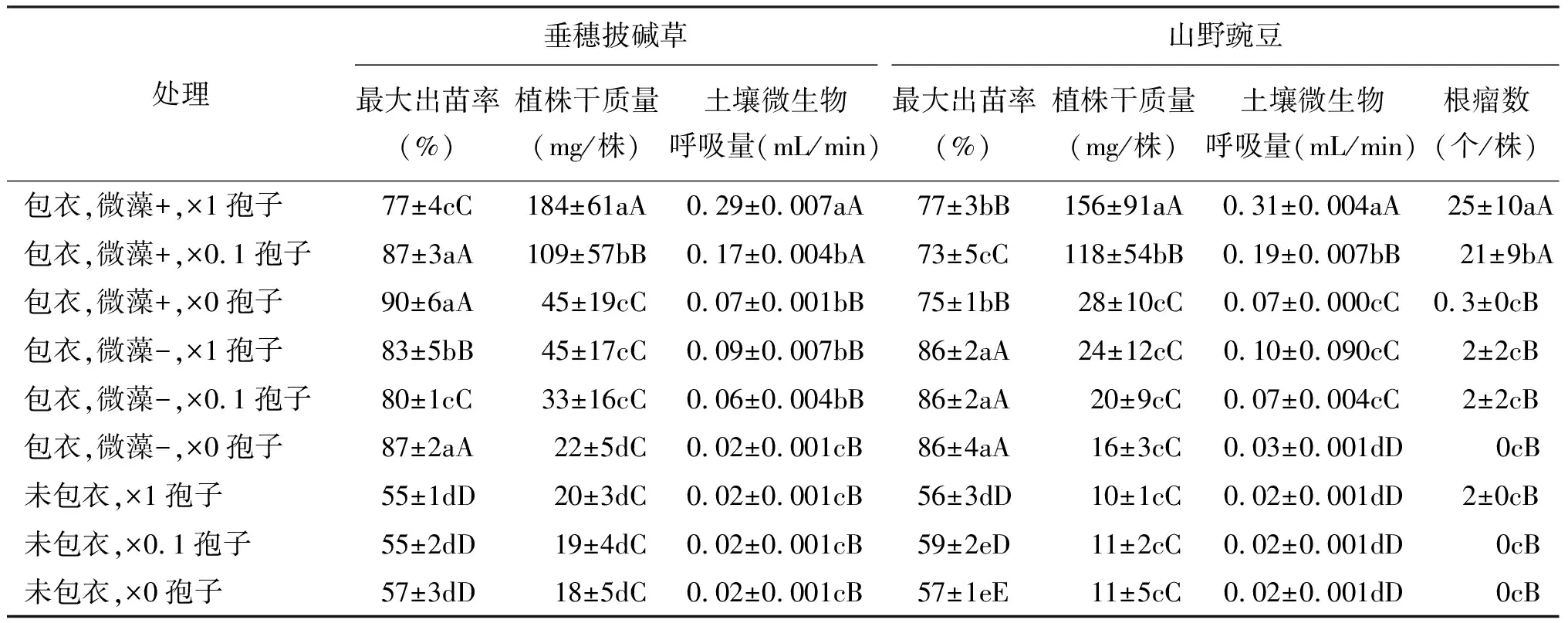
表2 种子包衣、微藻和微生物对两种牧草种子出苗率、植株干质量、根瘤数和土壤呼吸量的影响
本试验采用土壤曲霉真菌和放线菌。高寒草地土壤真菌的生物量最大,其次是放线菌[16],因此采用的曲霉真菌和放线菌引发了土壤微生物活性和植株生长的提高。玉米(Zeamays)植株的根际土壤中分离出固氮和溶磷的细菌,试验室扩繁后,再将这些细菌回归根际土壤,玉米籽粒产量显著提高[17]。在石灰矿区植被恢复中,将土壤中分离出的真菌在试验室进行扩大繁殖,再将该真菌接种于种子上,植株生长量显著高于对照[18]。园艺植物培养液中添加固氮菌,促进了植物生长[19]。植物根际的土壤微生物被分离出来,经过繁殖扩增再回归土壤环境。而在本研究中,不仅分离并异地繁殖扩增了土壤微生物,而且以种子包衣作为载体,将土壤微生物大量地回归植物根际,人为地加入了植物性亲水胶和藻粉,为微生物的生长繁殖提供碳、氮、磷和钾的营养,进而改善了根际营养条件。包衣材料中的微藻和微生物导致土壤微生物的活性提高和植株的生长。
包衣种子出苗率全部高于未包衣种子,说明种子包衣仅促进了种子的早期萌发,提高出苗率,而后期植株生长则有赖于包衣混合物中的藻粉与微生物之间的相互作用。
2.2包衣混合物的微藻和孢子对植物生长和土壤微生物活性的持续作用 第1茬种子处理效应均表现在第2茬植物的干质量和根瘤数上,如果第1茬包衣种子含有微藻和微生物孢子时(微藻+、孢子×1或0.1),第2茬植物植株的干质量极显著地增加(P<0.01),山野豌豆的根瘤数也极显著地增加(P<0.01)(表3)。两种植物,第1茬包衣种子含有微藻时,收获第2茬后土壤呼吸量均显著提高(P<0.05)。同样,第2茬植株的干物质量与土壤呼吸量之间也存在着显著的正相关的关系(垂穗披碱草为R2=0.719,P<0.001;山野豌豆为R2=0.982 ,P<0.001),山野豌豆的根瘤数与土壤呼吸量之间也有极显著的正相关(R2=0.989,P<0.001)。证明第1茬植株收获后,因为某些物质如土壤微生物等留在了土壤中,包衣混合物的微藻和孢子引发了土壤微生物的大量繁殖,改变了根际环境,这种效应持续到后续的植株生长过程中。另外,植物根系分泌物可以活化矿物质养分、促进植物吸收土壤养分;细胞和组织的脱落物等,又是土壤微生物的能源物质,通过影响土壤微生物的数量和活性,对土壤中的养分元素起到了间接的活化作用[20]。这种良性循环使得土壤环境得以改善。
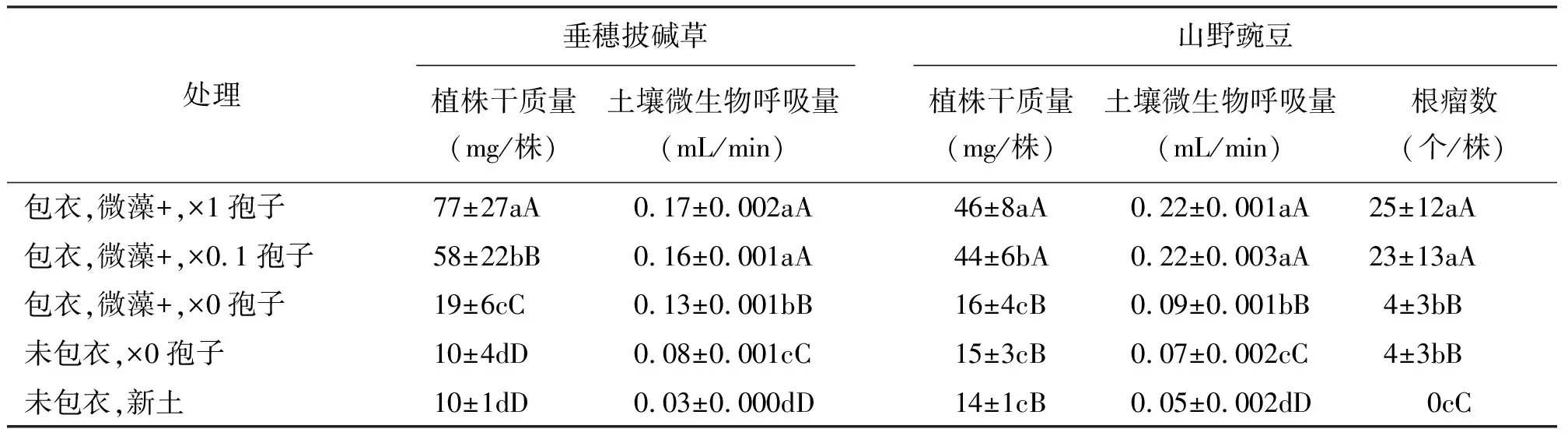
表3 微藻粉和微生物对两种牧草植株干质量、根瘤数和土壤呼吸量的持续影响
种子微藻包衣并接种微生物孢子,提高了植株根际土壤微生物活性和植物生长,并且诱导了土壤环境和植物生长的持续改善和提高。植株根际藻和微生物相互作用的机理、以及对植株生长影响的机理还有待于进一步的研究。
[1] 林永昌.青海省土壤资源评析[A].青海省草原总站资料选编(第三集)[C].西宁:青海人民出版社,1992:43-46.
[2] 王启兰,杨涛.高寒草甸土壤氮素代谢作用强度的研究[A].高寒草甸生态系统(第四集)[M].北京:科学出版社,1995:179-184.
[3] 王启兰,李家藻.高寒草甸不同植被土壤真菌生物量的季节动态[A].高寒草甸生态系统(第四集)[M].北京:科学出版社,1995:169-176.
[4] 熊毅.中国土壤[M].第二版.北京:科学出版社,1987:284-303.
[5] 尚占环,丁玲玲,龙瑞军,等.江河源区退化高寒草地土壤微生物与地上植被及土壤环境的关系[J].草业学报,2007,16(1):34-40.
[6] 李希来,黄葆宁.“黑土滩”退化草地补种禾草和嵩草试验初报[J].青海畜牧兽医杂志,1996(4):9-11.
[7] 黄葆宁,李希来.利用嵩草属优良牧草恢复“黑土滩”植被试验研究报告[J].青海畜牧兽医杂志,1996(1):1-5.
[8] Wu S C,Cao Z H,Li Z G,etal.Effects of biofertilizer containing N-fixers, P and K solubilizers and AM fungi on maize growth:a green house trial[J].Geoderma,2005,125(1/2):155-166.
[9] Xu H L.Effect of a microbial inoculant and organic fertilizers on the growth, photosynthesis and yield of sweet corn[J].Journal of Crop Production,2000,3:183-214.
[10] Nandi A S, Sen S P.Utility of some nitrogen-fixing microorganisms in the phylloshere of crop plants[J].Plant and Soil,1981,63(3):465-476.
[11] Kobayashi M,Torigai Y,Takashi E.Effect of yeast on higher plants[J].Plant and Soil,1980,57(1):41-47.
[12] 梁宁.海洋微藻Phaeocystissp.对退化土地微生物的影响——一种改良退化土地的尝试[D].Kochi:Kochi Uniersity of Technology,2003.
[13] Kobayashi A.An attempt to create a plantation pile[D].Kochi:Kochi University of Technology, 2007.
[14] Kurachi J.Physiological analysis of a unicellular marine microalga,Phaeocystissp.necolon 1[D].Kochi:Kochi University of Technology,2003.
[15] 李希来.青海省南部退化草地土壤特性调查[J].青海畜牧兽医杂志,1994(3):7-12.
[16] 张成霞,南志标.放牧对草地土壤微生物影响的研究述评[J].草业科学,2010,27(1):65-70.
[17] Mehnaz S,Lazarovits G.Inoculation effects ofPseudomonasputida,Gluconacetobacterazotocaptans, andAzospirillumlipoferumon corn plant growth under greenhouse conditions[J].Microbial Ecology,2006,51:326-335.
[18] Rao A,Tak R.Growth of different tree species and their nutrition uptake in limestone mine spoils as influenced by arbuscular mycorrhizal (AM) fungi in Indian arid zone[J].Journal of Arid Environment,2002,51:113-119.
[19] Perner H,Schwarz D,George E.Effect of mycorrhizal inoculation and compost supply on growth and nutrition uptake of young leek plants grown on peat-based substrates[J].HortScience,2006,41(3):628-632.
[20] 吴彩霞,傅华.根系分泌物的作用及影响因素[J].草业科学,2009,26(9):24-29.

