牛皮蝇HA抗原基因转化紫花苜蓿的研究
王红梅,朱 艳,陈玉梁
(1.甘肃省农科院生物技术研究所,甘肃 兰州 730070;2.兰州大学生命科学学院,甘肃 兰州 730000)
牛皮蝇蛆病是由牛皮蝇、纹皮蝇和中华皮蝇的幼虫寄生于牛或牦牛背部皮下组织所引起的疾病的统称[1],其危害牛的健康和皮革品质,是草原放牧牛最常见和危害最严重的寄生虫病之一,每年给畜牧业造成巨大的经济损失。同时,皮蝇幼虫还可寄生于人体,因而该病是一种人畜共患病[2-3]。
皮蝇的Hypodermin A (HA)是皮蝇幼虫感染牛后能首先检测到的重要抗原之一,也是牛皮蝇蛆病免疫诊断和基因工程疫苗研究的选择性抗原[4]。纯化的HA蛋白免疫牛后,可刺激机体产生抗体,有效地抵抗病原的侵袭,为寄生虫病疫苗的研制提供了依据[5]。由于提供足够量的天然HA具有相当大的难度,基因重组技术为免疫抗原的需求提供了平台。有研究者采用大肠杆菌、果蝇、杆状病毒和毕赤酵母等4种表达系统对HA蛋白进行了体外表达研究[6],发现大肠杆菌表达系统由于不具有蛋白质二级结构折叠与修饰作用,所表达的HA蛋白不具有酶活性;HA在果蝇表达系统中的表达,产量可达到25 mg/L,但其无血清培养液过于昂贵,难以推广应用;采用杆状病毒表达HA蛋白,所获产量过低,无法满足生产的需求;毕赤酵母蛋白表达产量高,是兼有真核表达系统翻译后修饰功能及原核表达系统方便、简单和生产成本低等优点的表达系统,为免疫抗原蛋白的生产提供了新的途径。
紫花苜蓿(Medicagosativa)富含蛋白质、多种维生素和矿物质,是多种家畜喜食的优质饲草,素有“牧草之王”的美称,是一种生产植物蛋白的巨大资源宝库[7],在实验室中又是牧草研究的模式植物。目前,已有多种病毒相关基因被导入苜蓿中,苜蓿表达的异源蛋白质具有良好的免疫原性,并能对机体产生较好的保护力[8-10]。本研究以紫花苜蓿优良品种甘农1号为受体材料,采用生物技术手段将HA抗原基因导入其中,旨在为利用苜蓿作为生物反应器来生产可食性疫苗建立研究基础。
1 材料与方法
1.1研究材料 HA抗原材料由中国农科院兰州兽医研究所殷宏研究员提供;紫花苜蓿甘农1号(M.sativacv.Gannong No.1)是适宜在牧区种植的抗旱、抗寒优良品种,种子由甘肃农业大学草业学院曹致中教授提供。
1.2农杆菌和质粒 农杆菌菌株为LBA4404,质粒为pCAMBIA1300(由甘肃省农科院生物技术研究所实验室构建并保存)。该质粒携带组成型启动子CaMV 35S启动子驱动的HA基因,以新霉素磷酸转移合成酶nptⅡ基因作为筛选标记基因。
1.3苜蓿再生体系建立 选取饱满的苜蓿种子,流水冲洗30 min,75%酒精消毒45 s,0.1%升汞消毒10 min,无菌水漂洗4次,吸干后接种到1/2 MS培养基上,25 ℃暗培养3 d,种子萌发后转入光照培养。取5~7 d苗龄的子叶和下胚轴,子叶沿叶脉方向切成两半,下胚轴切成0.5 cm左右的小段,接种在诱导培养基上,20 d后转入分化培养基。每处理接种外植体30个,设3个重复。培养条件为(25±1) ℃,光强度为2 500 lx,光照时间16 h/d。诱导培养基为MS+2,4-D 1.0~2.0+6-BA 0~1.0;分化培养基为MS+6-BA 0.5+NAA 0.01~0.05+GA32.0;生根培养基为1/2 MS+IAA 0.5(激素单位:mg/L,pH值为5.8)。
1.4苜蓿转化体系建立
1.4.1菌液浓度、浸染时间的确定 分别采用不同浓度的农杆菌菌液浸染子叶,OD600分别为0.2、0.5、0.8、1.0,20 d后观察愈伤组织并记录结果。用OD600为0.5的农杆菌菌液分别侵染子叶5、10和15 min,观察愈伤组织长势并记录结果。
1.4.2共培养时间的选择 农杆菌浸染之后,设置共培养时间分别为2、3、4和5 d,以研究共培养时间对转化的影响,不同处理在20 d后观察愈伤形成情况。
1.4.3抑菌素质量浓度的确定 分别采用质量浓度为0、100、200、300、400和500 mg/L的头孢霉素(Cef) 和羧苄青霉素(Carb)的诱导培养基进行抗生素抑菌质量浓度的选择,30 d后观察统计生长情况。
1.4.4农杆菌浸染和植株再生 将浸染过的子叶放在无菌的滤纸上,吸去表面多余的菌液,共培养2 d后转入加有50 mg/L Kan和500 mg/L Carb的培养基进行愈伤诱导,约3 周后转入分化培养基上诱导植株再生,期间不断调整抗菌素种类和质量浓度。
1.5转化植株的分子检测
1.5.1PCR检测 DNA提取采用CTAB微量法。PCR反应体系为25 μL,其中包含10 mmol/L Tris-HCl(pH值8.3),1.8 mmol/L MgCl2,0.2 μmol/L dNTP,0.25 μmol/L引物,1 U Taq酶,约30 ng基因组DNA。PCR反应程序:94 ℃预变性3 min,94 ℃ 50 s,50 ℃ 40 s,72 ℃ 60 s,35个循环,72 ℃延伸10 min。扩增产物用1.0%的琼脂糖凝胶电泳检测,结果用凝胶成像扫描仪拍照并保存。试验中所用生化试剂均为分析纯,DNA Taq酶和电泳试剂购自上海生工,引物[9]由大连宝生物技术有限公司合成,分别在上游引物和下游引物中引入EcoRⅠ、XhoⅠ酶切位点。上游引物:5′-ACGAATTCATTGTTGGTGGCTTTGAGGCCGAT-3′,下游引物:5′-GCCTCGAGTTAAAAAGATTTTGCATTTTCAGTAATC-3′,划线部分为内切酶识别位点。
1.5.2Southern分子杂交检测 苜蓿总DNA提取、浓度纯度测定、酶切、电泳、转移印迹、固定等,参照王关林和方宏筠[11]提供的方法。探针制备、免疫检测参见DIG DNA Labeling and Detection Kit使用说明。预杂交、杂交方法参见ULTR-AhybTM使用说明。
2 结果与分析
2.1外源激素对苜蓿外植体愈伤组织诱导和再生的影响 建立受体材料高效再生体系对于实现遗传转化至关重要。针对甘农1号苜蓿特定基因型筛选诱导再生的激素种类和浓度是实现遗传转化的前提和保障。
2.1.1激素对紫花苜蓿愈伤组织诱导的影响 采用MS基本培养基附加2,4-D和6-BA两种不同质量浓度的激素及其组合来诱导苜蓿子叶和下胚轴愈伤组织。培养期间发现2,4-D的存在及其质量浓度直接决定了愈伤的发生和生长状态,培养基中单纯使用2,4-D诱导愈伤形成的作用较为明显,子叶和下胚轴诱导率均为100%,且愈伤的增殖非常快,但组织结构过于疏松,表面呈白色粉末状,完全没有分化的可能;生长素2,4-D与细胞分裂素6-BA的组合使用诱导效果较好(图1A),愈伤呈浅黄绿色颗粒状,培养基MS+2,4-D 2.0 mg/L+6-BA 0.5 mg/L胚性愈伤组织诱导率高,子叶可达82%,有利于分化成苗。
2.1.2激素对苜蓿愈伤组织分化的影响 MS培养基附加不同种类和质量浓度的外源激素,诱导外植体出芽时间和芽分化率存在显著差异,子叶明显优于下胚轴。多次试验中发现,在附加6-BA 0.5 mg/L和NAA 0.03 mg/L的培养基中,子叶愈伤组织15 d转接一次,约40 d左右分化出芽(图1B、1C);在培养基中加入2 mg/L GA3能有效提高分化率,可达48.3%,GA3具有促进幼芽发育成植株的作用。下胚轴愈伤组织需要在分化培养基上转接4~5次,才有少量愈伤分化出芽,分化率约3.7%,显著低于子叶,严重制约着遗传转化效率。可见,选择恰当的外植体类型对提高分化率非常关键。
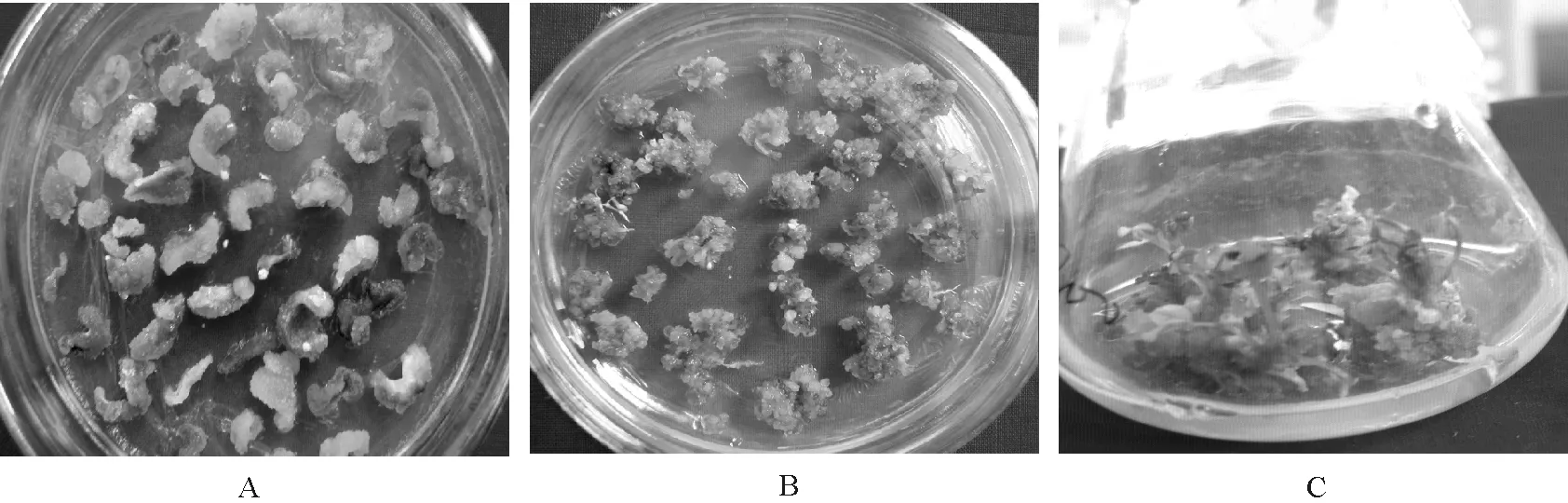
图1 甘农1号苜蓿子叶愈伤组织诱导及植株再生
2.2苜蓿遗传转化体系优化
2.2.1菌液浓度及感染时间对转化的影响 通常情况下当细菌培养到对数生长期即OD600为0.5~0.6被认为活力最好,感染力强,收集此时的菌体,用1/2 MS液体培养基稀释,使其浓度(OD600)为0.2~1.0进行试验。结果发现,随着菌液浓度的增大,苜蓿子叶愈伤诱导率逐步降低,但抗性愈伤组织诱导率在OD600为0.5时最高,大于0.5时逐渐降低。原因是随着菌液浓度的不断升高,细菌对外植体伤害越大,导致愈伤组织诱导率下降。用OD600为0.5的菌液分别浸染子叶5、10和15 min,观察愈伤长势情况时发现,子叶浸染小于10 min时愈伤长势良好(图2A、2B),且抗性愈伤组织诱导率较高,10 min以上农杆菌则会因过度生长而无法抑制。因此,本研究中确定菌液适宜的浸染浓度(OD600)为0.5,浸染时间为8~10 min。

图2 甘农1号苜蓿抗性愈伤组织诱导及植株再生
2.2.2共培养时间对转化的影响 外植体与农杆菌的共培养是T-DNA转移到植物细胞的过程。农杆菌浸染外植体后不能立即实现外源基因向受体细胞的转移和整合,一般认为需经过一定时间的“细胞调节期”才能发生这一过程[11]。因此,共培养时间的确定对遗传转化效率有着重要的影响。本研究结果表明,苜蓿子叶共培养时间为3 d时,抗性愈伤组织诱导率最高达58.4%(图3),但子叶切口边缘都有菌丝长出,使后期培养过程中抑菌困难,导致转化率降低。由此,确定2 d为比较适宜的共培养时间。
2.2.3选择培养基中抑菌抗生素质量浓度的选择 当头孢霉素(Cef)和羧苄青霉素(Carb)质量浓度达到500 mg/L时,可以完全抑制农杆菌的生长,但通过试验发现Cef对苜蓿子叶的诱导分化起抑制作用,但不影响植株的生根。所以,在本研究中苜蓿外植体与农杆菌共培养后,为了减少农杆菌的污染,在外植体诱导分化培养基上采取了先加500 mg/L Carb,然后在每次继代时逐渐降低其质量浓度,最低时用100 mg/L的Carb来抑菌。获得Kan抗性植株后,生根阶段采用200 mg/L Cef就可以有效抑制农杆菌(图2C)。
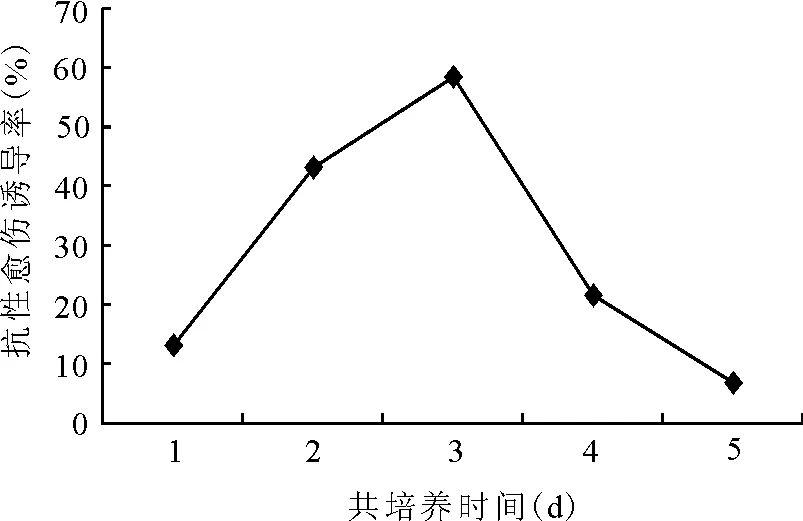
图3 共培养时间对子叶愈伤诱导率的影响
2.3转基因苜蓿分子生物学检测
2.3.1转基因苜蓿PCR检测 以质粒pCAMBIA1300-HA的DNA为阳性对照,分别以非转基因植株和无模板扩增为阴性对照,用HA基因特异性引物对Kan抗性植株DNA进行PCR扩增。从获得的56株转化苗中,有7株扩增出了大约697 bp的特异片段,阳性检出率12.5%。检测结果初步表明,HA基因已整合到受体苜蓿基因组中(图4)。

图4 部分转基因植株PCR检测
2.3.2转基因植株PCR-Southern检测 将PCR阳性植株和非转基因植株的DNA经EcoRⅠ、XhoⅠ酶切后,进行琼脂糖凝胶电泳,然后转移到尼龙膜上,与以地高辛标记的HA基因特异PCR 产物进行分子杂交。结果显示(图5),阴性对照无杂交条带,阳性对照和转化植株有明显的杂交条带,South-ern分子杂交结果进一步证明了HA抗原基因已整合到了紫花苜蓿基因组中。

图5 转基因植株PCR-Southern检测
3 讨论
苜蓿作为转基因受体材料,其本身存在着体细胞胚诱导困难、分化率低、重复性差等问题,这就严格制约着转化效率的提高[12-13]。为此,有必要针对特定基因型材料建立高频再生体系对实现遗传转化至关重要。本研究中甘农1号紫花苜蓿7 d苗龄的子叶再生频率显著高于下胚轴,生长素2,4-D对诱导愈伤形成的作用明显,6-BA和NAA的配合使用可提高子叶再生频率,GA3可降低畸形苗的形成,促进植株正常生长发育。另外,影响遗传转化的因素很多,并且各因素之间存在交互作用。本研究优化了紫花苜蓿遗传转化条件,确定菌液浸染浓度(OD600)为0.5,浸染时间为8~10 min,适宜的共培养时间为2 d,子叶诱导分化阶段使用Carb抑菌,再生植株壮苗期间使用Cef有利于生根,最终获得了经过分子鉴定的转基因苜蓿植株。但与一些相关研究[14]相比,本研究中的转化效率较低,原因是苜蓿外植体再生频率存在基因型差异,甘农1号紫花苜蓿再生频率低,严重制约着遗传转化效率。因此,需要从建立高频再生体系方面加强研究。
转基因苜蓿作为植物生物反应器具有操作方便、便于大面积推广等许多潜在的优势,多数可直接饲用或食用。例如口蹄疫疫苗等可以免去提取、纯化、注射等一系列过程,直接作为“口服疫苗”使用,为人类提供了一个更加安全和廉价的生产体系,展现出了非常广阔的应用前景[15]。但是在转基因苜蓿疫苗的研究中,抗原表达量低及遗传稳定性差是限制其规模化发展的主要问题。一般考虑选用合适的强启动子、增强子和改造表达载体等方法,来提高外源基因在苜蓿体内的表达量[16]。本研究中获得的转基因苜蓿为皮蝇蛆病植物源疫苗的开发和应用奠定了研究基础,但HA基因在苜蓿体内是否表达及在后代材料中遗传稳定性如何还有待进一步的研究。
[1]孔繁瑶.家畜寄生虫学[M].第2版.北京:中国农业大学出版社,1997:276-278.
[2]凌洪博,梁韶晖,刘启真.牛皮蝇致人体皮蝇蛆病一例[J].温州医学院学报,2000,30(1):7.
[3]胡群,王焱.牛皮蝇幼虫所致蝇蛆病1例[J].中国寄生虫病防治杂志,2002,15(6):351.
[4]孙怡,何国声,徐梅倩,等.重组牛皮蝇素A蛋白的免疫试验[J].中国兽医寄生虫病,2006(2):1-5.
[5]Moire N,Bigot Y,Periquet G,etal.Sequencing and gene expression of hypodermins A,B,C in larval stages ofHypodermalineatum[J].Molecular and Biochemical Parasitology,1994,66(2):233-240.
[6]孙怡,徐梅倩,高兴春,等.毕赤酵母表达皮蝇素A 蛋白[J].中国兽医学报,2006,26(3):296-299.
[7]李瑞琴,于安芬,水蓉,等.苜蓿蛋白质分组测定初探[J].草业科学,2009,26(5):99-102.
[8]Joensuu J J,Verdonck F,Ehrstrom A,etal.F4 (K88) fimbrial adhesin FaeG expressed in alfalfa reduces F4+ enterotoxigenicEscherichiacoliexcretion in weaned piglets[J].Vaccine,2006,24(13):2387-2394.
[9]张金波,祝建波,陈创夫.转基因苜蓿口服疫苗的研究和应用[J].生命的化学,2007,27(4):355-357.
[10]唐立刚,杨东英,罗建勋,等.皮蝇Hypodermin A基因的克隆及表达质粒构建[J].动物科学与动物医学,2004,21(1):22-23.
[11]王关林,方宏筠.植物基因工程[M].北京:科学出版社,2002:744,757-758.
[12]毛雅妮,孙娟,张德罡,等.苜蓿组织培养研究进展[J].草业科学,2009,26(9):146-155.
[13]马伶俐,柳小妮,刘晓静,等.甘农4号紫花苜蓿组培再生体系的建立[J].草业科学,2008,25(12):67-70.
[14]盛慧,朱延明,李杰,等.DREB2A基因对苜蓿遗传转化的研究[J].草业科学,2007,24(3):40-45.
[15]韩利芳,张玉发.紫花苜蓿作为生物反应器的研究现状及应用前景[J].草业学报,2004,13(2):23-27.
[16]燕丽萍,夏阳,梁慧敏,等.转BADH基因苜蓿T1代遗传稳定性和抗盐性研究[J].草业学报, 2009,18(6):66-71.

