金属的什么部位腐蚀最严重?
陈春丽
(江苏省丰县欢口中学江苏丰县221700)
金属的什么部位腐蚀最严重?
陈春丽
(江苏省丰县欢口中学江苏丰县221700)
通过浓差电池的形成和实验说明了金属在电解质溶液液面上下的腐蚀情况,澄清了人们对金属腐蚀的一种错误认识。
电化学腐蚀;溶解氧;浓差电池;锈蚀
电化学腐蚀是自然界中金属腐蚀最普遍的一种形式,由于金属在这种腐蚀的过程中发生许多微电池反应,造成电化学腐蚀比其它形式的腐蚀更快、更严重。

图1
在中学化学中,有这样一个和电化学腐蚀有关的问题:将一根铁钉如图1所示放入一个盛有食盐水的试管中,则铁钉上部(液面上)、铁钉与液面交界处、铁钉下部(液面下)三个部位,哪个部位腐蚀最严重?
通过实验我们发现在食盐水液面与铁钉的接触处铁锈产生的最多。对于上面提出的问题我们有些老师和许多教辅材料给出的答案为:液面交界处铁钉腐蚀最严重。可能你也会认为这个答案是正确的,因为自然界中钢铁通常在液面交界处有大量的铁锈产生,其它部位的铁锈都比液面交界处少得多。其实这个答案是凭想当然给出的,是受了这种日常现象的蒙蔽。在某些电解质溶液中,腐蚀最严重的部位不是在铁钉和液面交界处,而是位于液面以下的部分,并且与液面以下的深度有关系,液面越往下铁钉腐蚀也越严重,这是为什么呢?我们可以作下面的分析。
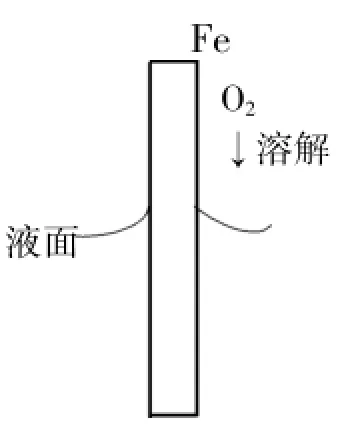
图2
如图2所示将铁棒插入弱碱性或中性电解质溶液(如食盐水)中,溶解于水溶液中的氧气和铁棒间就会发生原电池反应而引起铁棒的锈蚀。
在铁棒腐蚀的过程中,铁失去电子被氧化,吸附在铁表面的氧气分子得到电子被还原,当铁棒插入溶液而又有铁棒露在液面外时,暴露在液面外和与液面交界处的铁棒周围氧气的浓度较大,而液面下铁棒附近溶液中溶解的氧气浓度较小,氧气浓度大的地方氧气在铁棒上更容易得到电子被还原,这样就造成液面交界处铁棒的电位高于液面下铁棒的电位,液面下铁棒失去电子就会流向电极电位高的上部,铁棒和电解质溶液间就形成了浓差电池,处于氧气浓度低处的铁将失去电子构成浓差电池的负极而受到腐蚀,在这种腐蚀过程中,液面下面的铁被逐渐消耗,而和液面交界处的铁接受了液面下部铁提供的电子被保护,因此上述试管中的铁钉下部腐蚀最严重。
为了说明铁棒腐蚀的情况,笔者设计了下面的实验:
实验装置如图3所示:
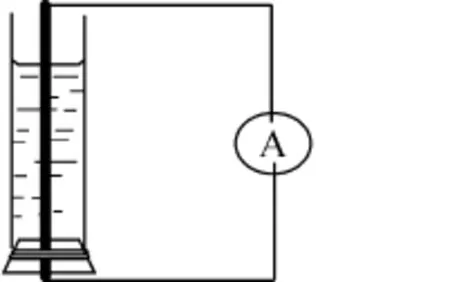
图3
将带橡皮塞的铁棒插入一定长度的玻璃管中,玻璃管中加入加热煮沸的氯化钠溶液,用玻璃棒搅拌上部的溶液,形成与自然条件相似的环境。然后用导线连接铁棒两端,线路中接入检流计,观察检流计指针偏转情况。
我们看到检流计指针发生了偏转,说明形成了原电池,通过检流计指针的偏转方向,可以得出发生原电池反应的负极是铁棒的下端,铁棒的上端为原电池的正极。所以在铁棒腐蚀的过程中,下端的铁失电子被腐蚀。
既然铁棒、铁钉下部的腐蚀最严重,为什么我们却看到和液面交界处铁钉生锈最多呢?我们来看铁锈的形成过程。
由于浓差电池的形成,液面下铁钉为负极:2Fe-4e-=2Fe2+
液面交界处铁钉为正极:O2+4e-+2H2O=4OH-
生成的Fe2+在溶液中扩散到OH-浓度大的液面,在液面Fe2+结合OH-生成Fe(OH)2,Fe(OH)2容易被氧化转化为Fe(OH)3,进一步形成铁锈。
1008-0546(2011)10-0067-01
G633.8
B
10.3969/j.issn.1008-0546.2011.10.034

