饲粮添加L-精氨酸或N-氨甲酰谷氨酸对感染PRRSV妊娠母猪繁殖性能及免疫功能的影响
杨 平 吴 德* 车炼强 方正锋 林 燕谯仕彦 李 勇 曾 毅 苏 祥
(1.四川农业大学动物营养研究所,动物抗病营养教育部重点实验室,雅安 625014;2.中国农业大学国家饲料工程技术研究中心,北京 100193;3.广西商大科技有限公司,南宁 530105)
饲粮添加L-精氨酸或N-氨甲酰谷氨酸对感染PRRSV妊娠母猪繁殖性能及免疫功能的影响
杨 平1吴 德1*车炼强1方正锋1林 燕1谯仕彦2李 勇3曾 毅3苏 祥3
(1.四川农业大学动物营养研究所,动物抗病营养教育部重点实验室,雅安 625014;2.中国农业大学国家饲料工程技术研究中心,北京 100193;3.广西商大科技有限公司,南宁 530105)
本文旨在研究饲粮添加L-精氨酸或N-氨甲酰谷氨酸(N-carbamyl glutamate,NCG)对感染猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)妊娠母猪繁殖性能及免疫功能的影响。选用3~5胎感染PRRSV的母猪(长白×大约克)60头,随机分为3组,每组20头,单栏饲养。试验猪妊娠第30~90天分别饲喂含1.7%L-丙氨酸(对照组)、1.0%L-精氨酸和0.1%NCG的等氮饲粮,妊娠第91天至分娩饲喂对照组饲粮。妊娠第30、90和110天早上采食后2 h收集母猪血样。试验结果表明:与对照组相比,1%L- 精氨酸添加组窝产活仔数提高0.89 头(P<0.05),窝活仔重提高1.02 kg(P>0.05),0.1%NCG添加组窝产活仔数提高0.33头(P>0.05);1.0%L-精氨酸添加组和0.1%NCG添加组妊娠第90天母猪血清免疫球蛋白G(IgG)、免疫球蛋白M(IgM)和PRRSV抗体水平显著升高(P<0.05),血浆尿素浓度显著降低(P<0.05);1.0%L-精氨酸添加组妊娠第90天母猪血浆蛋氨酸、精氨酸、鸟氨酸、脯氨酸浓度显著升高(P<0.05),妊娠第110天母猪血清IgG水平显著升高(P<0.05);1.0%L-精氨酸添加组和0.1%NCG添加组母猪繁殖性能无显著差异(P>0.05),但1.0%L-精氨酸添加组妊娠第90天母猪血浆蛋氨酸、精氨酸、鸟氨酸浓度及血清IgG水平显著高于0.1%NCG添加组(P<0.05)。结果提示:饲粮添加L-精氨酸或NCG能改善妊娠母猪繁殖性能,其作用途径可能与饲粮中L-精氨酸或NCG可以提高母猪体内部分氨基酸利用率及免疫力有关。
L-精氨酸;NCG;PRRSV;妊娠母猪;繁殖性能;免疫
母猪产仔数的增加将有助于提高母猪繁殖效率和经济效益。妊娠母猪感染猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)会引起母猪早产、死胎、流产及产弱仔等繁殖障碍,带来巨大的经济损失[1]。近年来国内外许多研究证实通过饲粮添加精氨酸可显著提高母猪窝产活仔数和窝活仔重[2-3],然而,Li等[4]研究发现精氨酸有降低妊娠早期母猪胚胎存活的作用。因此,精氨酸对妊娠母猪繁殖成绩的提高作用可能发生在妊娠中后期。同时研究还发现,精氨酸对改善机体免疫功能起着重要作用[5-6]。N - 氨甲酰谷氨酸(N-carbamyl gluta-mate,NCG)作为尿素循环中鸟氨酸生成瓜氨酸的中间体N-乙酰谷氨酸(NAG)的代谢稳定类似物,是精氨酸内源合成限速酶——氨甲酰磷酸合成酶-1(CPS-1)的激活剂,能促进精氨酸的合成。不过,饲粮添加精氨酸或NCG对感染PRRSV母猪弱仔率、死胎率、窝产活仔数的影响未见报道。因此,本试验旨在探讨饲粮添加L-精氨酸或NCG是否会通过影响母猪体内代谢过程和提高免疫力进而影响感染PRRSV母猪的繁殖性能。
1 材料与方法
1.1 试验材料
L-精氨酸盐酸盐和L-丙氨酸,纯度≥98.5%(购于北京嘉康源科技有限公司);NCG纯度为50%,由国家饲料工程技术研究中心提供。
1.2 试验设计与分组
选用3~5胎感染 PRRSV(检测方法:RTPCR,见图1)的母猪(长白×大约克)60头,妊娠第1~29天饲喂相同的对照组饲粮,妊娠第30天,按体况将母猪随机分为3组,每组20头,单栏饲养。妊娠第30~90天分别饲喂含1.7%L-丙氨酸(对照组)、1.0%L- 精氨酸和0.1%NCG 的饲粮,妊娠第91天至分娩饲喂对照组饲粮,对照组饲粮添加1.7%L-丙氨酸以满足等氮平衡需要,试验共计84 d。
1.3 试验饲粮
试验饲粮参照美国NRC(1998)妊娠母猪营养需要进行配制。饲粮配方氨基酸平衡参考Dourmad等[7]。对照组和0.1%NCG 添加组饲粮精氨酸水平为0.73%,1.0%L-精氨酸添加组为1.54%(计算值)。饲粮组成及营养水平见表1。
1.4 饲养管理
试验在广西某猪场进行,妊娠母猪采用限位栏饲养,妊娠第1~29天根据母猪体况进行饲喂[(1.8 ~2.0)kg/d];妊娠第 30 天按试验设计给母猪分别饲喂各组饲粮,试验期间每头母猪平均日采食量为 2.5 kg/d,分 2次饲喂(07:00和18:00),母猪在分娩前1周由妊娠舍进入分娩舍,试验过程中因繁殖失败(返情、流产、空怀)、疾病问题的母猪将会被淘汰。饲养管理遵循规模化猪场管理制度进行,每天记录温度、湿度,观察母猪采食情况及健康状况。
1.5 血样收集
每组选择10头母猪,妊娠第30、90和110天采食后2 h[8]用2种灭菌真空采血管(无任何添加剂的血清收集管和含肝素钠的血浆收集管)耳缘静脉采血各5 m L,血样静置10~15 m in,即刻3 000 r/m in离心4~5 m in,将分离得到的血清和血浆分装于0.2 m L EP管中,于-20℃冷冻保存待测血浆氨基酸、尿素和总蛋白浓度及血清免疫球蛋白G(IgG)、免疫球蛋白M(IgM)和PRRSV抗体水平。
1.6 指标测定及方法
1.6.1 血清PRRSV 检测
1.6.1.1 材料 每个组随机抽取6头母猪血样(共计30%试验猪);PRRSV株、阳性及阴性病料均由四川农业大学生物技术中心提供。
1.6.1.2 试剂 主要试剂 RNAiso、RT(反转录)试剂盒、2×Tap PCR Master Mix、DNA 分子质量标准DL 2000等PCR反应试剂均购于大连宝生物公司。
1.6.1.3 引物设计与合成 参照曹洪志等[9]建立的三联PCR诊断猪3种繁殖障碍疾病的方法对PRRSV检测的引物进行RT-PCR检测,扩增基因片段为363 bp。对GenBank中已经发表的10株PRRSV的M基因序列进行同源性分析,利用Prem ier 5.0和Oligo 6.0软件进行PCR引物设计,上游引物为:5'-CCGACTGCTAGGGCTTCT-3',下游引物为:5'-TATCTGCCACCCAACACG-3'。该引物由上海英俊生物技术有限公司合成。
1.6.1.4 病毒 RNA的提取及反转录 按照RNAiso Regent试剂盒说明书提取血清样品中病毒RNA,置于-20℃保存备用。按照RT(反转录)试剂盒说明合成cDNA,采用10μL体系进行:5 ×PrimeScriptTMBuffer 2 μL,PrimeScriptTMRT Enzyme Mix 0.5 μL,random 6 mers 0.5 μL;反转录反应程序:37℃ 20 m in,85℃ 5 s,4℃保存。
1.6.1.5 PCR反应 反转录完成后,采用20μL的反应体系进行PCR扩增,反应体系为:10μL 2×Tap PCR Master Mix,3μL反转录产物cDNA,上、下游引物各 0.5 μL,6μL ddH2O。按照下列条件进行扩增:95.5℃预变性5 m in;95℃循环变性30 s,55 ℃退火复性30 s,72 ℃延伸30 s,30个循环,72℃末延伸10 m in,4℃保存。取扩增产物于10 g/L琼脂糖凝胶中电泳30 m in后在凝胶成像系统中进行观察。

表1 饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of diets(air-dry basis) %
1.6.2 繁殖性能
在母猪分娩当日,详细记录每头母猪产仔数、活仔数、弱仔数(初生体重<900 g)、木乃伊数(早期死胎未形成完整胎儿的不作产仔数记录)、死胎数、初生个体重[在母猪分娩完1 h内完成仔猪单个逐一称重(木乃伊不记重,死胎和活仔均记重)]、初生窝重。
1.6.3 血液指标
血浆游离氨基酸浓度采用四川农业大学动物营养研究所日立L-8800氨基酸全自动分析仪(日本日立公司)进行测定(共检测15种氨基酸);血浆尿素和总蛋白浓度采用TMS1024i全自动生化分析仪(日本东京贸易公司)测定,所用试剂购于迈瑞生化试剂有限公司;采用猪酶联免疫吸附测定法(enzyme-linked immunosorbent assay,ELISA)测定血清PRRSV抗体水平,试剂盒由南京建成生物研究所提供;采用免疫透射比浊法测定血清IgG、IgM水平,试剂盒由浙江伊利康生物技术有限公司提供。
1.7 数据处理
由于试验过程中有9头母猪被淘汰,最终进入数据统计的共计51头:对照组、1.0%L-精氨酸添加组和0.1%NCG添加组分别为18、17和16头。试验数据用Excel 2010初步整理后,采用SPSS 16.0统计软件进行重复数不等的单因素方差分析,并采用Duncan氏检验进行多重比较和显著性分析,弱仔率和死胎率采用χ2检验。除χ2检验指标外,所有数据均以平均值±标准差表示,将P<0.05作为显著性评判标准。
2 结果
2.1 血清PRRSV检测结果
由图1可知,对编号1~6的对照组母猪血清进行PRRSV抗原RT-PCR检测,结果显示均为阳性,剩余样品检测结果与图1结果一致。由于该场爆发过猪繁殖与呼吸综合征(PRRS),定期对母猪血样收集进行RT-PCR检测,发现抽样母猪均为感染PRRSV。本试验中每组随机抽取30%试验母猪血样进行血清PRRSV抗原分析,抽样母猪阳性率达到100%,抽样结果提示所有试验母猪均为感染PRRSV。

图1 母猪血清PRRSV PCR检测代表图Fig.1 Representative picture of PRRSV PCR detection in serum of sows
2.2 饲粮添加L-精氨酸或NCG对妊娠母猪繁殖性能的影响
由表2可知,与对照组相比,1.0%L-精氨酸添加组窝产活仔数提高0.89头(P<0.05),窝活仔重提高1.02 kg(P=0.065),死胎率有所降低,但差异不显著(P>0.05);0.1%NCG添加组窝产活仔数提高0.33头(P>0.05),弱仔率和死胎率均降低,但差异不显著(P>0.05)。1.0%L-精氨酸添加组与0.1%NCG添加组之间均无显著差异(P>0.05),但前者窝产活仔数、初生窝活仔重、弱仔率均高于后者,死胎率低于后者。
2.3 饲粮添加L-精氨酸或NCG对妊娠母猪血浆游离氨基酸浓度的影响
由表3可知,与对照组相比,1.0%L-精氨酸添加组和0.1%NCG添加组妊娠第30天和第110天母猪血浆游离丙氨酸、蛋氨酸、精氨酸、鸟氨酸、脯氨酸浓度无显著差异(P>0.05);1.0%L-精氨酸添加组妊娠第90天母猪血浆游离蛋氨酸、精氨酸、鸟氨酸、脯氨酸浓度显著升高(P<0.05),丙氨酸浓度显著降低(P<0.05);0.1%NCG添加组妊娠第90天母猪血浆游离精氨酸、鸟氨酸、脯氨酸浓度有增加趋势,但差异不显著(P>0.05);1.0%L- 精氨酸添加组较 0.1%NCG 添加组妊娠第90天母猪血浆游离蛋氨酸、精氨酸、鸟氨酸浓度显著升高(P<0.05),丙氨酸浓度显著降低(P<0.05),脯氨酸浓度有增加趋势,但差异不显著(P>0.05)。除此之外,3个组之间其他血浆游离氨基酸浓度之间均无显著差异(P>0.05)。

表2 饲粮添加L-精氨酸或NCG对妊娠母猪繁殖性能的影响Table 2 Effects of dietary supplementation with L-arginine or N-carbamylglutamate on reproductive performance of pregnant sows

表3 饲粮添加L-精氨酸或NCG对对妊娠第30、90和110天母猪血浆游离氨基酸浓度的影响Table 3 Effects of dietary supplementation with L-arginine or N-carbamylglutamate on plasma concentrations of free am ino acids in sow s at day 30,90 and 110 of gestation μmol/L
2.4 饲粮添加L-精氨酸或NCG对妊娠母猪血浆总蛋白和尿素浓度的影响
由表4可知,与对照相比,1.0%L-精氨酸添加组和0.1%NCG添加组妊娠第30天和第110天母猪血浆尿素浓度无显著差异(P>0.05),妊娠第90天母猪血浆尿素浓度显著降低(P<0.05);1.0%L-精氨酸添加组较0.1%NCG添加组母猪血浆尿素浓度无显著差异(P>0.05)。另外,3个组之间血浆总蛋白浓度无显著差异(P>0.05)。
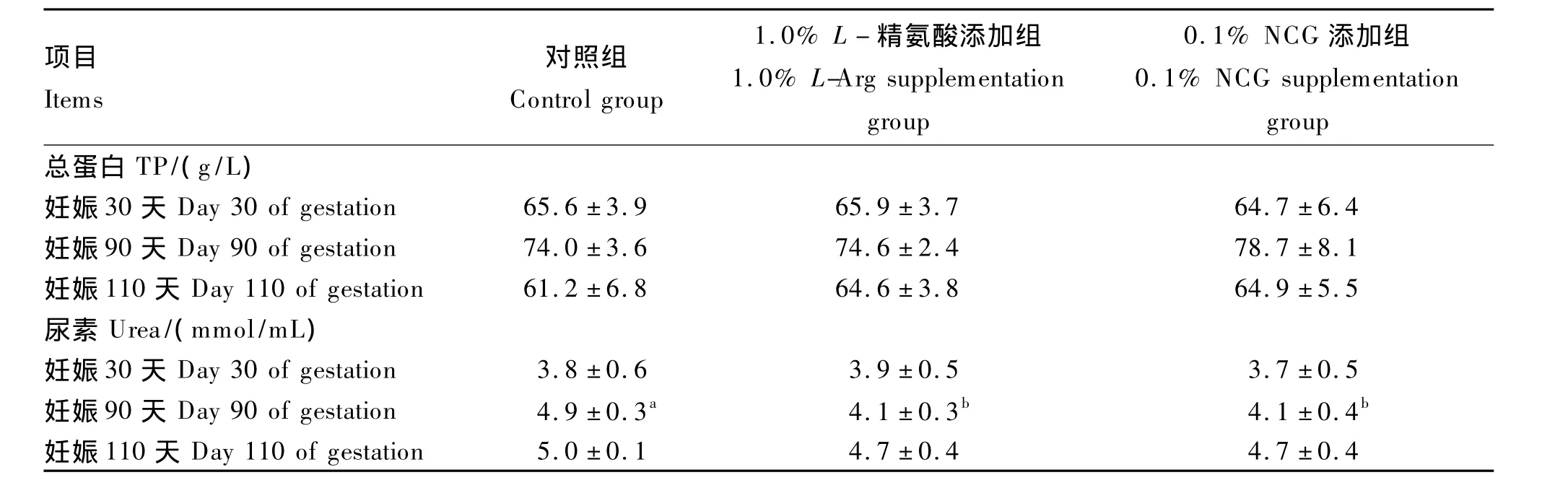
表4 饲粮添加L-精氨酸或NCG对妊娠第30、90和110天母猪血浆总蛋白和尿素浓度的影响Table 4 Effects of dietary supplementation with L-arginine or N-carbam ylglutamate on plasma concentrations of total protein and urea in sows at day 30,90 and 110 of gestation
2.5 饲粮添加L-精氨酸或NCG对妊娠母猪血清免疫球蛋白和PRRSV抗体水平的影响
由表5可知,与对照组相比,1.0%L-精氨酸添加组和0.1%NCG添加组妊娠第30天和第110天母猪血清PRRSV抗体和IgM水平无显著差异(P>0.05),妊娠第90天母猪血清 PRRSV抗体、IgG和IgM 水平显著提高(P<0.05);1.0%L-精氨酸添加组妊娠第110天母猪血清IgG水平显著提高(P<0.05),0.1%NCG 添加组有提高趋势,但无显著差异(P>0.05);1%L-精氨酸添加组较0.1%NCG添加组妊娠第90天母猪血清IgG水平显著提高(P<0.05),但妊娠第30、90和110天PRRSV抗体和IgM水平均无显著差异(P>0.05)。

表5 饲粮添加L-精氨酸或NCG对妊娠第30、90和110天母猪血清IgG、IgM及PRRSV抗体水平的影响Table 5 Effects of dietary supplementation with L-arginine or N-carbamylglutamate on serum levels of IgG,IgMand PRRSV-Ab in sows at day 30,90 and 110 of gestation
3 讨论
在妊娠早期母猪感染PRRSV时,胚胎对PRRSV有一定的封阻作用,妊娠中后期经胎盘感染PRRSV的可能性增加,最终导致母猪产弱仔和死胎增加[1]。本试验研究结果发现妊娠中期给感染PRRSV母猪饲粮添加精氨酸或NCG降低了死胎率,窝产活仔数和窝活仔重增加,且精氨酸的作用尤为明显。精氨酸是母猪妊娠早期胎儿最丰富的氮载体和胎儿组织中沉积最丰富的氨基酸之一[10],同时在尿囊液中含量最高[11],这些都说明精氨酸在胎儿存活、生长及发育中的重要性。Mateo等[2]在妊娠第30~114天给母猪饲粮添加1%精氨酸显著提高了窝产活仔数和窝活仔重。Ramaekers等[3]在妊娠第14~28天给母猪饲喂添加1%精氨酸饲粮,结果增加了1头活产仔数。在大鼠上的研究也发现精氨酸可以提高窝产仔数[12]。以上结果都未发现精氨酸影响个体初生重[2-3],但由于产仔数的增加,因此窝活仔重提高。由此可见,精氨酸的添加时间对妊娠母猪繁殖性能的影响起着重要作用,尤其在妊娠后期精氨酸对感染PRRSV母猪繁殖性能的影响有待进一步研究。另外,NCG作为精氨酸内源合成途径中关键酶CPS-1的有效激活剂,能增加精氨酸的内源合成。本试验研究结果发现饲粮添加NCG窝产活仔数只提高0.33头,这可能与NCG的添加时间及在体内不能促进大量精氨酸的合成及其代谢产物(鸟氨酸和脯氨酸)的增加有关。以前研究表明,子宫容积是限制妊娠早期胚胎存活的主要因素,因此影响了胎儿的生长,最终导致活仔数减少[2]。虽然大部分孕体的损失发生在胚胎植入期,但本研究结果发现妊娠中期饲粮添加精氨酸或NCG降低死胎率,很可能为胎儿的生长和发育提供了一个有利的子宫内环境[13]。
精氨酸或NCG对窝产活仔数、窝活仔重的影响可能通过影响体内代谢过程进而影响妊娠早中期胎盘血管发生和生长,为整个妊娠期建立一个良好的子宫内环境[14]。本试验研究发现妊娠第30~90天饲粮添加精氨酸显著增加了母猪血浆精氨酸及其代谢产物(鸟氨酸和脯氨酸)的含量,从而满足妊娠中期胎盘快速生长发育所需,妊娠第60~70天时胎盘达最大生长[15]。同时,饲粮中添加NCG对母猪血浆精氨酸及其代谢产物(鸟氨酸和脯氨酸)也有提高作用。体外试验也证明,在猪小肠上皮细胞培养液中添加2 mmol/L NCG,由谷氨酰胺和脯氨酸合成的瓜氨酸分别增加了7.7和0.6倍,也显著增加了合成精氨酸的产量[16]。和成年鼠的研究相似,饲粮添加精氨酸增加了胎盘和胎儿NO、多胺、胶原合成所需要的鸟氨酸和脯氨酸[17-18],最终结果将会增加胎盘血管的发生和生长,子宫与胎盘血流量、营养物质从母体到胎儿的转运,从而影响胎儿存活、生长和发育[16,19]。值得注意的是,精氨酸或NCG的添加没有影响到大部分氨基酸的吸收,这说明精氨酸或NCG并不会导致氨基酸的不平衡,但对照组和NCG组中丙氨酸含量较高的原因是由于其作为等氮平衡添加到饲粮中,但并不会影响母猪的繁殖性能[20]。另外,我们还发现饲粮精氨酸的添加显著增加了血浆蛋氨酸的含量。但是,Mateo等[2]在妊娠母猪饲粮添加精氨酸并未发现血浆蛋氨酸含量发生变化,可能是由于动物生理状态不同造成的,具体原因有待进一步研究。饲粮添加精氨酸或NCG减少了机体内氨基酸的降解,从而减少尿素的生成。Kim等[21]研究表明饲粮添加精氨酸降低了新生哺乳仔猪尿素水平,提高了新生仔猪饲粮蛋白质的利用率。本试验结果发现精氨酸或NCG添加减少了尿素的生成,提高了氨基酸的利用率,但并没有影响到血浆总蛋白生成,这就说明窝产活仔数、窝活仔重的增加可能是由于机体提高了对部分氨基酸利用率,从而为胎儿的生长发育提供了更有利的条件。
精氨酸是动物体内NO合成的唯一前体物质,研究表明精氨酸经一氧化氮合酶(NOS)催化生成具有生物活性的NO[17],从而介导免疫反应,并且NCG可间接通过精氨酸代谢过程而发挥作用。因此当母猪感染PRRSV时,妊娠中期通过饲粮添加精氨酸或NCG有助于补充通过NO途径介导的免疫反应。免疫球蛋白是体液免疫应答中发挥免疫功能最主要的免疫分子,在保护胚胎的发育中起着非常重要的作用。Douillard等[22]研究发现精氨酸能提高手术、肿瘤等病理情况下的IgG水平,提示精氨酸能改善机体的体液免疫功能。本试验中血清IgG和IgM水平显著增加,这说明母体体液免疫水平升高,有利于胚胎的生长和发育。但麻名文等[23]在兔上的研究发现精氨酸并没有影响血清IgG和IgM水平,这可能与动物种属和生理状态有关,具体原因还有待进一步研究。血清中PRRSV特异性抗体是抑制PRRSV的指示器[24]。本试验研究结果发现精氨酸或NCG均能显著提高母猪血清PRRSV特异性抗体水平,提示饲粮添加精氨酸或NCG抑制了PRRSV的持续感染,提高了机体免疫力。另外,当动物感染PRRSV后,可能会通过影响与妊娠相关细胞因子水平变化[25-26],且 TH1/TH2 型细胞因子比值增加将会导致妊娠失败[27]。精氨酸可能通过降低TH1/TH2型细胞因子比值,增强其免疫力,为胎儿的生长和发育提供一个有利的子宫内环境,降低死胎率,进而提高母猪繁殖成绩。
4 结论
饲粮中添加L-精氨酸或NCG能通过提高感染PRRSV母猪体内氨基酸的利用率,增强机体免疫力来降低死胎率,提高窝产活仔数和窝活仔重,最终改善母猪繁殖性能。
[1]MENGELING W L,LAGER K M,VORWALD A C.Temporal characterization of transplacental infection of porcine fetuses with porcine reproductive and respiratory syndrome virus[J].American Journal of Veterinary Research,1994,55(10):1391-1398.
[2]MATEO R D,WU G,BAZER FW,et al.DietaryL-arginine supplementation enhances the reproductive performance of gilts[J].The Journal of Nutrition,2007,137(3):652-656.
[3]RAMAEKERSP,KEMP B,VAN DER LENDE T.Progenos in sows increases number of piglets born[J].Journal of Animal Science,2006,84(Suppl.1):394.(Abstract)
[4]LIX,BAZER FW,GREGORY A J,et al.Dietary supplementation with 0.8%L-arginine between days 0 and 25 of gestation reduces litter size in gilts[J].The Journal of Nutrition,2010,140(6):1111 -1116.
[5]QIAO S F,LU T J,SUN JB,et al.A lterations of intestinal immune function and regulatory effects ofL-arginine in experimental severe acute pancreatitis rats[J]. World Journal of Gastroenterol,2005,11(39):6216-6218.
[6]LEW IS B,LANGKAMP-HENKEN B.Arginine enhancesin vivoimmune responses in young,adult and aged m ice[J].Nutrition,2000,130(7):1827 -1830.
[7]DOURMAD JY,ETIENNEM,VALANCOGNE A,etal.InraPorc:A model and decision support tool for the nutrition of sows[J].Animal Feed Science and Technology,2008,143(1):372-386.
[8]WU G,BAZER FW,CUDD T A,etal.Pharmacokinetics and safety of arginine supplementation in animals[J].The Journal of Nutrition,2007,137(6):1673S-1680S.
[9]曹洪志,颜其贵,李成贤.三联PCR诊断猪3种繁殖障碍疾病的方法研究[J].四川畜牧兽医,2010(7):20-22.
[10]WU G,OTT T L,KNABE D A,et al.Am ino acid composition of the fetal pig[J].The Journal of Nutrition, 1999;129(5):1031-1038.
[11]WU G,BAZER FW,TUOW,etal.Unusualabundance of arginine and ornithine in porcine allantoic fluid[J].Biology of Reproduction,1996,54(6):1261-1265.
[12]ZENG X,WANG F,FAN X,etal.Dietary arginine supplementation during early pregnancy enhances embryonic survival in rats[J].The Journal of Nutrition,2008,138(8):1421-1425.
[13]WU G,BAZER FW,WALLACE JM,et al.Intrauterine growth retardation:implications for the animal sciences[J].Journal of Animal Science,2006,84(9):2316-2337.
[14]WU G,BAZER FW,CUDD T A,et al.Maternal nutrition and fetal development[J].The Journal of Nutrition,2004,134(9):2169-2172.
[15]WU G,BAZER FW,HU J,et al.Polyam ine synthesis from proline in the developing porcine placenta[J].Biology of Reproduction,2005,72(4):842 -850.
[16]WU G,JAEGER L A,BAZER FW,etal.Arginine deficiency in preterm infants:biochem ical mechanisms and nutritional implications[J].The Journal of Nutritional Biochem istry,2004,15(8):442-451.
[17]WU G,MORRIS S M Jr.A rginine metabolism:nitric oxide and beyond[J].Biochem ical Journal,1998,336(Part1):1-17.
[18]KOHLIR,MEININGER C J,HAYNES T E,et al.DietaryL-arginine supplementation enhances endothelial nitric oxide synthesis in streptozotocin-induced diabetic rats[J].The Journal of Nutrition,2004,134(3):600-608.
[19]KWON H,WU G,MEININGER C J,et al.Developmental changes in nitric oxide synthesis in the ovine placenta[J].Biology of Reproduction,2004,70(3):679-686.
[20]K IM SW,WU G,BAKER D H.Am ino acid nutrition of breeding sows during gestation and lactation[M].Pigs New s Inform,2005,26:N89-N99.
[21]KIM SW,MCPHERSON R L,WU G.Dietary arginine supplementation enhances the growth of m ilk-fed young pigs[J].The Journal of Nutrition,2004,134(3):625-630.
[22]DOUILLARD J Y,BENNOUNA J,VAVASSEUR F,et al.PhaseⅠ trial of interleukin-2 and high-dose arginine butyrate in metastatic colorectal cancer[J].Cancer Immunol Immunother,2000,49(1):56 -61.
[23]麻名文,李福昌.日粮精氨酸水平对断奶~2月龄肉兔生长性能、免疫器官指数及血清指标的影响[J].动物营养学报,2009,21(3):405 -410.
[24]ALBINA E,PIRIOU L,HUTET E,et al.Immune responses in pigs infected with porcine reproductive and respiratory syndrome virus(PRRSV)[J].Veterinary Immunology and Immunopathology,1998,61(1):49-66.
[25]MEIERW A,GALEOTA J,OSORIO F A,et al.Gradual development of the interferon-gamma response of sw ine to porcine reproductive and respiratory syndrome virus infection or vaccination[J].Virology,2003,309(1):18-31.
[26]SURADHAT S,THANAWONGNUWECH R,POOVORAWAN Y.Upregulation of IL-10 gene expression in porcine peripheral blood mononuclear cells by porcine reproductive and respiratory syndrome virus[J].Journal of General Virology,2003,84:453 -459.
[27]尤昭玲,刘慧萍,雷磊,等.正常妊娠与自然流产模型小鼠Th1/Th2型细胞因子表达的差异[J].中国中医药科技,2009,16(2):133 -134.
*Corresponding author,professor,E-mail:pig2pig@sina.com
(编辑 田艳明)
Effects of DietaryL-arginine or N-carbam ylglutam ate Supp lementation on Reproductive Perform ance and Immune Function of PRRSV-infected Pregnant Sows
YANG Ping1WU De1*CHE Lianqiang1FANG Zhengfeng1LIN Yan1QIAO Shiyan2LIYong3ZENG Yi3SU Xiang3
(1.Key Laboratory for Animal Disease-resistance Nutrition of China Ministry of Education,Institute of Animal Nutrition,Sichuan Agricultural University,Ya’an625014,China;2.National Feed Engineering Technology
Research Center,China Agricultural University,Beijing100193,China;3.Guangxi Shangda Technology Co.Ltd.,Nanning530105,China)
The study was conducted to investigate the effects of dietaryL-arginine(Arg)or N-carbamylglutamate(NCG)supplementation on reproductive performance and immune function of porcine productive and respiratory syndrome virus(PRRSV)-infected pregnant sows.At day 30 of gestation,sixty Yorkshire×Landracemultiparous sows with PRRSV infection were selected and random ly assigned into three groups with 20 pigs in each group.Sows in the control group were fed the diet containing 1.7%alanine,and the others in two experimental groups were fed the diets supplemented with 1.0%L-Arg or 0.1%NCG.Sows were fed the control diet from day 91 to 114 of gestation.Blood sampleswere collected after themorning feed for2 h at day 30,90 and 110 of gestation.Compared with the control group,1.0%L-Arg supplementation increased the number of piglets born alive by 0.89(P< 0.05),and live litter birth weight of piglets by 1.02 kg(P>0.05);0.1%NCG supplementation increased the number of piglets born alive by 0.33(P> 0.05);serum levels of IgM,IgG and PRRSV-Ab from 1.0%L-Arg or0.1%NCG supplementation groupswere significantly higher than those from the control group at day 90 of gestation(P<0.05),and plasma concentration of urea was significantly lower than that from the control group(P<0.05);1.0%L-Arg supplementation increased plasma concentrations ofmethionine,arginine,ornithine and proline at day 90 of gestation,and serum level of IgG at day 110 of gestation compared to the control group(P<0.05);plasma concentrations ofmethionine,arginine,ornithine and proline from the 1.0%L-Arg supplementation group were higher than those from the control group at day 90 of gestation(P<0.05).However,all of themeasured indices did not differ between the 1.0%L-Arg and 0.1%NCG supplementation groups(P>0.05),but plasma concentrations of methionine,arginine and ornithine from the 1.0%L-Arg supplementation group were significantly higher than those from the 0.1%NCG supplementation group at day 90 of gestation(P<0.05).The results of this study indicate that dietaryL-Arg or NCG supplementation can improve the reproductive performance of pregnant sow s by improving the utilization of am ino acids and immune function.[Chinese Journal of Animal Nutrition,2011,23(8):1351-1360]
L-Arg;NCG;PRRSV;pregnant sows;reproductive performance;immune
S 828;S816.7
A
1006-267X(2011)08-1351-10
10.3969/j.issn.1006-267x.2011.08.014
2011-03-07
杨 平(1986—),男,四川成都人,硕士研究生,从事动物营养与饲料开发研究。E-mail:yp20041107@163.com
*通讯作者:吴 德,教授,博士生导师,E-mail:pig2pig@sina.com

