饲粮蛋白质水平对肥育猪背最长肌嫩度及骨骼肌特异性蛋白-核转录因子κB信号途径的影响
张 勇 崔 岩 陶 亮 朱宇旌 邓 科 孙 璀 邵彩梅
(1.沈阳农业大学畜牧兽医学院,沈阳 110866;2.辽宁禾丰牧业股份有限公司,沈阳 110164)
饲粮蛋白质水平对肥育猪背最长肌嫩度及骨骼肌特异性蛋白-核转录因子κB信号途径的影响
张 勇1崔 岩1陶 亮1朱宇旌1邓 科1孙 璀1邵彩梅2
(1.沈阳农业大学畜牧兽医学院,沈阳 110866;2.辽宁禾丰牧业股份有限公司,沈阳 110164)
本试验旨在研究饲粮理想蛋白质水平对背最长肌嫩度及骨骼肌特异性蛋白-核转录因子κB(P94-NFκB)信号途径相关蛋白和钙蛋白酶抑制蛋白(CAST)mRNA表达量的影响。选择初始重约50 kg的杜洛克×长白×大白三元杂交猪90头,随机分配到3个处理,每个处理3个重复,每个重复10头,公母各占1/2。3个处理分别采用12%、16%、20%理想蛋白质水平的饲粮,饲粮能量水平相同。正试期58 d,结束后屠宰取样,测定肌肉剪切力并利用实时定量PCR法测定猪背最长肌P94、NFκB、核转录因子抑制物(IκB)和CAST mRNA表达量。结果表明:1)饲粮蛋白质水平对背最长肌剪切力、P94、NFκB、IκB和CAST mRNA表达量有显著影响(P<0.05);随饲粮蛋白质水平升高,背最长肌剪切力、IκB和 CAST mRNA表达量升高、P94和NFκB mRNA 表达量降低。2)背最长肌剪切力与 IκB(相关系数为 0.513,P<0.05)、CAST mRNA表达量(相关系数为0.816,P<0.01)呈正相关。3)CAST与P94 mRNA表达量呈负相关(相关系数为 -0.496,P<0.05),与 IκB mRNA 表达量呈正相关(相关系数为 0.710,P<0.01)。4)P94 与 NFκB mRNA 表达量呈正相关(相关系数为 0.550,P<0.05),与 IκB mRNA表达量呈负相关(相关系数为-0.518,P<0.05);IκB与NFκB mRNA表达量呈负相关(相关系数为-0.539,P<0.05)。结果提示:饲粮高蛋白质水平提高了猪背最长肌剪切力、CAST和IκB mRNA表达量,降低了肌肉嫩度和P94 mRNA表达量;猪背最长肌P94-NFκB信号途径在肌肉嫩度调控过程中发挥一定作用,但不是主要途径。
蛋白质水平;钙蛋白酶抑制蛋白;骨骼肌特异性蛋白;核转录因子κB;肌肉嫩度
肉品质直接影响到养殖业、肉类加工业和批发零售业效益以及广大消费者的切身利益,如何提高肉品质已成为当今学者共同关心的一项重大课题。嫩度作为评价肉品质的重要指标而倍受瞩目。在肌肉组织中,钙蛋白酶系(calpains)控制着肌纤维蛋白的降解,这一过程是肌肉蛋白质降解的限速步骤[1],钙蛋白酶系在肌肉纤维更新及宰后的嫩化中扮演着重要角色[2]。骨骼肌特异性蛋白酶(P94,又名 calpain-3、CAPN3)和钙蛋白酶抑制蛋白(calpastatin,CAST)都属于钙蛋白酶系统的一员。核转录因子κB(NFκB)广泛存在于真核生物中,是一个由复杂的多肽亚基组成的蛋白质家族,在肌细胞形成、肌细胞再生和细胞增殖中发挥了重要作用。骨骼肌特异性蛋白酶-核转录因子κB(P94-NFκB)信号途径与肌细胞核凋亡密切相关。近年来,对P94的研究多集中于P94多态性的分析[3-4],对 NFκB 和核转录因子抑制物(IκB)的研究多集中在干细胞生物学领域及肌肉疾病的研究[5-6],在动物营养中的应用很少,并且对 P94-NFκB信号途径与肌肉嫩度的联系更是鲜见报道。曾有报道利用分子生物学技术手段研究饲粮营养水平对肌肉嫩度的影响,从微观角度探讨相关基因表达对肌肉嫩度的调控机制。本试验考察饲粮理想蛋白质水平对生长肥育猪肌肉CAST和P94-NFκB信号途径的影响,明确 CAST与 P94-NFκB信号途径在猪肌肉嫩度调控中的作用,为改善猪肉品质提供依据。
1 材料与方法
1.1 试验仪器
数显式肌肉嫩度仪(C-LM 3型,东北农业大学工程学院研制);高速台式冷冻离心机(TGL-20M,长沙湘仪离心机仪器有限公司);紫外分光光度计(Cary 50 Probe,美国 Varian公司);基因扩增仪[TC-96/G/H(6),杭州博日科技有限公司];PCR仪(ABIPRISM 7000 HT Real-Time RCR System,美国ABI公司);凝胶成像系统(江苏捷达)。
1.2 试验试剂
RNA提取试剂盒(RNAiso Reagent)、荧光定量PCR(real time-PCR,RT-PCR)试剂盒[SYBRPrimeScriptTMRT-PCR Kit(Perfect Real Time)]、DEPC水、DNA分子量标准(DL2000)、50 bp DNA Ladder Marker均购自于TaKaRa公司;琼脂糖购自于宝泰克(西班牙)公司;其他常用化学试剂均为国产分析纯。
1.3 试验动物与试验设计
本试验采用完全随机区组试验设计,选择初始重约50 kg的杜洛克×长白×大白三元杂交猪90头,随机分配到3个处理,每个处理3个重复,每个重复10头,公母各占1/2。3个处理分别采用12%、16%、20%理想蛋白质水平的饲粮,饲粮能量水平相同,正试期58 d,参照NRC(1998)肥育猪的营养需要配合成粉状全价料,饲粮消化能保持相同。饲粮组成及营养水平见表1。
1.4 饲养管理
试验前进行驱虫、防疫、编号等工作。试验猪水泥地面单圈饲养,自由采食,以鸭嘴式饮水器提供充足清洁饮水,日饲喂3次,清粪3次,保持舍内清洁,随时观察并记录饲养期间猪的食欲、精神状况、粪便等情况。
1.5 样品采集制备
为了使胴体尽量少受破坏,肉样采集位置为猪最后肋骨和最后腰椎间的单侧背最长肌,采样400 g,用于肉品质测定;并在最短的时间内于第13~16肋骨间取猪背最长肌样本30 g,放入锡箔纸中包好,用液氮迅速冷冻,之后放于-80℃保存备用。
1.6 肌肉嫩度测定
采用C-LM 3型数显式肌肉嫩度仪测定肉样剪切力值,具体试验步骤参考张勇等[7-8]文献。
1.7 利用RT-PCR测定相关蛋白m RNA表达量
1.7.1 总 RNA 提取
参照RNA提取试剂盒推荐方法,提取猪背最长肌样品总RNA。提取后的RNA用紫外分光光度计在260 nm和280 nm处测定吸光度值,根据OD260nm/OD280nm检验纯度,并按如下公式计算RNA的浓度:

1.7.2 cDNA 合成
按照RT-PCR试剂盒操作方法进行。cDNA合成后放-20℃保存备用。
1.7.3 引物设计与合成
本试验选择β-肌动蛋白(β-actin)作为内参,用相对定量的方法,测定肥育猪 P94、NFκB、IκB、CAST的mRNA相对表达量。引物均由TaKaRa宝生物工程(大连)有限公司合成,引物序列及参数见表2。
1.7.4 RT-PCR
β-actin、P94、NFκB、IκB PCR 扩增反应的反应体系均为25μL:TaKaRa SYBR Prem ix Ex Taq(2×)12.5 μL,上游、下游引物各 0.5 μL(10 μmol/L),Rox Reference Dye(50 × )0.5 μL,模板cDNA溶液2μL,RNase-free H2O 9μL。
反应条件:94℃预变性5 m in;94℃变性30 s,59~63℃退火30 s(具体基因的退火温度见表2),72℃延伸45 s,40个循环;72℃最后延伸2 m in。

表1 饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of diets(air-dry basis) %
1.7.5 电泳
将预先配制好的加溴化乙锭(EB)的1%琼脂糖凝胶融化,冷却至约60℃,倒入装好梳子的胶槽内,使凝胶厚度为5~7 mm,待凝胶完全凝固后,小心移去梳子,将凝胶放入装有1×TAE电泳缓冲液的电泳槽中,将5μL PCR产物与1μL电泳上样缓冲液(6×Loading buffer)混合后,点样。同时于样品旁边点5μL DL2000 DNA Maker作为分子量标记,110 V电压电泳20 m in。紫外线下观察结果,并拍照记录。
1.8 数据统计与分析
用中国科学院沈阳应用生态研究所的ABI Prism 7000 SDS software 1.5进行相对定量分析。采用2-△△Ct的计算方法计算出目的基因的相对表达量,用 SPSS 16.0对数据进行统计分析,并用LSD法和Duncan氏法进行多重比较,结果用平均值±标准差表示。
2 结果
2.1 背最 长 肌剪 切 力 及 P94、NFκB、IκB 和CAST m RNA表达量
从表3可见,背最长肌剪切力随饲粮蛋白质水平的升高而升高,20%组显著高于12%、16%组(P<0.05)。猪背最长肌 P94、NFκB mRNA 表达量随饲粮蛋白质水平的升高而降低,其中P94 mRNA表达量在20%组与12%、16%组之间差异显著(P<0.05),而 NFκB mRNA 表达量在不同组之间差异不显著(P>0.05)。猪背最长肌 IκB、CAST mRNA表达量随饲粮蛋白质水平的升高而升高,其中IκB mRNA表达量20%组与16%组之间差异显著(P<0.05),20%组与12%组差异极显著(P<0.01),而 CAST mRNA表达量在20%组与12%、16%组之间差异极显著(P<0.01)。所有基因mRNA表达量在16%组与12%组之间差异均不显著(P>0.05)。

表2 引物序列及实时定量PCR反应条件Table 2 Primer sequences and the conditions for real-time PCR
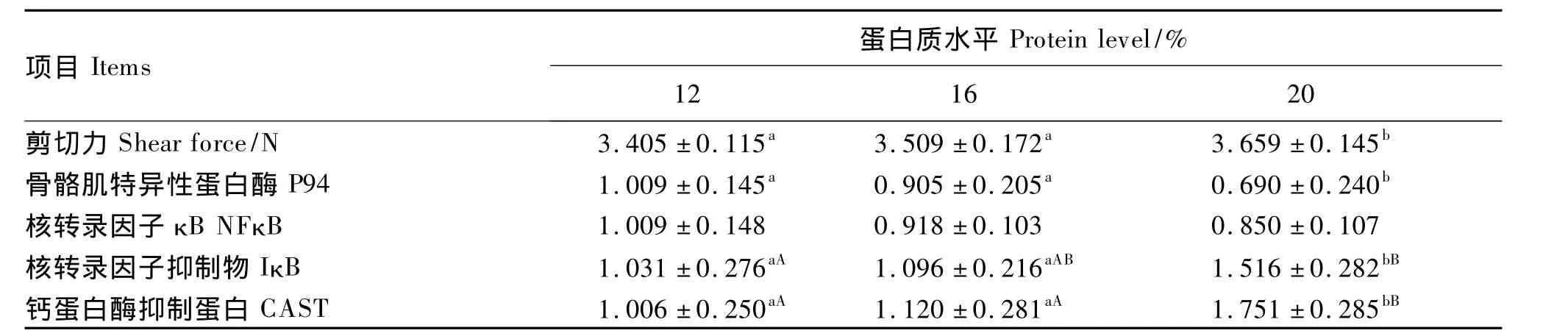
表3 饲粮不同蛋白质水平对猪背最长肌剪切力及P94、NFκB、IκB和CAST m RNA相对表达量的影响Table 3 Effects of dietary protein level on the shear force and P94、NFκB、IκB and CAST mRNA relative expression levels of longissimus dorsi in pigs
2.2 背最 长肌剪 切 力 与 P94、NFκB、IκB 和CAST m RNA表达量相关性
由表4可见,背最长肌剪切力与 P94、NFκB mRNA表达量呈负相关,剪切力随背最长肌P94、NFκB mRNA表达量的降低而升高,相关系数分别为-0.453、-0.181,但相关性不显著(P>0.05)。背最长肌剪切力与IκBmRNA表达量呈正相关,剪切力的值随背最长肌IκB mRNA表达量的升高而升高,相关系数为0.513,相关性显著(P<0.05)。背最长肌剪切力与CAST mRNA表达量呈正相关,剪切力随背最长肌CAST m RNA表达量的升高而升高,相关系数为0.816,相关性极显著(P<0.01)。
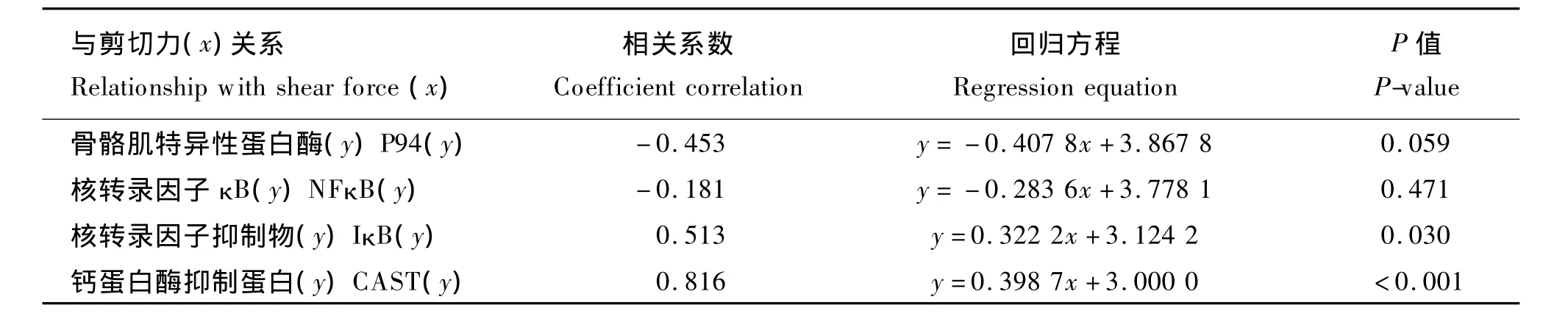
表4 猪背最长肌剪切力与P94、NFκB、IκB和CAST m RNA相对表达量回归方程Table 4 Regression equations between shear force and mRNA relative expression levels of P94,NFκB,IκB and CAST of longissimus dorsi in pigs
2.3 背最长肌 P94、NFκB、IκB 与 CAST m RNA表达量的相关性
由表5可见,CAST与P94、NFκB mRNA表达量呈负相关,相关系数分别为 -0.496、-0.224,其中CAST与P94 mRNA表达量的相关性显著(P<0.05)。CAST 与 IκB mRNA 表达量呈正相关,相关系数为0.710,相关性极显著(P<0.01)。
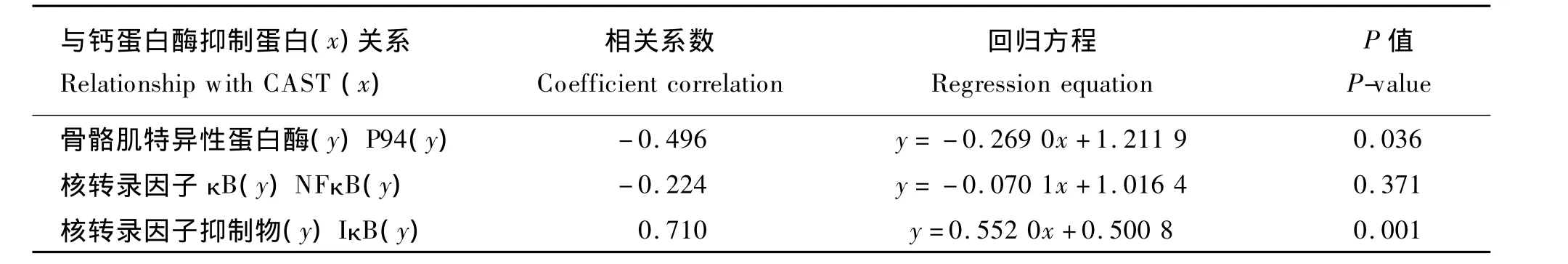
表5 猪背最长肌CAST与P94、NFκB、IκB m RNA相对表达量回归方程Table 5 Regression equations formRNA relative expression levels of CAST and P94,NFκB and IκB of longissimus dorsi in pigs
2.4 背最长肌 P94、NFκB、IκB m RNA 表达量三者之间的相关性
由表6可见,P94与NFκB mRNA表达量呈正相关,相关系数为0.550,随着P94 mRNA表达量的增加,NFκB mRNA表达量也随之增加,相关性显著(P<0.05)。P94与 IκB mRNA 表达量呈负相关,相关系数为 -0.518,随着P94 mRNA表达量的增加,IκB mRNA表达量降低,相关性显著(P<0.05)。IκB 与 NFκB mRNA 表达量呈负相关,相关系数为 -0.539,随着 IκB mRNA 表达量的增加,NFκB mRNA表达量降低,相关性显著(P<0.05)。
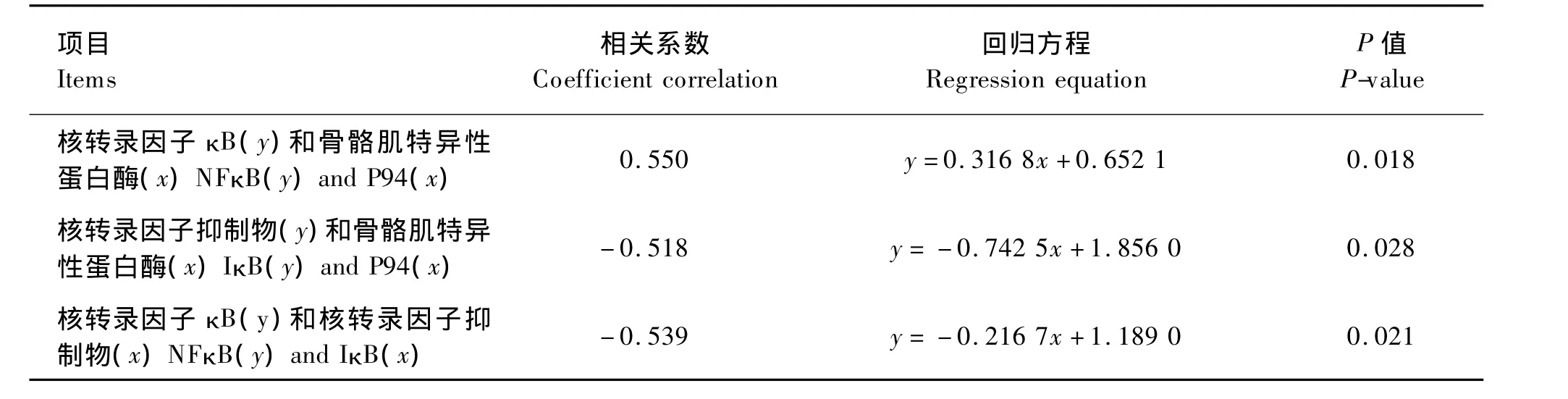
表6 猪背最长肌P94与NFκB、IκB m RNA相对表达量回归方程Table 6 Regression equations formRNA relative expression levels of NFκB,P94 and IκB of longissimus dorsi in pigs
3 讨论
3.1 理想蛋白质水平对猪背最长肌剪切力的影响
理想蛋白质是氨基酸平衡最佳的蛋白质。饲粮蛋白质不足,肌肉蛋白质合成受阻,未被利用的能量以脂肪的形式沉积下来,使肌内脂肪含量增加;提高饲粮蛋白质水平有促进蛋白质沉积的作用。Davey等[9]发现,用高蛋白质饲粮饲喂瘦肉型猪,可提高瘦肉率,降低肌肉内脂肪水平,肉的嫩度下降。Goerl等[10]研究了饲粮蛋白质水平对28~104 kg猪肉品质的影响,同样发现,随饲粮蛋白质水平的增加,胴体背膘厚下降、瘦肉率增加、肉嫩度下降。张克英等[11]研究表明,随饲粮理想蛋白质水平的提高,肌肉率趋于增加、肌肉脂肪含量显著下降。何若钢等[12]采用3个能量水平和3个蛋白质水平对生长期特种野猪屠宰性能的影响进行了评定,肌肉剪切力、瘦肉率随饲粮蛋白质水平的增加而增加。在本试验中随着饲粮蛋白质水平的提高,肌肉剪切力也随之提高,与上述研究结果相一致。低蛋白质水平能提高肉的嫩度,其原因可能是肌肉内脂肪含量的升高和低蛋白质饲粮促使体内蛋白质周转加快所致。
3.2 理想蛋白质水平对 CAST和 P94-NFκB信号途径相关蛋白m RNA表达量的影响
随着营养基因组学的不断发展,营养水平与基因型之间的互作逐步被人们所认识。钙蛋白酶系统在骨骼肌肌丝蛋白降解过程中起到重要作用,存在于绝大多数细胞中[13]。饲粮蛋白质水平会影响动物机体内的蛋白质周转代谢,有可能也会影响骨骼肌中有关蛋白质降解的基因。本试验结果表明,随着饲粮理想蛋白质水平的升高,CAST mRNA表达量显著升高,而P94 mRNA表达量显著降低。P94是calpains的成员之一,而CAST正是calpains的抑制剂,CAST mRNA表达量的增加或减少必然会引起calpainsmRNA表达量的减少或增加,这与本试验结果相符合。Senskypl等[14]曾研究表明,注射生长激素和饲喂β-兴奋剂克伦特罗均可改变背最长肌CAST mRNA表达量,但P94与NFκB未发生变化,提出生长激素和β-兴奋剂对CAST mRNA表达的调控与P94-NFκB信号途径无关。本试验中饲粮理想蛋白质水平对P94、IκB mRNA表达量有显著影响,但对NFκB mRNA表达量无显著性影响,这表明理想蛋白质水平对P94-NFκB信号途径存在一定影响,但具体的影响机制还需要进一步研究。
3.3 CAST和P94-NFκB信号途径对肌肉嫩度的影响
肉的嫩度好坏是肌肉内部结构的反映,在一定程度上反映了肌原纤维、结缔组织以及肌肉脂肪的含水量、分布和化学结构[15]。CAST是细胞内专一抑制calpain活性的蛋白质,CAST是通过抑制calpain的自溶作用而发挥作用的,且这种抑制作用并不受 pH 的影响[16]。Delgado 等[17]发现,降解后的CAST同样具有抑制calpain的活性,并发现肉的嫩化与CAST活性及降解速度有关。Melody等[18]研究表明,CAST与肌肉发育之间存在密切关系,CAST能提高肌肉的嫩度,指出通过调节calpain和CAST的活性可调节肌肉的发育,从而提高家畜的瘦肉率和产出率,提高肌肉的质量。Koohmaraie等[19]研究认为,高水平的 CAST抑制宰后肌肉蛋白水解和嫩化。程丰等[20]发现,CAST的基因型与猪肉的嫩度存在相关性,为CAST作为猪肉嫩度的候选基因奠定了基础。武艳群等[21]试验进一步证明CAST是一个与肉质相关性非常高的候选基因。曾有试验表明CAST mRNA表达量与肌肉嫩度显著相关[7-8]。本试验结果同样证实CAST与肌肉嫩度存在显著相关性,CAST mRNA表达量的增加降低猪背最长肌嫩度。
P94-NFκB信号途径与肌细胞凋亡密切相关。Ouali等[22]推断,动物宰后应该有一个细胞凋亡的过程,从微观角度看,肌肉的成熟嫩化是肌细胞发生凋亡进而继发性坏死的过程,因此,细胞凋亡与肌肉的成熟嫩化有着密切的关系。P94是骨骼肌NFκB信号途径的上游调节者,调节相关基因表达,维持肌核功能。2A型脐带型肌营养不良症患者肌肉中P94的表达缺陷导致IκB-α在患者肌肉中积累,从而减弱NFκB对基因表达的调控,导致肌核程序性细胞凋亡[23]。Ojima等[24]探讨了 P94在骨骼肌细胞信号调节途径中的作用,试验结果指出P94受肌纤维的种类、肌纤维的收缩、肌节的成熟化的影响。Kimberly等[25]研究发现鼠的肌肉营养失调主要是由P94的活性引起的。Murphy等[26]在鼠的骨骼肌中发现P94的活性与肌纤维密切联系。沙玉圣等[27]试验证明通过上调半腱肌P94 mRNA的表达可显著改善半腱肌的嫩度。但Parr等[28]的研究表明,P94与猪背最长肌的嫩度并没有直接的关系。本试验结果显示:P94 mRNA表达量与猪背最长肌嫩度存在负相关性,但是相关性不显著,本结果与Parr等的结论相符合。本试验结果也显示NFκB mRNA表达量与猪背最长肌嫩度没有相关性,这表明P94-NFκB信号途径与猪背最长肌嫩度并无明显关系。对于P94-NFκB信号途径与肌肉嫩度的研究国内外鲜见报道,其间具体的相关性还有待研究。
4 结论
①饲粮高蛋白质水平提高了猪背最长肌剪切力、降低了肌肉嫩度。
②饲粮高蛋白质水平提高了猪背最长肌CAST mRNA表达量;对P94-NFκB信号途径上游调节者显著降低了P94和IκB mRNA表达量分别起到降低和提高的作用。
③猪背最长肌剪切力与IκB mRNA表达量呈显著正相关、与 P94、NFκB mRNA表达量呈不显著负相关,表明猪背最长肌P94-NFκB信号途径在肌肉嫩度调控过程中发挥一定作用,但不是主要途径。
[1]HUANG J,NEIL E F.Role of calpain in skeletalmuscle protein degradation[J].Proceedings of the National Academy of Sciences of the United States of America,1998,95:12100-12105.
[2]HOPKINSD L,THOMPSON JM.Inhibition of protease activity.Part1.The effecton tenderness and indicators of proteolysis in ovinemuscle[J].Meat Science,2001,59:175-185.
[3]ILIAN M A,BEKHIT A E D,STEVENSON B,et al.Up and down-regulation of longissimus tenderness parallels changes in themyofibril-bound ealpain 3 protein[J].Meat Science,2004,67:433 -445.
[4]LARSEN N J,KENEALY S,TUGGLE C K,et al.Rapid communication:a HincⅡmorphism in the porcine calpain,large polypeptide L3(CAPN3)gene[J].Journal of Animal Science,1998,76:918 -919.
[5]MATSUO H, TAMURA M,KABASHIMA N.Prednisolone inhibits hyperosmolarity-induced expression of MCP-1 via NF-kappaB in peritonealmesothelial cells[J].Kidney International,2006,69(4):736-746.
[6]KAFOURY R M,HEMANDEZ JM,LASKY JA,et a1.Activation of transcription factor IL-6(NF-IL-6)and nuclear factor-kappaB(NF-kappaB)by lipid ozonation products is crucial to imerleukin-8 gene expression in human airway epithelial cells[J].Environmental Toxicology,2007,22(2):159-168.
[7]张勇,高彦,朱宇旌,等.不同饲喂方式对猪背最长肌钙蛋白酶抑制蛋白和钙蛋白酶基因表达及剪切力的影响[J].动物营养学报,2010,22(3):640-646.
[8]张勇,李方方,朱宇旌,等.日粮不同蛋白质水平对猪骨骼肌钙蛋白酶抑制蛋白和钙蛋白酶基因表达及嫩度的影响[J].动物营养学报,2008,20(3):360-365.
[9]DAVEY R J.Grow th and carcass characteristics of high-and low-fatsw ine fed diets varying in protein and lysine content[J].Journal of Animal Science,1976,43:598-605.
[10]GOERL K F,EILERT S J,MANDIGO RW,et al.Pork characteristics as affected by two populations of sw ine and six crude protein levels[J].Journal of Animal Science,1995,73:3621-3626.
[11]张克英,陈代文,罗献梅,等.饲粮理想蛋白水平对猪肉品质的影响[J].四川农业大学学报,2002,20(1):37-39.
[12]何若钢,冯誉龄,李秀宝,等.不同能量和但蛋白水平对生长期特种野猪屠宰性能的影响[J].黑龙江畜牧兽医,2009(4):112-113.
[13]ILIAN M A,BEKHITA E D,BICKERSTAFFE R.The relationship between meat tenderization,myofibril fragmentation and autolysis of calpain 3 during post-mortem aging[J].Meat Science,2004,66:387-397.
[14]SENSKYP L,JEWELL K K,RYAN K J,et al.Effect of anabolic agents on calpastatin promoters in porcine skeletalmuscle and their responsiveness to cyclic adenosine monophosphate and calcium-related stimuli[J].Journal of Animal Science,2006,84(11):2973-2982.
[15]李德发.营养调控肉品质量的研究现状及发展趋势[C]//动物营养研究进展论文集.北京:农业科技出版社,2004:7-14.
[16]ROMAN L,HRUSKA U S.Effect of calpastatin on degradation of myofibrillar proteins by calpain under postmortem conditions[J].Journal of Animal Sci-ence,1999(7):685-692.
[17]DELGADO E F,GEESIN G H,MARCHELLO JA,et al.The calpain system in three muscles of normal and callipyge sheep[J].Journal of Animal Science,2001,79:398-412.
[18]MELODY J L,LONERQAN S M,ROWE L J,et al.Early postmortern bilchem ical factor influence tenderness and water-holding capacity of three porcine musles[J].Journal of Animal Science,2004,82:1195-1205.
[19]KOOHMARAIE M,GEESINK G H.Contribution of postmortem muscle biochem istry to the delivery of consistent meat quality with particular focus on the calpain system[J].Meat Science,2006,74:34 -43.
[20]程丰,赵云焕,易本驰,等.猪 CAST基因 PCRRFLPs与肉质相关性的分析[J].河南农业科学,2006(2):103-106.
[21]武艳群,吴旧生,赵晓枫,等.猪CAST基因与肌纤维组织学特性及屠宰性状的相关性分析[J].遗传,2007,29(1):65 -69.
[22]OUALIA,HERRERA-MENDEZ C H,COULIS G,et al.Revisiting the conversion of muscle into meat and the underlying mechanisms[J].Meat Science,2006,74:46-48.
[23]SORIMACHI H,ONO Y,SUZUKI K.Skeletal muscle-specific calpain,p94 and connectin/titin:their physiological functions and relationship to limb-girdle muscular dystrophy type 2A[J].Advances in Experimental Medicine and Biology,2000,481:383-395.
[24]OJIMA K,ONO Y,HATA S,et al.Possible functions of p94 in connectin-mediated signaling pathways in skeletal muscle cells[J].Journal of Muscle Research and CellMotility,2005,26(6/8):409-417.
[25]KIMBERLY A,HUEBSCH E K,CHRISYINE M W,et al.Mdm muscular dystrophy:interactionswith calpain 3 and a novel functional role for titin’s N2A domain[J].Human Molecular Genetics,2005,19(14):2801-2811.
[26]MURPHY R M,VERBURH E,LAMB G D.Ca2+activation of diffusible and bound pools ofμ-calpain in rat skeletalmuscle[J].The Journal of Physiology,2006,576(2):595-612.
[27]沙玉圣,王谭稳,杨晓静,等.半胱胺对育肥山羊生长及肌肉嫩度的影响[J].中国农业科学,2007,40(5):1010-1016.
[28]PARR T,SENSKY P L,SCOTHERN G P,et al.Relationship between skeletalmuscle-specific calpain and tenderness of conditioned porcine longissimus muscle[J].Journal of Animal Science,1999,77:661-668.
Author,ZHANG Yong,professor,E-mail:syndzhy@yahoo.com.cn
(编辑 王智航)
Dietary Protein Level A ffects the Tenderness and P94-NFκB Signaling Pathway of Longissim us Dorsi in Finishing Pigs
ZHANG Yong1CUIYan1TAO Liang1ZHU Yujing1DENG Ke1SUN Cui1SHAO Caimei2
(1.School of Animal Science and Veterinary,Shenyang Agricultural University,Shenyang110866,China;2.Liaoning Wellhope Agri-Tach Co.Ltd.,Shenyang110164,China)
The study was conducted to investigate the effect of dietary ideal protein level on tenderness and mRNA expression levels of P94-NFκB signaling pathway related to proteins and CAST of longissimus dorsi in finishing pigs.Ninety crossbred pigs(Duroc × Landrace × Large white,about 50 kg BW)were random ly allocated into 3 treatments with 3 replicates per treatment and 10 heads per replicate.Pigs in the three treatments were fed dietswith the same energy level and ideal protein levels at12%,16%and 20%,respectively.A ll pigs were slaughtered after 58 days experiment and then muscle samples were collected for the analysis of shear force,meanwhile,mRNA expression levels of P94,NFκB,IκB and CAST of longissimus dorsi in pigs were determ ined by real-time PCR.The results showed as follow s:1)there were significant effects of dietary protein level on shear force and the mRNA expression levels of P94,NFκB,IκB and CAST of longissimus dorsi(P<0.05);with the increasing of dietary protein level,the shear force and mRNA expression level of IκB and CAST were increased,but that of P94 and NFκB were decreased.2)the shear force was positively correlated with the mRNA expression levels of IκB(coefficient correlation=0.513,P< 0.05)and CAST(coefficient correlation=0.816,P<0.01).3)ThemRNA expression level of CAST was negatively correlated with that of P94(coefficient correlation= -0.496,P<0.05),but positively correlated with that of IκB(coefficient correlation=0.710,P<0.01).4)ThemRNA expression level of P94 was positively correlated with thatof NFκB(coefficient correlation=0.550,P<0.05),butnegatively correlated with thatof IκB(coefficient correlation= - 0.518,P< 0.05);the mRNA expression levels of IκB and NFκB were negatively correlated(coefficient correlation= -0.539,P<0.05)to each other.The results indicate that high dietary protein level can increase the shear force and themRNA expression levels of CAST and IκB,but decrease the tenderness and themRNA expression level of P 94;P94-NFκB signaling pathway plays a role in the process of regulating muscle tenderness,but it is not themain pathway.[Chinese Journal of Animal Nutrition,2011,23(8):1342-1350]
protein level;CAST;P 94;NFκB;muscle tenderness
S828
A
1006-267X(2011)08-1342-09
10.3969/j.issn.1006-267x.2011.08.013
2011-02-14
国家自然科学基金“钙蛋白酶调控猪体蛋白降解的信号途径研究”(30972112)
张 勇(1972—),男,甘肃武威人,教授,博士,硕士生导师,主要从事分子营养学与饲料资源开发利用研究。E-mail:syndzhy@yahoo.com.cn

