不同植物油脂对体外培养条件下培养液酶活及微生物活力的影响
王 曙 王梦芝* 卢占军 董淑红 张 鑫 王洪荣
(1.扬州大学动物科学与技术学院,扬州 225009;2.赣南师范学院,赣州 341000)
不同植物油脂对体外培养条件下培养液酶活及微生物活力的影响
王 曙1王梦芝1*卢占军2董淑红1张 鑫1王洪荣1
(1.扬州大学动物科学与技术学院,扬州 225009;2.赣南师范学院,赣州 341000)
本文旨在研究不同饱和程度的植物油脂对体外培养条件下培养液酶活及微生物活力的影响。试验以3头装有瘤胃瘘管的山羊提供瘤胃液,采用单因子试验设计,对照组不加油脂,试验组分别添加花生油、菜籽油、玉米油和豆油进行体外培养。结果表明:乳酸脱氢酶、谷草转氨酶、谷丙转氨酶3种酶的活性都以菜籽油组最高,豆油组、玉米油组、花生油组依次降低,除花生油组外,其他试验组均显著高于对照组(P<0.05),且试验组间存在显著差异(P<0.05)。总脱氢酶以豆油组最高,显著高于对照组(P<0.05),并依次显著高于玉米油组、花生油组和菜籽油组(P<0.05)。此外,油脂组原虫DNA、细菌DNA、微生物DNA、原虫/细菌区系比例的均值与对照组,以及试验组间差异均不显著(P>0.05),但随着培养时间的延长其动态变化模式不尽相同。微生物DNA在各时间点都以豆油组与玉米油组的较高;而原虫/细菌比例则以豆油组和玉米油组较低。综上所述,饱和程度不同的油脂对体外培养瘤胃微生物区系及其微生物细胞活力影响不同,其中以豆油促进微生物活力的效应最佳,玉米油较好。
油脂;瘤胃微生物;转氨酶;脱氢酶;体外
油脂作为能量饲料,对畜禽生产至关重要。但有报道认为,不饱和的油脂使用超过一定的量时,其降解产生的游离脂肪酸的不饱和键将会毒害瘤胃原虫和部分细菌,减少微生物的群体量并可能改变其群体结构,进而影响正常的微生物代谢与瘤胃发酵[1-2]。若能够借助油脂的这种负面效应,科学使用油脂,则可能达到在一定程度上抑制原虫群体量和其对细菌的吞噬力,进而增加细菌量、降低原虫与细菌区系比例、提高微生物生物总量,促进瘤胃发酵的效果。研究表明,各区系微生物(细菌、原虫、真菌和甲烷菌)因各自特点而对不饱和油脂的响应也不尽一致,如没有体壁的原虫对油脂较其他微生物为敏感[1],本实验室前期对微生物微循环的研究也发现适量比例、且适当结构的油脂能够抑制原虫吞噬细菌的微生物再循环、增加了细菌生物量,对原虫和细菌区系有一定的控调效应[3]。因此,利用广泛易得、经济实用的油脂能量饲料作为瘤胃调控剂,增强瘤胃内酶和微生物活性、促进发酵,而最终实现饲料碳素、氮素的利用效率和宿主动物的生产力是可行而又实践意义的。关于油脂的研究多以影响瘤胃的微生物、发酵、甲烷产量等为主[4-6],迄今尚未见关于影响微生物转氨酶、脱氢酶等细胞活力方面的研究报道。鉴于此,本试验拟选用4种植物油脂分别进行体外培养,测定体系中转氨酶、脱氢酶等的活性,以研究饱和程度不同的油脂对微生物细胞活力影响的规律和机制,为反刍动物瘤胃微生态调控技术的研究和实际生产中油脂的使用提供参考。
1 材料与方法
1.1 试验动物与饲养管理
在扬州大学农牧场选择3只1.5岁并装有瘤胃瘘管的徐淮白山羊,平均体重为(29.7±0.14)kg,用于采集瘤胃液。试验山羊分隔单舍,以玉米、豆粕和羊草为常规饲粮,于07:00和19:00分2次饲喂,自由饮水。
1.2 试验设计与培养底物
试验采用单因子试验设计,共分5组,每组3重复。对照组不加油脂、试验组分别为花生油组、菜籽油组、玉米油组和豆油组。底物组成与油脂碘价见表1,棕榈酸钙为本实验室生产。
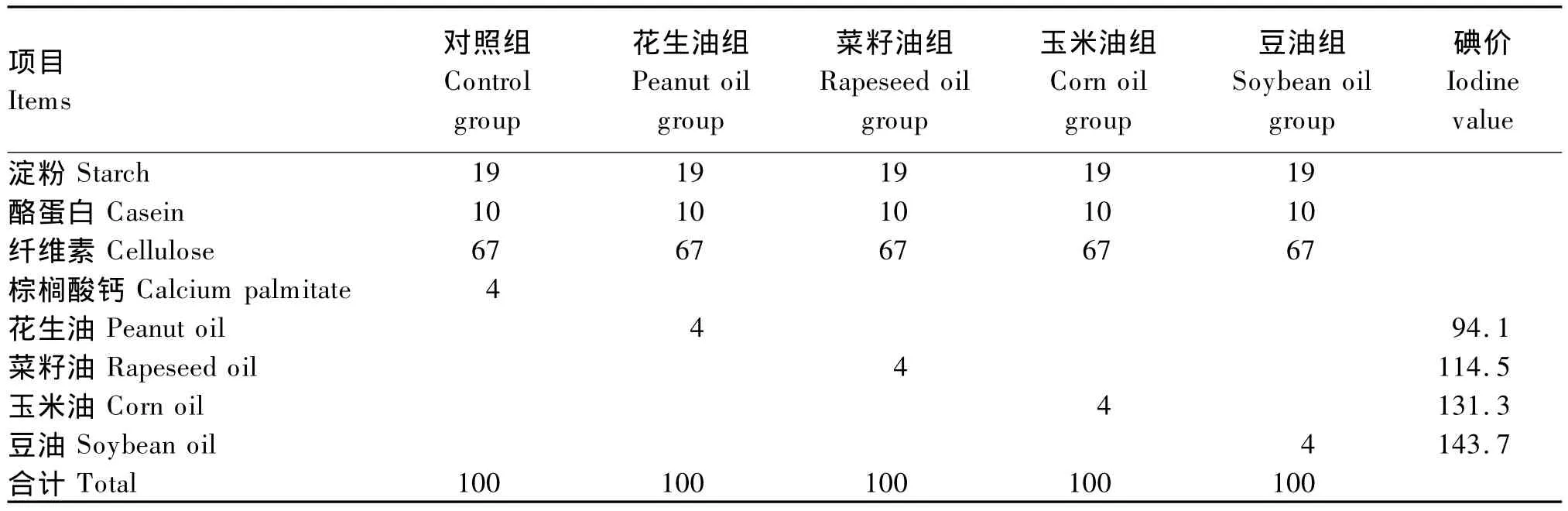
表1 底物组成与油脂碘价Table 1 Composition of substrates and iodine values of oil %
1.3 体外培养与取样设计
参考Menke等[7]的方法。配制好培养液(人工唾液盐∶瘤胃液 =2∶1),通入 CO2,39℃水浴预热。按照试验设计准确称取2.0 g底物置于培养瓶中,分别加入150 m L培养液。通入CO2,39℃恒温水浴震荡培养。
分别在培养后 0、4、8、12、16、24 h 取样,每次取约15 m L培养液,分装于3支离心管,其中1支立即离心并取上清液用于测定谷丙转氨酶、谷草转氨酶、乳酸脱氢酶的酶活;1支立即离心并用于测定总脱氢酶酶活;1只立即于-20℃冷冻保存,待分离微生物与微生物DNA的测定。
1.4 测定指标及方法
1.4.1 谷丙转氨酶、谷草转氨酶及乳酸脱氢酶测定
各个时点取样后立即7 000 r/mim离心15 min离心,并取上清液送江苏省苏北人民医院,采用全生化分析仪测定。
1.4.2 总脱氢酶活性测定
参考Humeyan等[8]的方法,并略有改进。取100目尼龙布过滤的新鲜培养液2 m L于试管中,加入0.2 m L 1.5%的氯化三苯四氮唑(TTC)反应,而对照管先加入5 m L异丙醇抑制酶反应。在厌氧条件下恒温水浴(38~39℃)10 m in。试验组加入5 m L异丙醇终止反应后,以4 000 r/m im离心10 min。上清液稀释15倍,于分光光度计在485 nm处比色。酶活单位定义为在38.5℃、pH 6.8条件下,每分钟引起测定液吸光度上升0.1的酶量为1个酶活单位。
酶活单位(U/m L)=(样品A485 nm/m in-对照A485 nm/m in)×15。
1.4.3 微生物分离与其DNA的测定
依据差速离心原理分离微生物,具体步骤为:1)原虫:取瘤胃液加等体积生理盐水置于恒温(39℃)水浴锅中震荡(125 r/m in)水浴孵育60 m in,并辅以搅拌,再经4层纱布过滤,滤液离心(400 r/m im离心10 m in),收集沉淀为原虫,用生理盐水洗涤2次后用生理盐水悬浮,-20℃贮存待测。2)细菌:收集上述1)中离心后的上清液,再高速离心(15 000 r/m im离心15 m in),收集沉淀为细菌,其余处理同1)中所述。
微生物DNA测定原理:微生物体内DNA所占比例比RNA或蛋白质等成分更为恒定,利用微生物的DNA量来代表微生物的总量更加科学。DNA二苯胺显色后其595 nm处的吸光度与样品中含量成线性关系,线性范围为40~400μg/m L,据此将待测样品释至线性范围内测定其光密度值、再据标准品测定得到的标准曲线即可查得样品浓度。微生物DNA测定采用二苯胺显色法并参照赵亚华[9]的步骤。制备小牛胸腺DNA钠盐(上海生工公司)标准溶液,制作以DNA量为横坐标,吸光度值为纵坐标的标准曲线。以样品的吸光度值从标准曲线上查出相对应DNA含量。
1.5 统计分析
Excel整理数据和作图,用SPSS v16.0软件中comparemean的One-way-ANOVA过程进行方差分析和Tukey多重比较。
2 结果与分析
2.1 转氨酶及脱氢酶随时间的动态变化
由表2和表3可见,培养液谷草转氨酶、谷丙转氨酶、乳酸脱氢酶等随培养时间的延长大体上都不断提高,其中以菜籽油组变化幅度最大、豆油组次之,并且该2组持续在远高于对照组和其他油脂组的水平上变化;而玉米油组与花生油组与对照组接近,变化幅度不大。各个时间点比较,其中谷草转氨酶、谷丙转氨酶随时间变化的幅度较大,同一组的随时间变化有显著变化(P<0.05);而乳酸脱氢酶随时间变化的幅度不大,同一组的各个时间点间没有显著差异(P>0.05)。
由表3可见,随着培养时间的延长,各组培养液总脱氢酶的活性有显著增长的趋势(P<0.05),除玉米组外,都以16 h的该酶活性最高,而后又略有下降。各组间变化不尽一致,其中以豆油组增长幅度最大,其次依次为玉米油组、花生油组、对照组和菜籽油组,总体看来仅菜籽油组的总脱氢酶活性在培养过程中持续低于对照组。

表2 培养液中谷草转氨酶和谷丙转氨酶的活性变化Table 2 The activities of GOT and GPT in culture solution IU/L

表3 培养液中乳酸脱氢酶和总脱氢酶的活性变化Table 3 The activities of LDH and total dehydrogenase in culture solution
2.2 油脂对转氨酶、脱氢酶均值的影响
由表4可见,各组间培养液乳酸脱氢酶、谷草转氨酶、谷丙转氨酶在各组间有显著差异(P<0.05)。3种酶都以菜籽油组最高、其次依次为豆油组、玉米油组、花生油组,除花生油组与对照组差异不显著外(P>0.05),其他油脂组都显著高于对照组(P<0.05)。
总脱氢酶组间差异显著(P<0.05)。其中总脱氢酶以豆油组最高,显著高于对照组(P<0.05)、玉米油组次之、花生油组再次之,菜籽油组最低,在数值上低于对照组,但差异不显著(P>0.05)。
2.3 油脂对培养液原虫、细菌区系的影响
由表4还可知,培养液原虫、细菌、微生物DNA,以及原虫/细菌区系比例的均值与对照组差异不显著(P>0.05),添加油脂的试验组间也没有显著差异(P>0.05);但本试验中脱氢酶、转氨酶等动态指标在时间点间基本均有显著变化趋势(表2、3),而且同时进行的各时间点微生物DNA及原虫/细菌区系比例测定也表明,各组的微生物DNA、原虫/细菌比例(图1、2)随时间都有显著或极显著的变化(P<0.05、P<0.01)。这说明了微生物在培养过程中其区系、活力等都发生了变化,而要考察体系中微生物的客观情况不仅要考察其均值或终点值,还要考察其动态指标;同时也表明,在本试验的各组培养过程中微生物的量与活力虽然有较大的动态变化,但微生物的均产量受到的影响不大。可通过调节微生物的活力改变其发酵状态,而不影响微生物蛋白产量。
3 讨论
3.1 油脂对转氨酶和乳酸脱氢酶活性的影响
谷草转氨酶、谷丙转氨酶和乳酸脱氢酶等一般在胞内的浓度远远高于胞外,但若细胞受损、胞膜破坏将导致胞外的浓度上升。在本研究中,各组培养液乳酸脱氢酶、谷草转氨酶和谷丙转氨酶等随时间培养时间的延长皆不断提高,其原因可能即是在培养过程中随时间的延长微生物与代谢物的积累而微生物细胞自溶导致细胞壁、细胞膜的破坏而释放上述的酶所致[10-11]。其中以菜籽油组的变化幅度最大、豆油组次之,玉米油组与花生油组与对照组接近,变化幅度不大。可能是由于植物油脂的不饱和脂肪酸对原虫或细菌具有一定的负效应,而且不饱和程度越高其负效应越大所致[2]。本试验也表明碘价最高的豆油组其培养液转氨酶、乳酸脱氢酶的活性较碘价较低的玉米油组、花生油组高,其微生物细胞的破损更为严重。

表4 4种油脂对培养液酶活及微生物区系的影响Table 4 Effects of the 4 kinds of oils on enzyme activity and m icroflora in culture solution

图1 油脂对培养液微生物DNA的影响Fig.1 Effects of oils on m icrobial DNA in culture solution

图2 油脂对培养液原虫/细菌区系比例的影响Fig.2 Effects of oils on protozoa to bacteria ratio in calture solution
其中谷草转氨酶和谷丙转氨酶随时间变化的幅度较大,同一组的各个时间点间有显著变化;而乳酸脱氢酶随时间变化的幅度不大,同一组的各个时间点间没有显著差异。其原因可能是谷草转氨酶和谷丙转氨酶2种酶为微生物细胞生长繁殖中代谢过程中必不可少的“催化剂”,参与氨基酸的分解和合成[12],在正常代谢时的细胞中含量较高。当微生物细胞有少量的破损时则培养液转氨酶活性急速上升,临床研究发现,有1%的肝细胞破损可使血清中转氨酶增加1倍以上。而本试验中该酶的酶活菜籽油组、豆油组、玉米油组等在24 h时已分别为对照组的10、6、3倍左右,说明添加油脂对微生物细胞的损伤程度增加,但具体的剂效关系有待进一步研究。相比之下,乳酸脱氢酶在各个时间点、或组间没有显著的变化,豆油组仅为对照组的1.2倍,远远小于2种转氨酶的变化幅度,其原因可能是乳酸的代谢并非瘤胃微生物正常发酵的途径,只有在大量淀粉或可溶性糖底物存在时才诱发牛链球菌的乳酸脱氢酶活性,以乳酸代谢为主[13-15],因此,本体系中并未导致该酶类似转氨酶的急剧升高。
3.2 油脂对总脱氢酶及其动态变化的影响
在瘤胃微生物中发现的总脱氢酶主要以烟酰胺腺嘌呤二核苷酸(nicotinam ide adenine dinucleotide,NAD+)和烟酰胺腺嘌呤二核苷酸磷酸(nicotinam ide adenine dinucleotide phosphate,NADP+)为辅基的谷氨酸脱氢酶(GDH)和乳酸脱氢酶,其中NAD+-GDH很可能是微生物利用氨合成蛋白质最重要的酶。因此,总脱氢酶的活性能够直接反映微生物发酵时脱氢酶传递氢的能力,即整体微生物的活力水平[16]。本研究发现随着时间的延长,各组总脱氢酶的活性有显著增长的趋势,基本在16 h达到最高,之后又有所下降,这与微生物的生长繁殖规律相一致,即微生物的培养过程中指数生长期后会进入稳定期、衰亡期而使微生物活力下降所致[17-18]。
本试验中豆油组和玉米油组总脱氢酶极显著或显著高于对照组,2个油脂试验组间也有显著差异,以豆油组显著高于玉米油组。表明一定比例的不饱和油脂有一定的提高培养液微生物活性的效应。这可能是由于不饱和的油脂降解后其游离脂肪酸的不饱和键会抑制了原虫[6],使其群体生物量减少,进而减少其对细菌的吞噬,而增加细菌的数量,通过区系生物量的交替消长,而最终可能改变了微生物的生物总量及微生物总的活力所致[19-20]。
在本试验添加4%水平油脂的基础上,豆油组和玉米油组显著高于对照组,表明不饱和程度更高的玉米油和豆油对通过限制原虫而提高细菌具有积极的意义;但花生油组与对照组不显著,表明其不饱和程度不高在4%的水平添加并未起到统计上的积极意义。而菜籽油组的总脱氢酶活性在培养过程中持续低于对照组,即该组对原虫、细菌的负作用大于通过抑制原虫提高细菌的正向作用,表明该添加水平致使微生物细胞的损害程度较大,其中可能也包括较大量的细菌细胞,而对瘤胃微生物的发酵起到了负面的抑制作用。由于本试验实测了所使用的各油脂的碘价,表明菜籽油并非不饱和程度最高,但其负面效应最大的原因是否与菜籽油的芥酸[21]与培养液中氨的持续共存,再经由微生物复杂的作用,而形成有毒性的三聚氰酸、芥酸酰胺等物质有关,其具体原因有待进一步的研究。
由临床研究可知,谷草转氨酶/谷丙转氨酶≥1时,常说明肝等组织细胞受到严重损伤。本研究该比值上小于1,而且表征微生物总活力的总脱氢酶活性除菜籽油组都高于对照组,因此推测认为,本研究添加4%的油脂的油脂除菜籽油外,尚未使微生物细胞有严重的损伤。
4 结论
在本试验条件下,油脂对体外培养瘤胃微生物细胞活力有显著的影响,其效应有随着油脂不饱和程度的加大而加大的趋势,其中以豆油的促进微生物活力效应最好,玉米油次之。
[1]DIJKSTRA J,GERRITS W J J,BANNINK A,et al.Modelling lipid metabolism in the rumen[C]//Modelling Nutrient Utilization in Farm Animals,MCNAMARA J P,FRANCE J,BEEVER D E,eds.Publisher:CABIPublishing,2000.
[2]MCGINN SM,BEAUCHEM IN K A,COATES T.Methane em issions from beef cattle:effects ofmonensin,sunflower oil,enzymes,yeast,and fumaric acid[J].Journal of Animal Science,2004,82:3346-3356.
[3]王梦芝,程欣,谢文文,等.体外法研究不同油脂对瘤胃原虫吞噬细菌微循环的影响[J].中国农业科学,2010,43(8):3831-3837.
[4]BUSQUET M,CALSAM IGLIA S,FERRET A,et al.Effect of garlic oil and four of its compounds on rumen m icrobial fermentation[J].Journal of Dairy Science,2005,88:4393-4404
[5]李旦,王加启,卜登攀,等.运用Real-time PCR方法研究日粮添加豆油与胡麻油对肉牛瘤胃纤维分解菌数量的影响[J].动物营养学报,2008,20(3):256-260.
[6]JALCˇD,CˇERTIK M,KUNDRIKOVA K,et al.Effect ofm icrobial oil and fish oil on rumen fermentation and metabolism of fatty acids in artificial rumen[J].Czech Journal of Animal Science,2009,54(5):229-237.
[7]MENKE K H,STEINGASSH.Estimation of the energetic feed value obtained from chem ical analysis andin vitrogas production using rumen fluid[J].Animal Research and Development,1988,28:7-55.
[8]HUMEYAN D B,NAGARAJA T G,M ILLER G W,et al.Rumen m icrobial changes in cattle fed diets with or without salinomycin[J].Applied and Environmental Microbiology,1986,51(2):340-345.
[9]赵亚华.生物化学与分子生物学实验技术教程[M].北京:高等教育出版社,2005.
[10]JENKINS T C.Lipid metabolism in the rumen[J].Journal of Dairy Science,1993,76:3851-3863.
[11]JALCˇD,KIŠIDAYOVÁ S,NERUD F.Effect of plant oils and organic acids on rumen fermentationin vitro[J].Folia Microbiologic,2002,47(2):171-177.
[12]加勒特,格里萨姆.生物化学[M].3版.北京:高等教育出版社,2005:809-853.
[13]OWENS FN,SECRIST D S,HILLW J,etal.Acidosis in cattle:a review[J].Journal of Animal Science,1998,76:275-286.
[14]ENEMARK JM,JØRGENSEN R J,ENEMARK P.Rumen acidosis with special emphasis on diagnostic aspects of subclinical rumen acidosis:a review[J].Veterinary Zootechnique,2002,20(42):16-29.
[15]胡红莲,刘大程,卢德勋,等.日粮不同NFC/NDF比对奶山羊血液参数的影响[J].江西农业大学学报,2008,30(5):855-859.
[16]刘春龙,李杰.丝兰皂甙对绵羊瘤胃原虫数目及酶活性的影响[J].西南农业大学学报,2005,27(2):214-217.
[17]程茂基,卢德勋,王洪荣,等.不同来源肽对培养液中瘤胃细菌蛋白产量的影响[J].畜牧兽医学报,2004,35(1):1-5.
[18]李莉.应用微生物学[M].武汉:武汉理工大学出版社,2006.
[19]NGUYEN T H N,NGUYEN T N,NGUYEN T,et al.Determ ination of the optimum level of a soybean oil drench with respect to the rumen ecosystem,feed intake and digestibility in cattle[J/OL].Livestock Research for Rural Development,2007,19(8).[2011-02-01].http://www.cipav.org.co/lrrd/lrrd19/8/nhan19117.htm.
[20]WANG M Z,WANG H R,YU L H.Effects of NDF content on protozoal community and grazing rate in rumen[J].Journal of Animal and Veterinary Advances,2009,8(9):1746-1752.
[21]陈蛋,陈斌,陆道礼,等.近红外光谱分析法测定菜籽油中芥酸的含量[J].农业工程学报,2007,23(1):234-237.
*Corresponding author,lecturer,E-mail:mengzhiwang@yahoo.cn
(编辑 武海龙)
Effects of Different Plant Oils on the Enzyme Activity and Microbial Activityin vitro
WANG Shu1WANG Mengzhi1*LU Zhanjun2DONG Shuhong1ZHANG Xin1WANG Hongrong1
(1.College of Animal Science and Technology,Yangzhou University,Yangzhou225009,China;2.Gannan Normal College,Ganzhou341000,China)
The objectives of this paperwere to determ ine the effects of different plantoils on the enzyme activity and m icrobial activityin vitro.Three goats with permanent cannulas were used in a simple factor design.The control group was supplemented with no oil and the experimental groups were supplemented with peanut oil,rapeseed oil,corn oil,and soybean oil,respectively.The results showed that the activity of lactate dehydrogenase(LDH),glutam ic oxaloacetic transam inase(GOT),and glutam ic-pyruvic transam inase(GPT)were highest in rapeseed oil group and that in soybean oil group,corn oil group and peanut oil group fell in turn,the activity of LDH,GOT and GPT in the experimental groups were significant higher than that in the control group except for peanutoil group(P<0.05)and therewere significantly differences among the experimental groups(P<0.05).The activity of total dehydrogenase in soybean oil group was the highest and significantly higher than that of the control group(P<0.05)and that in corn oil group,peanut oil group and rapeseed oil group fell in turn.Additionally,no significant difference was observed in the protozoal DNA,bacterial DNA,m icrobial DNA,and protozoa to bacteria ratio among groups(P>0.05).However,m icrobial DNA was generally higher in soybean oil group and corn oil group at all sampling time points,and the changing trend along with time differed from each other.It was further observed that,protozoa to bacteria ratios weremuch lower in soybean and corn oil.In conclusion,different oils had different effects on m icroflora and activity of rum inalm icroorganismsin vitro,while soybean oil and corn oil showed much better effects on promoting m icrobial activity than the others.[Chinese Journal of Animal Nutrition,2011,23(8):1309-1316]
oil;rumen m icrobe;transam inase;dehydrogenase;in vitro
S816.43
A
1006-267X(2011)08-1309-08
10.3969/j.issn.1006-267x.2011.08.009
2011-02-25
国家自然科学基金(31072051);扬州大学创新培育基金(2010CXJ054)
王 曙(1987—),男,江苏宿迁人,硕士研究生,从事反刍动物瘤胃微生态营养调控的研究。E-mail:yzuwangshu@163.com
*通讯作者:王梦芝,博士,讲师,E-mail:mengzhiwang@yahoo.cn

