铜伴侣蛋白CCS介导铜锌-超氧化物歧化酶激活的过程
唐 玲 冯 琳 刘 扬 胡 凯 周小秋,3*
(1.四川农业大学动物营养研究所,雅安 625014;2.鱼类营养与安全生产四川省高校重点实验室,雅安 625014;3.动物抗病营养教育部重点实验室,雅安 625014)
铜伴侣蛋白CCS介导铜锌-超氧化物歧化酶激活的过程
唐 玲1,2冯 琳1,2刘 扬1,2胡 凯1,2周小秋1,2,3*
(1.四川农业大学动物营养研究所,雅安 625014;2.鱼类营养与安全生产四川省高校重点实验室,雅安 625014;3.动物抗病营养教育部重点实验室,雅安 625014)
CCS是细胞质中铜锌-超氧化物歧化酶(SOD1)的铜伴侣蛋白。本文综述了CCS介导SOD1激活的过程。CCS与SOD1通过蛋白-蛋白相互作用的方式将铜离子插入到不含铜离子的SOD1(apoSOD1)中,并促进二硫键的形成而激活SOD1。影响CCS活性的因素包括:X连锁的细胞凋亡抑制蛋白(XIAP)、神经接头蛋白X11α和铜代谢中含结构域Murr1蛋白(COMMD1)。
CCS;铜;SOD1
铜是具有氧化还原活性的动物必需的微量元素,它以酶的催化基团或结构辅因子的形式参与多种功能活动,如电子传递、氧合与催化等[1]。铜容易得失电子,即使在低浓度情况下也具有很强的毒性,因此动物机体铜的吸收、分配和排出都受到严格调控,以预防其积累所导致的大分子物质的氧化损伤[2]。铜离子在胞内的定位主要由3种铜伴侣蛋白实现:ATX1[3]、COX17[4]和 CCS[5]。CCS,即 copper chaperone for superoxide dismutase 1,Culotta等[5]首次在啤酒酵母菌株上用基因遗传学方法将其鉴定出来。CCS与细胞质中的铜锌-超氧化物歧化酶(SOD1)通过蛋白-蛋白相互作用的方式将铜离子插入到SOD1铜结合位点[5-7]。CCS 与 SOD1 活性有关[5,7-11]。本文就 CCS 介导的SOD1激活的过程作一综述。
1 CCS的结构
CCS是由270~300个氨基酸组成的一条多肽,分子量大约是 28 ku[5,12]。这些氨基酸形成 3个结构域:CCS氮端即结构域Ⅰ,从 Met 1~Ser 80,包含2个α-螺旋片段与4股反向平行的β折叠,其中含有1个金属结合序列(即 MHCXXC),CCS结构域Ⅰ的组成与铜伴侣蛋白ATX1高度相似[13-15];CCS的中间部分即结构域Ⅱ,从Leu 86~A la 234,包含8股希腊钥匙β折叠桶结构,这是超氧化物歧化酶(SOD)家族的典型结构,并且其氨基酸序列与SOD亚基同源性高达47%,结构域Ⅱ包含了SOD1中所有结合锌离子的His位点以及3个结合铜离子的His位点,SOD1中第4个结合铜离子的His位点在CCS中被 Asp取代[13-15];CCS 的碳端即结构域Ⅲ,大约由40个氨基酸组成,碳端是无规则卷曲,该结构域氨基酸序列在各物种间高度保守,保守性达到90%,其中含有2个Cys残基(即CXC)在所有物种上全部保守,也具有结合铜离子的能力[13,15]。人CCS在生理条件下以同源二聚体形式存在(图1)。
2 CCS介导SOD1激活的过程
铜离子是SOD1活性中心的重要组成部分,SOD1催化超氧阴离子()歧化为氧气(O2)和过氧化氢(H2O2)是由SOD1活性中心的铜离子通过得失电子实现[15-16],而细胞中的铜离子均以螯合形式存在,几乎没有游离铜离子[17],因此各种含铜蛋白中铜离子的获取途径是近年来研究的热点。有关啤酒酵母的一系列遗传学研究表明,铜离子在胞内的定位由铜伴侣蛋白家族介导[2-5]。CCS是铜伴侣蛋白家族中的一员,介导铜离子向SOD1定位[5]。在CCS基因缺陷型酵母中,SOD1的蛋白含量不受影响,但是该SOD1蛋白没有活性[9]。CCS基因缺陷型小鼠胚胎成纤维细胞SOD1没有活性是由于该蛋白不含铜离子[18]。而变性的不含铜离子的SOD1(apoSOD1)在CCS和铜盐同时存在时有活性,仅有铜盐时不具有活性[13]。Amy 等[18]在 CCS 基因缺陷型小鼠胚胎成纤维细胞中转入CCS后,发现SOD1的活性得以恢复,并且该SOD1蛋白中铜离子含量也得以恢复。而铜离子进出细胞以及在胞内的定位是由亲和力梯度驱动,SOD1对铜离子的亲和力是CCS的10倍,因此铜离子从CCS传递到SOD1具有热力学优势[19]。这些研究表明CCS能够介导SOD1中铜的定位以及SOD1的激活。
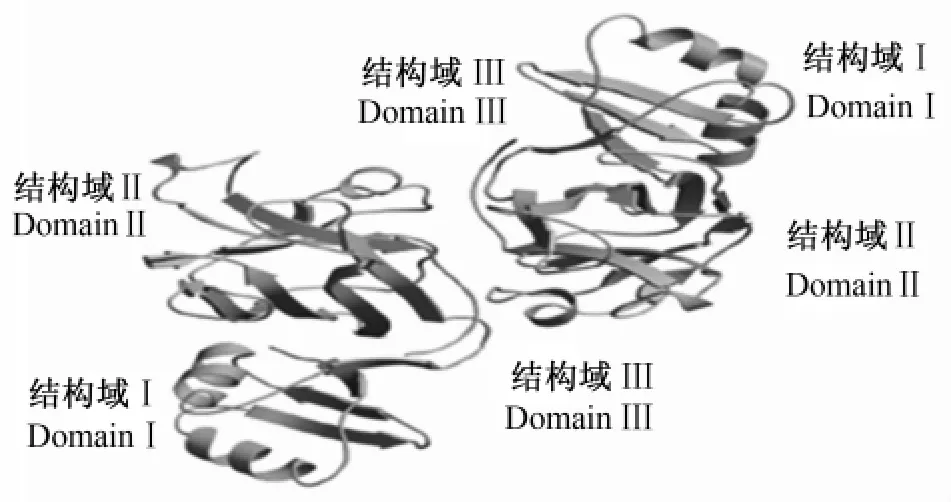
图1 CCS形成的同源二聚体结构图Fig.1 Homodimer structure of CCS[14]
CCS 的结构域Ⅰ分子量大约 8 ku[12],它在CCS介导的SOD1激活过程中有重要作用。Schm idt等[7]用铜离子特异性螯合剂BCS(bathocuproine sulfonate)螯合细胞中游离铜离子,即模拟生理条件下无游离铜离子状态,在CCS基因缺陷型酵母中转入缺失结构域Ⅰ的CCS发现SOD1没有活性。Amy等[18]在小鼠胚胎成纤维细胞中的研究得到相同的结果,并进一步分析发现该SOD1蛋白不含铜离子。这说明在铜离子极其有限的情况下,CCS的结构域Ⅰ是CCS激活SOD1必需的。而在生理条件下,铜离子均以螯合物的形式存在,细胞内几乎没有游离的铜离子[17],因此CCS的结构域Ⅰ在生理条件下对SOD1激活有重要作用。研究发现CCS结构Ⅰ中金属结合位点MXCXXC的2个Cys残基参与结合铜离子[13]。铜离子结合后 CCS的稳定性增强[7,13]。酵母 CCS 结构域Ⅰ能够与其结构域Ⅲ相识别和结合,并将铜离子转移到结构域Ⅲ中的CXC位点[7]。因此生理条件下,CCS结构域Ⅰ在CCS激活SOD1中的必需性与其能够从螯合剂中获取铜离子并将铜离子转移到CCS结构域Ⅲ中有关,结构域Ⅰ缺失后导致SOD1蛋白中不含铜离子而使SOD1没有活性,因而CCS结构域Ⅰ的主要生理功能是从铜离子螯合剂获取铜离子[13,17]。
CCS的结构域Ⅱ,分子量大约 16 ku[12]。虽然CCS结构域Ⅱ与SOD1同源性高,且含有SOD1中所有结合锌离子的His位点以及3个结合铜离子的His位点,但是 CCS没有SOD活性[7]。CCS结构域Ⅱ与SOD1一样结合锌离子,锌离子的结合可能有利于其结构的稳定,这对CCS功能的发挥是必需的[20],但是CCS结构域Ⅱ中潜在的铜离子结合位点却不是CCS将铜离子传递给SOD1所必需的,因为将这3个His残基定点突变为Gly之后,使铜离子不在该结构域结合,SOD1仍具有活性[13]。由于CCS与SOD1的序列同源性以及二聚体界面的相似性,CCS可能与SOD1通过结构域Ⅱ 相 互 识 别[6]。Hwanga 等[21]发 现 CCS 与SOD1在沙鼠椎体细胞中的分布完全一致。Falconi等[12]发现 CCS结构域Ⅱ与SOD1表面电荷分布相互匹配,并推断CCS与SOD1可能通过这种电荷互补性相识别和结合。酵母CCS能与SOD1相识别和结合,并且这种结合需要CCS的结构域Ⅱ和Ⅲ[6]。Lamb 等[14]研究发现 His 48 定点突变成Phe的SOD1不能结合铜离子,突变的SOD1与CCS形成了异源二聚体(图2),二聚体界面有4个氢键:SOD1中Gly 52和Gly 115与CCS中217 Arg,CCS中Arg 187和Gly 137与SOD1中Leu 152分别形成2个氢键。而将酵母CCS结构域Ⅱ形成二聚体界面Phe 136和Gly 137突变为Glu 以后,酵母体内的 SOD1 则没有活性[8,18],这种SOD1不含有铜离子[18]。因此CCS的结构域Ⅱ与SOD1相互识别和结合,结构域Ⅱ中的潜在铜离子结合位点与SOD1激活无关,但是该结构域中形成二聚体界面的氨基酸残基突变后导致CCS无法与SOD1识别而使铜离子不能插入到SOD1 中,进而导致 SOD1 没有活性[8,18]。
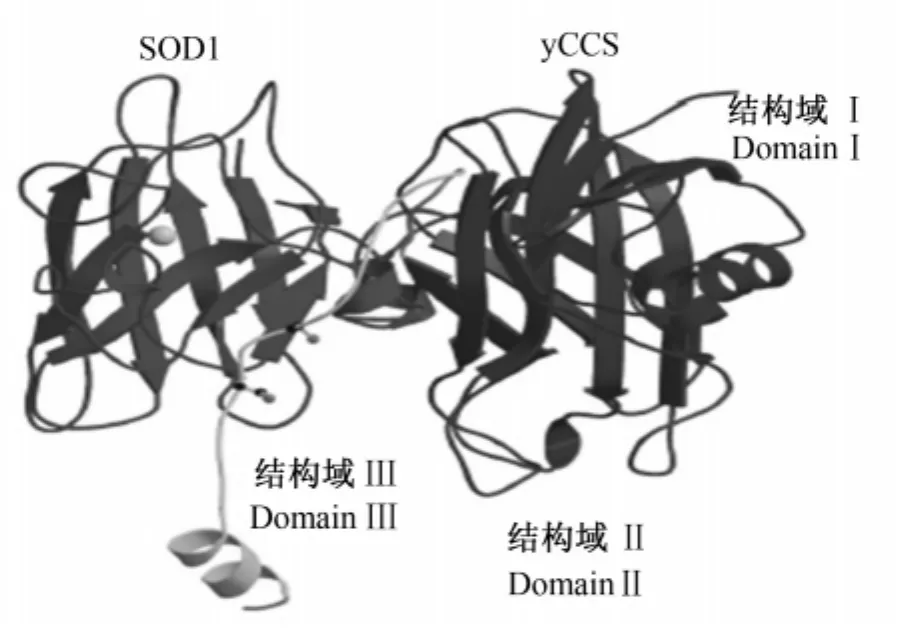
图2 CCS与SOD1形成的异源二聚体Fig.2 Heterodimer structure of the complex between CCS and SOD1[14]
CCS的结构域Ⅲ是由30~40个氨基酸组成的多肽,是一段无规则卷曲[7,12]。在所有物种中,CCS结构域Ⅲ中CXC序列高度保守,CCS结构域Ⅲ对于SOD1的活性至关重要[7]。在CCS基因缺陷型酵母中转入缺失结构域Ⅲ的CCS或者转入结构域Ⅲ中Cys定点突变的CCS,SOD1均没有活性[7,8]。酵母 SOD1完全不能与缺失结构域Ⅲ的CCS相结合,但是SOD1与Cys定点突变的CCS相结合的量不受影响[8]。这表明结构域Ⅲ是CCS与SOD1相识别与结合必需的,Cys虽与识别过程无关但却是铜离子插入SOD1必需的。转入结构域Ⅲ中 Cys定点突变的 CCS后,SOD1没有活性[8,18],该 SOD1 蛋白不含铜离子[18]。结构域Ⅲ与结构域Ⅰ相识别并结合铜离子[7]。Lamb等[14]发现CCS的结构域Ⅲ延伸到SOD1的铜结合位点,并且CCS中Cys 229与SOD1中Cys 57形成二硫键。因此,CCS结构域Ⅲ从结构域Ⅰ中获取铜离子后延伸到SOD1的铜结合位点,并将铜离子插入到SOD1的铜结合位点,是激活SOD1必需的[8,14,18]。
CCS介导SOD1激活过程一般包括2步,第1步是CCS介导铜离子插入到SOD1中,第2步是SOD1二硫键的形成[15]。SOD1是同源二聚体,各亚基都有一个保守的二硫键,这与SOD1结构稳定以及活性中心形成有关,将SOD1中Cys 57或Cys 146定点突变使其不能形成二硫键时,虽然其中的铜和锌的含量不受影响,但SOD1蛋白没有活性[10]。酵母和大肠杆菌CCS激活SOD1需要氧的参与[9-10]。在厌氧条件下,CCS与 SOD1不能相识别和结合[22]。Furukawa 等[10]研究报道,仅有CCS和CuSO4处理时几乎检测不到二硫键,而在氧、CCS和CuSO4同时处理时检测到大量二硫键,表明氧能够诱导二硫键的形成。结合Cu+的人CCS与变性SOD1在有氧条件下孵育,Cu+被快速氧化为Cu2+,而在厌氧情况下孵育Cu+没有被氧化[9]。Cu2+能够氧化 Cys形成二硫键[23]。CCS中Cys 229与SOD1中Cys 57形成分子间二硫键[14]。而CCS能够促进氧诱导的分子间二硫键的异构化形成SOD1分子内二硫键[10]。
综上所述,在生理条件下,CCS的结构域Ⅰ从螯合剂中获取铜离子并结合到其金属结合框CXXC中,结构域Ⅱ则与apoSOD1相互识别而形成异源二聚体,结构域Ⅲ与结构域Ⅰ相互作用使铜离子转移到结构域Ⅲ中金属结合位点CXC上并延伸到SOD1的铜结合位点,在氧的作用下氧化Cu+为Cu2+,Cu2+使CCS中Cys 229与SOD1中Cys 57氧化形成二硫键,同时释放铜离子到SOD1铜结合位点,CCS促进该分子间二硫键异构化而形成SOD1分子内二硫键。此时,异源二聚体分开,各自形成同源二聚体,SOD1被激活。
3 影响CCS活性的因素
目前研究发现,有3种蛋白能够影响CCS活性:X连锁的细胞凋亡抑制蛋白(XIAP)、神经接头蛋白X11α和铜代谢中含结构域Murr1蛋白(COMMD1)。
XIAP能提高 CCS活性。Brady等[11]研究发现,XIAP基因敲除或小干扰RNA(siRNA)干扰其在酵母和小鼠胚胎成纤维细胞表达后,SOD1活性降低。生理条件下CCS结构域Ⅱ能与XIAP相互识别和结合并且XIAP诱导CCS中Lys 241不依赖于蛋白体的泛素化,提高CCS作为SOD1铜伴侣蛋白的活性。而铜浓度较高时,CCS介导铜离子传递给XIAP,使CCS结构域Ⅲ中的 Cys泛素化,从而进入 26S 蛋白体途径降解[11,18,24]。
X11α 抑制 SOD1 活性。M cLoughlin等[25]在鼠卵巢细胞上的研究表明,CCS与X11α分布相同,且X11α的PDZ 2结构域与CCS结构域Ⅲ结合。因此X11α对SOD1活性的抑制作用是由于其与CCS结构域Ⅲ结合,导致CCS不能将铜离子插入到SOD1中所致。
COMMD1也能抑制 SOD1活性。W illianne等[26]在人胚肾细胞的研究中发现,COMMD1过量表达影响SOD1二聚体的含量而使SOD1活性降低,而siRNA干扰其表达后,SOD1活性升高。因此,COMMD1通过抑制 SOD1二聚化而降低SOD1活性。
4小结
铜是动物必需的微量元素之一,也是SOD1活性中心的重要组成部分,SOD1的激活主要由CCS介导。研究CCS介导SOD1激活的过程,一方面有助于完善铜离子在细胞内定位和SOD1激活的理论知识,另一方面也为营养物质对机体抗氧化防御的影响方式提供研究方向和依据。关于CCS激活SOD1的研究还存在以下问题:1)铜离子从CCS结构域Ⅰ到结构域Ⅲ以及SOD1铜结合位点中,CCS和SOD1具体构象改变有待研究;2)CCS和SOD1中具体哪些氨基酸残基参与铜离子的转运有待深入研究。
[1]KIM B E,TRACY N,THIELE D J,et al.Mechanisms for copper acquisition,distribution and regulation[J].Nature Chem ical Biology,2008,4(3):176-185.
[2]VALENTINE S J,GRALLA E B.Delivering copper inside yeast and human cells[J].Science,1997,278(5339):817-818.
[3]KLOMP L W,LIN S J,YUAN D,et al.Identification and functional expression of HAH1,a novel human gene involved in copper homeostasis[J].The Journal of Biological Chem istry,1997,272(14):9221-9226.
[4]GLERUM D M,SHTANKO A,TZAGOLOFF A.Characterization of COX17,a yeast gene involved in coppermetabolism and assembly of cytochrome oxidase[J].The Journal of Biological Chem istry,1996,271(24):14504-14509.
[5]CULOTTA V C,KLOMP L W.The copper chaperone for superoxide dismutase[J].The Journal of Biological Chem istry,1997,272(38):23469-23472.
[6]CASARENO R L,DARRELW,GITLIN JD,et al.The copper chaperone CCS directly interactswith copper/zinc superoxide dismutase[J].The Journal of Biological Chem istry,1998,273(37):23625-23628.
[7]SCHM IDT P J,RAE T D,PUFAHL R A,et al.Multiple protein domains contribute to the action of the copper chaperone for superoxide dismutase[J].The Journal of Biological Chem istry,1999, 274(34):23719-23725.
[8]SCHM IDT P J,KUNST C,CCLOTTA V C,et al.Copper activation of superoxide dismutase 1(SOD1)in vivo[J].The Journal of Biological Chem istry,2000,275(43):33771-33776.
[9]BROWN N M,TORRES A S,DOAN P E,et al.Oxygen and the copper chaperone CCS regulate posttranslational activation of Cu,Zn superoxide dismutase[J].Proceedings of the National Academy of Sciences,2004,101(15):5518-5523.
[10]FURUKAWA Y,TORRES A S,OHALLORAN T V,etal.Oxygen-induced maturation of SOD1:a key role for disulfide formation by the copper chaperone CCS[J].The EMBO Journal,2004,23(14):2872-2881.
[11]BRADY G F,GALBAN S,LIU X W ,et al.Regulation of the copper chaperone CCS by XIAP-mediated ubiquitination[J].Molecular and Cellular Biology,2010,30(8):1923-1936.
[12]FALCONIM,IOVINO M,DESIDERIA,et al.A model for the incorporation of metal from the copper chaperone CCS into Cu,Zn superoxide dismutase[J].Structure,1999,7(8):903-908.
[14]LAMB A L,TORRESA S,O'HALLORAN T V,et al.Heterodimeric structure of superoxide dismutase in complex with its metallochaperone[J]. Nature,2001,8(9):751-755.
[15]FURUKAWA Y,THOMASV O.Posttranslational modifications in Cu,Zn-superoxide dismutase andmutations associated with amyotrophic lateral sclerosis[J].Antioxidants&Redox Signaling,2006,8(5):847-867.
[16]BARTNIKAS T B,GITLIN JD.Mechanisms of biosynthesis of mammalian copper/zinc superoxide dismutase[J].The Journal of Biological Chem istry,2003,278(35):33602-33608
[17]RAE T D,SCHM IDT P J,PUFAHL R A,et al.Undetectable intracellular free copper:the requirement of a copper chaperone for superoxide dismutase[J].Science,1999,284(805):805-808.
[18]AMY L C,BARTNIKAS T B,GITLIN JD,et al.Mechanisms of the copper-dependent turnover of the copper chaperone for superoxide dismutase[J].The Journal of Biological Chem istry,2006,281(19):13581-13587.
[19]BANCIL,BERTINII,BAFFONISC,et al.A ffinity gradients drive copper to cellular destinations[J].Nature,2010,10(465):1-4.
[20]ENDO T,FUJIIT,SATO K,etal.A pivotal role of Zn-binding residues in the function of the copper chaperone for SOD1[J].Biochem ical and Biophysical Research Communications,2000,276(3):999 -1004.
[21]HWANGA I K,EUMB W S,YOO K Y,et al.Copper chaperone for Cu,Zn-SOD supplement potentiates the Cu,Zn-SOD function of neuroprotective effects against ischem ic neuronal damage in the gerbil hippocampus[J].Free Radical Biology & Medicine,2005,39(3):392-402.
[22]TORRES A S,PETRIV,RAE T D,et al.Copper stabilizes a heterodimer of the yCCSmetallochaperone and its target superoxide dismutase[J].The Journal of Biological Chem istry,2001,276(42):38410 -38416.
[23]KACHUR A V,KOCH C J,BIAGLOW JE.Mechanism of copper-catalyzed autoxidation of cysteine[J].Free Radical Research,1999,31(1):23-34.
[24]BERTINATO J,LABBEM R.Coppermodulates the degradation of copper chaperone for Cu,Zn superoxide dismutase by the 26 S proteosome[J].The Journal of Biological Chem istry,2003,278(37):35071 -35078.
[25]MCLOUGHLIN D M,STANDEN C L,LAU K F,et al.The neuronal adaptor protein X11α interacts with the copper chaperone for SOD1 and regulates SOD1 activity[J].The Journal of Biological Chem istry,2001,276(12):9303-9307.
[26]W ILLIANNE IM,W IJMENGA C,BERGER R,et al.Cu,Zn superoxide dismutasematuration and activity are regulated by COMMD1[J].The Journal of Biological Chem istry,2010,285(37):28991 -29000.
*Corresponding author,professor,E-mail:zhouxq@sicau.edu.cn
(编辑 田艳明)
Activation Process of Copper/Zinc Superoxide Dismutase Mediated by CCS
TANG Ling1,2FENG Lin1,2LIU Yang1,2HU Kai1,2ZHOU Xiaoqiu1,2,3*
(1.Institute of Animal Nutrition,Sichuan Agricultural University,Ya’an625014,China;2.Fish Nutrition and Safety Production University Key Laboratary of Sichuan Province,Sichuan Agricultural University,Ya’an625014,China;3.Key Laboratory for Animal Disease-resistance Nutrition of China Ministry of Education,Sichuan Agricultural University,Ya’an625014,China)
CCS is the copper chaperone for copper/zinc-superoxide dismutase 1(SOD1)in cytoplasm.This review described the activation process of cytosolic SOD1 mediated by CCS.With the protein-protein interaction of CCS and SOD1,CCS can directly insert the copper ion into apoSOD1 and promote the formation of intramolecular disulfide bond in SOD1,then finish the activation of SOD1.The activity of CCS can be affected by X-linked inhibitor of apoptosis protein(XIAP),neuronal adaptor protein X11α and copper metabolism(Murr1)domain containing 1(COMMD1).[Chinese Journal of Animal Nutrition,2011,23(8):1259-1263]
CCS;copper;SOD1
S852.2
A
1006-267X(2011)08-1259-05
10.3969/j.issn.1006-267x.2011.08.001
2011-03-03
国家公益性行业(农业)科研专项(201003020)
唐 玲(1986—),女,重庆垫江人,硕士研究生,从事水生动物营养研究。E-mail:mm tanglingyy@163.com
*通讯作者:周小秋,教授,博士生导师,E-mail:zhouxq@sicau.edu.cn

