低聚异麦芽糖对产蛋鸡生产性能、盲肠微生物和免疫机能的影响
武书庚 高春起 张海军 田 方 齐广海*
(1.中国农业科学院饲料研究所,农业部饲料生物技术重点开放实验室,北京 100081;2.山东保龄宝生物股份有限公司,禹城 251200)
低聚异麦芽糖对产蛋鸡生产性能、盲肠微生物和免疫机能的影响
武书庚1高春起1张海军1田 方2齐广海1*
(1.中国农业科学院饲料研究所,农业部饲料生物技术重点开放实验室,北京 100081;2.山东保龄宝生物股份有限公司,禹城 251200)
本试验旨在研究饲粮中添加低聚异麦芽糖(IMO)对产蛋鸡生产性能、盲肠微生物菌群、机体抗氧化和免疫机能的影响。试验选取600只体重和产蛋率相近的200日龄海兰褐产蛋鸡,随机分成5 个处理(饲粮中分别添加0、0.1%、0.2%、0.4%和0.8%的 IMO),每个处理6 个重复,每个重复20只鸡。试验期8周。结果表明,与对照组相比,饲粮添加低剂量(0.1%和0.2%)IMO可在一定程度上改善平均蛋重、产蛋率、产蛋量和料蛋比,改善鸡蛋蛋白高度和哈夫单位;0.8%IMO组产蛋鸡的生产性能和鸡蛋品质均较低剂量组差。饲粮添加0.2%和0.4%IMO能显著增加产蛋鸡血浆球蛋白比例、降低尿素氮含量(P<0.05);0.2%IMO组能显著降低产蛋鸡盲肠食糜大肠杆菌的数量、增加乳酸杆菌和双歧杆菌的数量(P<0.05);0.2%和0.4%IMO组产蛋鸡血清中超氧化物歧化酶、谷胱甘肽过氧化物酶和总抗氧化酶活性显著升高(P<0.05);0.2% ~0.8%IMO组产蛋鸡血浆免疫球蛋白A、免疫球蛋白M、免疫球蛋白G和溶菌酶均显著提高(P<0.05)。结果提示,饲粮添加IMO可优化产蛋鸡盲肠菌群结构,提高产蛋鸡抗氧化和免疫功能,改善生产性能。产蛋鸡饲粮中IMO的适宜添加量为0.2%。
低聚异麦芽糖;产蛋鸡;生产性能;盲肠微生物;免疫机能
抗生素在杀死有害菌的同时也杀死了有益菌,且存在抗药性[1]、药物残留[2]等问题;产蛋鸡饲粮中不允许使用任何药物,故需提高其免疫力和抗病力。低聚异麦芽糖(isomalto-oligosaccharide,IMO)又称分枝低聚糖,是指葡萄糖残基之间至少有1个以α-1,6糖苷键结合而成的单糖数在2~5的一类低聚糖,主要包括异麦芽糖、潘糖、异麦芽三糖、异麦芽四糖等[3]。IMO不被动物机体消化吸收,可直接进入大肠内优先为双歧杆菌所利用,增加后者在机体肠道菌群中的数量[4-5],促进小肠蠕动,清除肠内有害物质[6-7],抑制腐败菌生长、减少其代谢产物,提高机体免疫力[8-9]。故IMO具有潜在的提高动物抗病力、改善动物生产性能的作用,但国内外关于IMO对产蛋鸡的影响鲜见报道。为此,本试验旨在研究IMO对产蛋鸡产蛋性能、鸡蛋品质、盲肠微生物、抗氧化和免疫机能的影响。
1 材料与方法
1.1 试验材料
IMO(900型,批次号:09091131)由山东保龄宝生物股份有限公司提供。
1.2 试验动物和设计
试验采用单因子完全随机区组设计,将200日龄体重和产蛋率相近的健康海兰褐产蛋鸡600只,随机分为5个处理(饲粮中分别添加0、0.1%、0.2% 、0.4%和 0.8%IMO),每个处理 6 个重复,每个重复20只鸡。每个处理分别采食1种试验饲粮,预试期1周,正试期8周。
1.3 试验饲粮
试验饲粮在参照 NY/T 33—2004和 NRC(1994)的基础上,结合海兰褐产蛋鸡饲养手册配制,试验采用玉米-豆粕-棉粕-花生粕(粉料)型饲粮(表1)。

表1 基础饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of the basal diet(air-dry basis) %
1.4 饲养管理
采用半开放式鸡舍3层立体笼养,每排相连的5个鸡笼(45 cm×30 cm×30 cm)作为1个重复,每笼4只鸡(共用150个鸡笼),各重复平均分布在上、中、下3排阶梯式笼养架上。
采用自然加人工补光,每天恒定光照16 h(自动照明控制系统),强度为14 LX。饲喂干粉料,自由采食,每天08:00和14:30各喂料1次,匀料4次;乳头式饮水器,自由饮水。按正常程序防疫,专人管理,每日捡蛋2次;每周带鸡消毒和清理鸡粪1次,常规免疫。
每天14:00记录温度和湿度、天气情况;随气候、季节和阳光而变化,试验期间温度变化范围在4.0~15.0 ℃;相对湿度在40% ~70%。
1.5 测定指标及方法
1.5.1 产蛋性能测定
以重复为单位记录每天产蛋数(包括软壳蛋、破壳蛋)、日产蛋量、死亡鸡数,每周记录产蛋鸡的耗料量。最后计算出每周和全期的产蛋率、日采食量、平均蛋重、料蛋比。
1.5.2 蛋品质测定
蛋壳强度、蛋壳厚度、蛋白高度、蛋黄颜色和哈氏单位采用以色列ORKA公司生产的系列鸡蛋品质测定仪进行测定,蛋形指数采用日本富士坪公司生产的蛋形指数测定仪测定,每2周1次,共4次。
1.5.3 血浆生化指标测定
用全自动生化分析仪(HITACHI-7600-020,日本)采用试剂盒法测定血浆尿素氮(BUN,UREA-GLDH法)、总蛋白(TP,双缩脲法)、白蛋白(TLB,溴甲酚绿法)、球蛋白(GLB,溴甲酚绿法)、总胆固醇(TC,CHOD-PAP法)和甘油三酯(TG,GPO-PAP法)的含量。所用试剂盒均购自南京建成生物工程研究所。
1.5.4 肠道微生物分析
于试验结束当日清晨喂料前,每重复屠宰2只(共60只)鸡,5%的新洁尔灭溶液浸泡5 m in,全身消毒;无菌条件下,将盲肠中段10 cm剪断,结扎两端带回实验室检测其中食糜双歧杆菌、大肠杆菌和乳酸杆菌含量。参照杨仕柳等[10]的方法,所用培养基均购于北京陆桥技术有限责任公司。菌群的数量用lg CFU/g盲肠内容物表示。
1.5.5 血清抗氧化指标测定
于试验结束喂料前,每重复随机选2只(共60只)鸡,各心脏采血 5 m L,3 000 r/m in离心15 m in,取上层血清,混匀,-20℃保存待测。
血清总抗氧化能力(T-AOC)、超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GSH-Px)活性及丙二醛(MDA)含量测定均在UV-2401紫外可见分光光度计上进行。所有试剂盒均购自南京建成生物工程研究所,操作过程严格按照试剂盒的说明进行。
1.5.6 血浆免疫球蛋白测定
试验结束当日喂料前,每重复随机选2只(共60只)鸡,翅静脉采血,分离血浆-20℃保存,测定血浆免疫球蛋白(IgA、IgM和IgG)含量。血浆IgA、IgG和 IgM 用试剂盒(Bethyl Laboratories,Montgomery,Texas,USA)按双抗体夹心法 ELISA测定。
1.5.7 血浆溶菌酶含量的测定
试验结束当日清晨喂料前,每重复随机选2只(共60只)鸡,翅静脉采血2 m L,分离血浆,-20℃保存。按 K reukniet等[11]方法,测血浆溶菌酶活性,用溶壁微球菌细胞作为反应底物。
1.6 数据处理
所有数据用Excel统计后,采用SAS(8.02)软件的ANOVA程序进行统计分析,用Duncan氏法进行差异显著性检验。试验结果均以“平均值±标准差”表示。
2 结果与分析
2.1 饲粮添加IMO对产蛋鸡产蛋性能的影响
试验期间各处理试验鸡状态良好,排便正常,无拉稀现象,无死亡。饲粮添加IMO对产蛋鸡生产性能的影响见表2。
平均蛋重:随着试验时间的延长,平均蛋重增加,0~4周平均蛋重约 61.49 g,5~8周为63.23 g;0~4周0.1%IMO 组平均蛋重最大,显著高于其他处理(P<0.05);5~8周0.1%IMO组平均蛋重最大,但各处理差异不显著(P>0.05);0 ~8 周平均蛋重62.36 g,也是0.1%IMO组最大,显著高于0.4%和0.8%IMO组(P<0.05),但 与 0.2%IMO 组 差 异 不 显 著 (P>0.05)。从平均蛋重角度,饲粮添加0.1% ~0.2%IMO即可满足需要,0.4%和0.8%IMO组表现较差。
产蛋率:因所选产蛋鸡正处于产蛋高峰期,几乎未受饲粮处理和产蛋日龄的影响,0~4周、5~8周和0~8周平均产蛋率分别为91.43%、91.38%和91.40%;各阶段0.4%IMO组的产蛋率均最高,0.8%IMO组较差,在0~4周2组差异达到显著水平(P<0.05)。
日产蛋量:日产蛋量同样未受饲粮处理和产蛋日龄的影响,0~4周、5~8周和0~8周平均产蛋量分别为 56.21、57.77 和 56.99 g/(只·d);虽然各处理差异不显著(P>0.05),但 0.1% ~0.4%IMO组均表现较好。
日采食量:因试验期间天气较冷,产蛋鸡日采食量较大,且随饲养试验的延长,产蛋鸡日采食量略有增加,0~4周、5~8周和0~8周平均日采食量分别为122.31、128.24 和 125.28 g;0 ~8 周对照组的日采食量较高,显著高于其他处理(P<0.05),各 IMO添加组之间差异不显著(P>0.05)。
料蛋比:因日采食量较高,造成料蛋比也较高,0~4周、5~8周和 0~8周分别为 2.18、2.22和2. 20;所有阶段,0.2%IMO组的料蛋均较低,显著低于对照组(P<0.05);其他IMO添加组对料蛋比也存在一定的改善趋势。
整个试验期内,低剂量(0.1%和0.2%)IMO对产蛋鸡平均蛋重、产蛋率、日产蛋量和料蛋比均有不同程度的改善;对照组和0.8%IMO组产蛋鸡的生产性能较差。
2.2 饲粮添加IMO对鸡蛋品质的影响
试验期间IMO对蛋壳厚度、蛋壳强度和蛋形指数均无显著影响(P>0.05),对蛋白高度和哈夫单位有一定影响(表3)。
蛋白高度:0~4周,0.1%和0.2%IMO组较高,显著高于0.8%IMO 组(P<0.05);5~8周和0~8周,0.2%IMO组均较高,显著高于对照组和0.8%IMO 组(P<0.05)。综上,饲粮中添加0.1% ~0.2%的IMO可改善鸡蛋的蛋白高度,且多加无益。
哈夫单位:0~4周和5~8周,0.2%IMO组的哈夫单位均较高,但与其他处理差异不显著(P>0.05);0~8周,0.2%IMO 组的哈夫单位显著高于对照组和0.8%IMO组(P<0.05),但与0.1%IMO 组差异不显著(P>0.05)。
综上,饲粮添加0.1%和0.2%IMO可改善蛋白高度和哈夫单位,且多加无益。
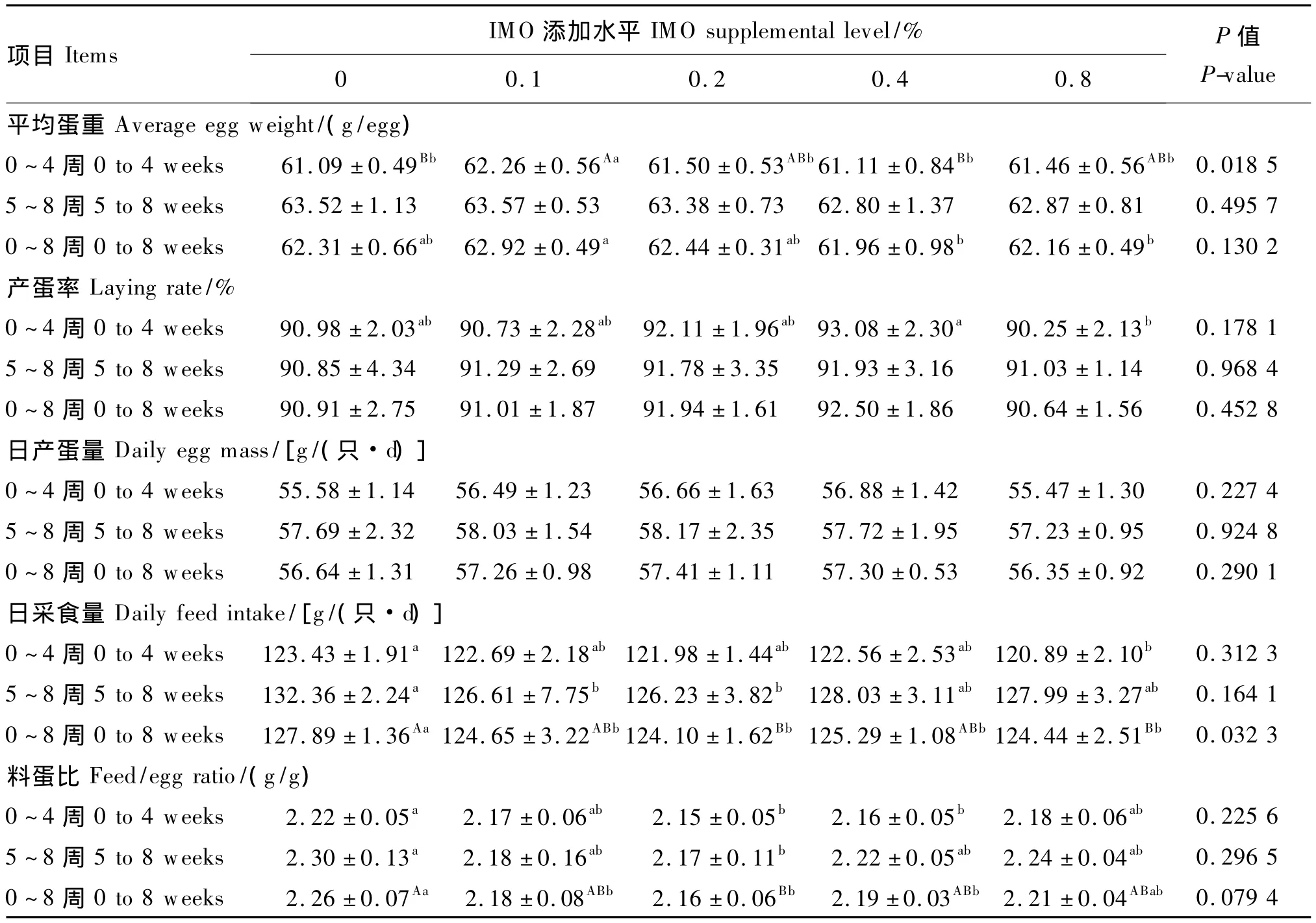
表2 饲粮添加IMO对产蛋鸡生产性能的影响Table 2 Effect of dietary IMO on performance of laying hens
2.3 饲粮添加IMO对产蛋鸡血浆生化指标的影响
由表4可知,饲粮添加IMO对产蛋鸡血浆总蛋白、白蛋白、球蛋白、甘油三酯和总胆固醇含量均无显著影响(P>0.05),但对白蛋白和球蛋白的比例(白球比)、尿素氮有一定影响。随着IMO添加量的增加,产蛋鸡血浆球蛋白所占比例有增加趋势,其中0.2% ~0.8%IMO组球蛋白比例显著高于对照组(P<0.05);血浆尿素氮含量有降低的趋势,其中0.2%和0.4%IMO组较低,显著低于对照组(P<0.05)。
综上,产蛋鸡饲粮添加IMO对血浆总蛋白无显著影响,但能增加球蛋白比例、降低尿素氮含量,其中0.2%和0.4%IMO组效果较好,对照组较差。
2.4 饲粮添加IMO对产蛋鸡盲肠微生物区系的影响
由表5可知,随饲粮IMO添加水平的增加,产蛋鸡肠道大肠杆菌的数量显著降低(P<0.01);与对照组相比,饲粮中添加0.1%IMO显著降低了产蛋鸡肠道大肠杆菌的数量(P<0.05),添加0.8%IMO 则进一步降低(P<0.01);0.2%IMO组肠道乳酸杆菌、双歧杆菌的数量均较高,显著高于对照组(P<0.05)。
饲粮添加IMO可降低产蛋鸡肠道大肠杆菌的数量,增加乳酸杆菌和双歧杆菌的数量,其中0.2%IMO对乳酸杆菌和双歧杆菌的增加效果最好。
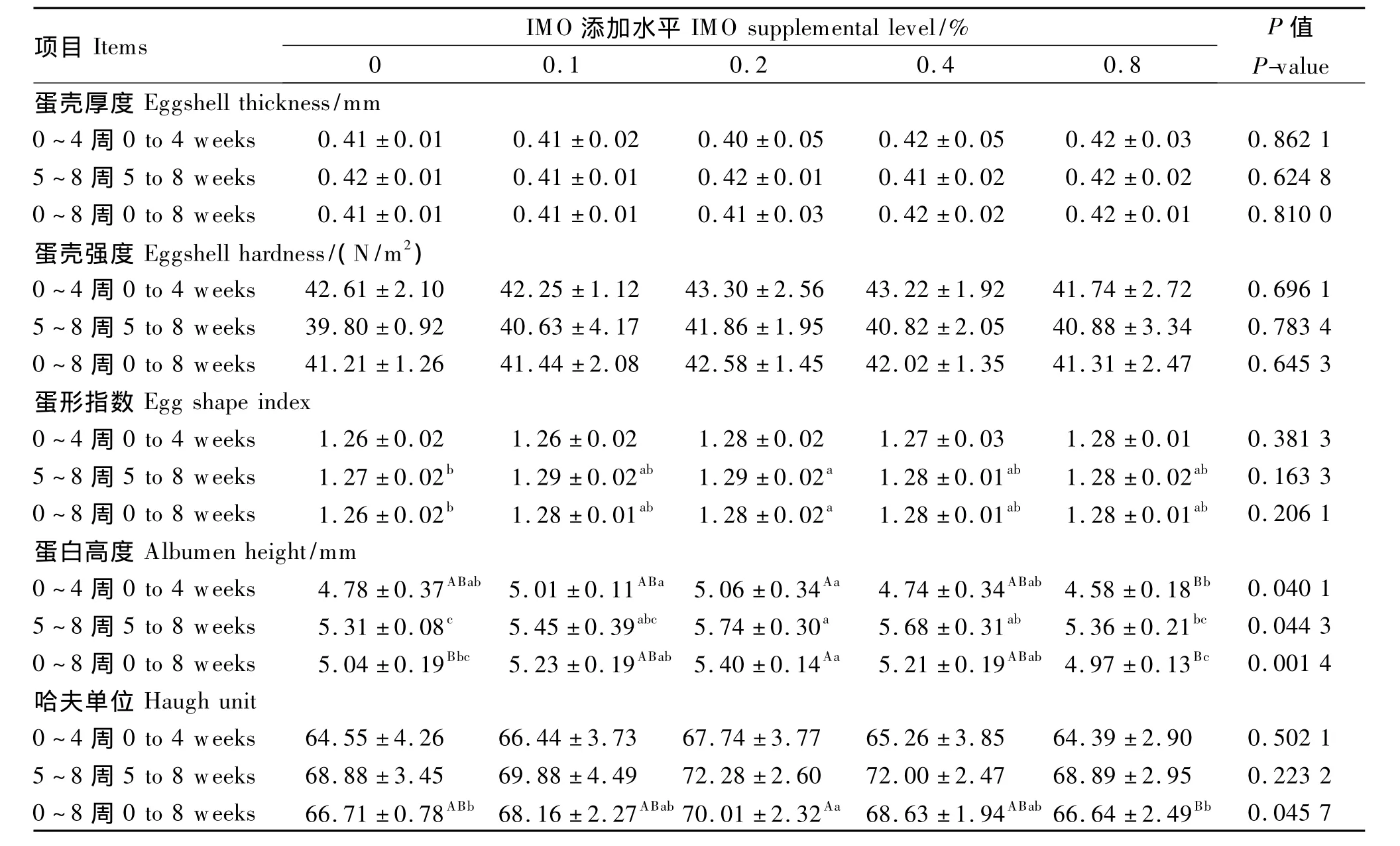
表3 饲粮添加IMO对产蛋鸡蛋品质的影响Table 3 Effect of dietary IMO on egg quality of laying hens
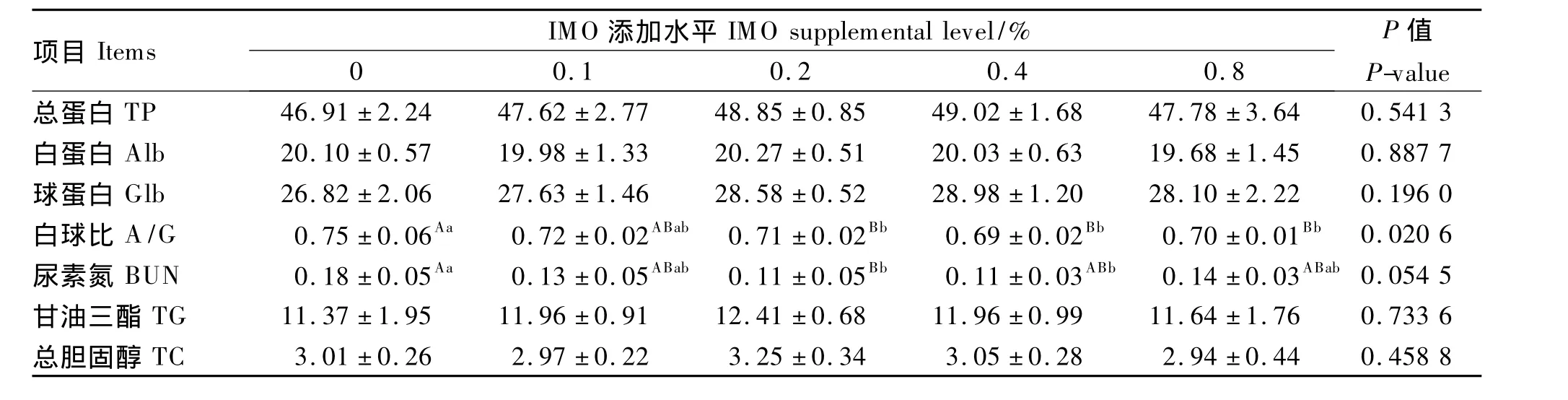
表4 饲粮添加IMO对产蛋鸡血浆生化指标的影响Table 4 Effect of dietary IMO on the plasma biochem ical parameters of laying hens mmol/L

表5 饲粮添加IMO对产蛋鸡盲肠细菌数量的影响Table 5 Effect of dietary IMO on the cecal bacterial population of laying hens
2.5 饲粮添加IMO对产蛋鸡抗氧化性能的影响
由表6可知,SOD:随饲粮IMO添加剂量从0增加到0.4%,产蛋鸡血清SOD活性升高,其中0.4%和0.2%IMO组较高,显著高于对照组和0.8%IMO 组(P<0.01),对照组最低。
GSH-Px:随饲粮IMO添加剂量从0增加到0.4%,产蛋鸡血清 GSH-Px活性升高,其中0.4%和0.2%IMO组较高,显著高于对照组(P<0.05),对照组最低。
T-AOC:随饲粮IMO添加剂量从0增加到0.4%,产蛋鸡血清 T-AOC增加,其中0.4%IMO组最高,显著高于对照组(P<0.01),对照组最低。
MDA:所有IMO添加组产蛋鸡血清MDA的含量均存在低于对照组的趋势,但只有0.8%IMO组达到显著水平(P<0.01)。
综上,随饲粮IMO添加剂量从0增加到0.4%,产蛋鸡血清中 SOD和 GSH-Px活性及T-AOC的升高趋势明显,0.2%和0.4%IMO组均较高,显著高于对照组;IMO有降低血清MDA含量的趋势,但仅有0.8%IMO组达到显著水平。
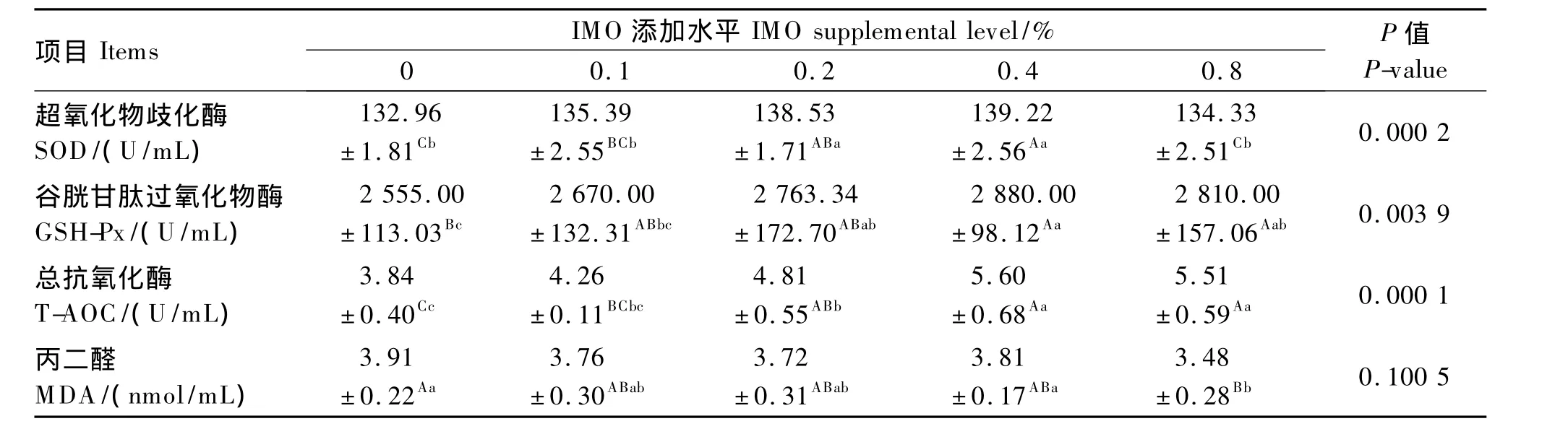
表6 饲粮添加IMO对产蛋鸡血清中抗氧化酶活性和MDA含量的影响Table 6 Effect of dietary IMO on the antioxidant enzyme activities and MDA content in serum of laying hens
2.6 饲粮添加IMO对产蛋鸡免疫机能的影响
由表7可知,IgA:0.2%IMO组最高,显著高于最低的对照组(P<0.01);各 IMO处理(0.1% ~0.8%)之间均差异不显著(P>0.05)。
IgM:各 IMO 处理(0.1% ~0.8%)之间均差异不显著,但均显著高于对照组(P<0.01)。
IgG:0.2% ~0.8%IMO 组较高,组间差异不显著(P>0.05),但均显著高于对照组(P<0.01),0.1%IMO 组与对照组差异不显著(P>0.05)。
溶菌酶:0.2% ~0.8%IMO 组较高,组间差异不显著(P>0.05),但均显著高于 0.1%IMO组和对照组(P<0.01)。
对于所测定的产蛋鸡免疫指标,0.2% ~0.8%IMO组均显著高于对照组。饲粮添加0.1%IMO不足以增强免疫力。
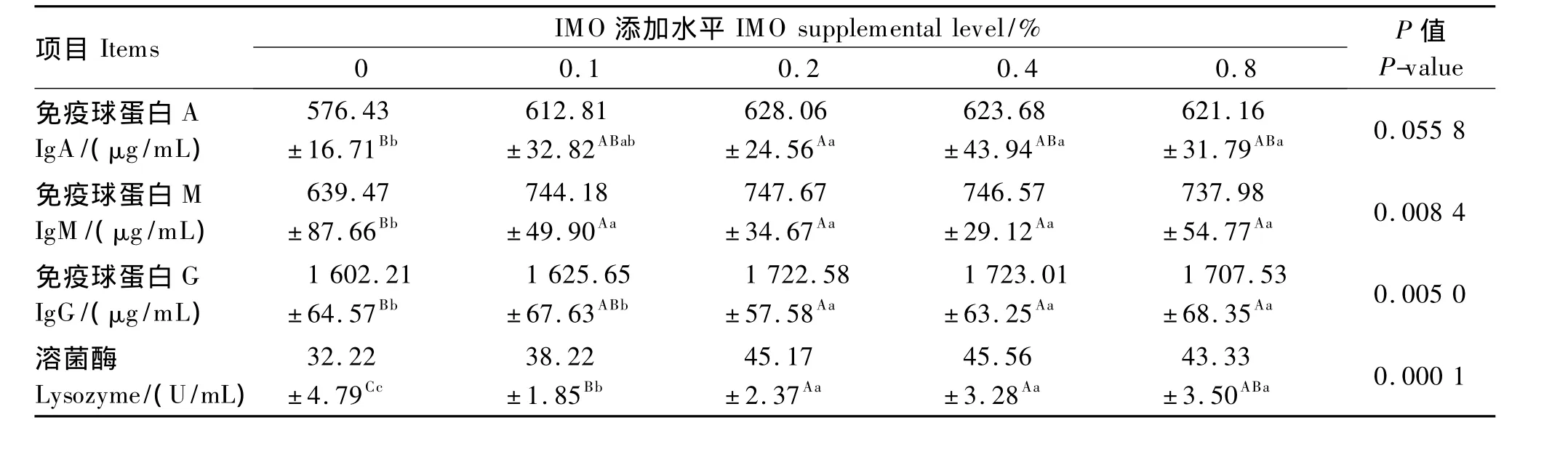
表7 饲粮添加IMO对产蛋鸡免疫机能的影响Table 7 Effect of dietary IMO on immune function of laying hens
3 讨论
IMO是一种新型功能性低聚糖,具有良好的理化特性和生理功能。本试验结果表明,低剂量(0.1%和0.2%)IMO对产蛋鸡平均蛋重、产蛋率和产蛋量均有不同程度的改善;对照组和0.8%IMO组的生产性能较差。过去的研究表明饲粮添加0.2%IMO可显著降低产蛋鸡的料蛋比,改善肉仔鸡饲料转化率[12];0.4%IMO 可促进断奶仔猪生长,降低料重比[13],这些研究表明 0.2% ~0.4%的IMO可以改善动物的生产性能,与本研究一致。产生上述结果的原因可能是:IMO可调整产蛋鸡肠道微生物菌群平衡,为动物建立正常的微生物区系[4-5,14],从而改善产蛋鸡的饲料转化率和产蛋性能。
关于IMO对鸡蛋品质的影响,目前在国内外研究较少。本研究结果表明,饲粮添加0.1%和0.2%IMO可改善蛋白高度和哈夫单位,添加0.8%IMO对鸡蛋品质未见改善;IMO的添加对蛋壳厚度、蛋壳强度和蛋形指数的影响均不显著,可能是因为鸡蛋的这些品质主要受遗传、繁殖等因素影响,添加IMO不足以使其改变。
本研究结果表明,饲粮添加IMO可降低肠道大肠杆菌数量,增加乳酸杆菌和双歧杆菌数量,其中添加0.2%IMO对乳酸杆菌和双歧杆菌的增加效果明显。IMO能明显抑制大肠杆菌的增殖,促进双歧杆菌和乳酸菌的增殖[15],其主要原因在于双歧杆菌和乳酸杆菌能产生糖苷酶,水解IMO产生葡萄糖,葡萄糖又能作为这些有益菌的营养物质,促进其增殖;另外,双歧杆菌和乳酸杆菌分解IMO产生的酸性物质对大肠杆菌有抑制作用,因而IMO可抑制大肠杆菌的增殖[16]。
正常机体的氧化损伤和抗氧化体系处于动态平衡中,机体代谢产生的活性氧(ROS)能不断地被抗氧化防御体系清除,以维持细胞氧化和还原的稳态。自由基过度产生和机体抗氧化防御体系功能严重受损时,过多自由基会导致机体氧化应激,造成细胞和生物分子的氧化损伤,造成脂质过氧化,产生脂质过氧化物(MDA)。T-AOC是机体抗氧化力量的总体体现,机体抗氧化酶[主要包括SOD、过氧化氢酶(CAT)、GSH-Px等]能清除多种自由基。本研究结果表明,随着饲粮添加IMO剂量(0~0.4%)的增加,产蛋鸡血清中 SOD和GSH-Px的活性及T-AOC升高趋势明显,0.2%和0.4%IMO组均较高,显著高于对照组;IMO有降低血清MDA含量的趋势,但仅0.8%IMO组达到显著水平。饲粮添加0.2%的IMO可显著提高产蛋鸡血清中SOD的活性,这可能与0.2%IMO组对乳酸杆菌和双歧杆菌的明显增加有关。
免疫是动物机体识别和清除非自身大分子物质、保持体内外平衡的生理反应。动物机体的免疫功能主要是通过免疫分子(免疫球蛋白、细胞因子和补体)等来发挥作用,提高抗体免疫应答能力,增加动物体液及细胞免疫能力,免疫球蛋白(IgG、IgM、IgA等)是主要的免疫分子。溶菌酶主要由巨噬细胞分泌,是非特异性免疫的效应物,通过降解细菌多糖细胞壁杀灭细菌,保护机体免受感染[17]。本研究结果表明,IMO可显著增加产蛋鸡血浆IgG、IgM 和溶菌酶的含量,0.2% ~0.8%IMO组均显著高于对照组,说明一定剂量的IMO可显著改善产蛋鸡免疫功能,增强疾病抵抗力。Schroedl等[18]研究表明低聚糖可提高仔猪和牛血浆中IgA、IgM和IgG的含量,增加细胞分裂素释放,提高白细胞介素Ⅱ水平,能诱导免疫功能的活化,从而增强机体的细胞免疫和体液免疫。
4 结论
① 饲粮添加低剂量(0.1%和0.2%)IMO可改善产蛋鸡平均蛋重、产蛋率、产蛋量和料重比,改善蛋白高度和哈夫单位;饲粮添加0.2%和0.4%IMO可增加产蛋鸡血浆球蛋白比例、降低血浆尿素氮含量;饲粮添加0.2%IMO对产蛋鸡盲肠食糜中乳酸杆菌和双歧杆菌含量的增加明显;饲粮添加0.2%和0.4%IMO组产蛋鸡血清中SOD和GSH-Px的活性及T-AOC升高趋势明显;0.2% ~0.8 IMO组的产蛋鸡免疫指标均较高,饲粮添加0.1%IMO不足以增加其免疫力。
②饲粮添加IMO可以降低产蛋鸡肠道大肠杆菌数量,增加乳酸杆菌和双歧杆菌数量,改善免疫机能,增加抗氧化活性;对血浆总蛋白无显著影响。对照组和0.8%IMO组产蛋鸡的生产性能和鸡蛋品质较差。
③产蛋鸡饲粮中IMO的适宜添加量为 0.2%。
[1]AARESTRUP F M.Association between the con-sumption of antim icrobial agents in animal husbandry and the occurrence of resistant bacteria among food animals[J].International Journal of Antim icrobial A-gents,1999,12:279 -285.
[2]TURNIDGE J.Antibiotic use in animals-prejudices,perceptions and realities[J].The Journal of Antim icrobial Chemotherapy,2004,53:26-27.
[3]LIY J,ZHAO G Y,DU W,et al.Effect of dietary isomaltooligosaccharides on nutrient digestibility and concentration of glucose,insulin,cholesterol and triglycerides in serum of grow ing pigs[J].Animal Feed Science and Technology,2009,151:312-315.
[4]THITARAM SN,CHUNG C H,DAY D F,et al.Isomaltooligosaccharide increases cercalBifidobacteriumpopulation in young broiler chickens[J].Poultry Science,2005,84(7):988-1003.
[5]付萍,冉陆,赵熙,等.不同剂量异麦芽低聚糖调节人体肠道菌群的试验研究[J].中国微生态学杂志,1999,11(4):198 -199.
[6]CHEN H L,LU Y H,LIN JJ,et al.Effects of isomalto-oligosaccharides on bowel functions and indicators of nutritional status in constipated elderly men[J].Journal of the American College of Nutrition,2001,20(1):44-49.
[7]WANG H F,LIM P S,KAO M D,et al.Use of isomalto-oligosaccharide in the treatment of lipid profiles and constipation in hemodialysis patients[J].Journal of Renal Nutrition,2001,11(2):73-79.
[8]M IZUBUCHIH,YAJIMA T,AOIN,et al.Isomalto-oligosaccharides polarize Th1-like responses in intestinal and system ic immunity inm ice[J].Nutritional Immunology,2005,135:2857-2861.
[9]ZHANGW F,LID F,LU W Q,et al.Effects of isomalto-oligosaccharides on broiler performance and intestinalm icroflora[J].Poultry Science,2003,82:657-663.
[10]杨仕柳,戴求仲,蒋桂韬,等.壳聚糖饲用微生物制剂对湘黄鸡免疫指标和肠道菌群的影响[J].湖南农业大学学报:自然科学版,2006,32(5):529-532.
[11]KREUKNIET M B,NIEUWL M G B,VAN DER ZIJPP A J.Phagocytic activity of two lines of chickens divergently selected for antibody production[J].Veterinary Immunology and Immunopathology,1994,44:371-387.
[12]冯敏山,宋金昌,李素芬,等.微生态制剂和异麦芽低聚糖对产蛋鸡产蛋性能和免疫力的影响[J].中国饲料,2007,20:6 -10.
[13]刘雪兰,谢幼梅,韩绍忠,等.异麦芽低聚糖提高断奶仔猪生产性能机理的研究[J].山东农业科学,2002(5):33-36.
[14]KANEKO T,YOKOYAMA A,SUZUKIM.Digestibility characteristics of isomaltooligosaccharides in comparison with several saccharine using the rat jejunum loop method[J].Bioscience,Biotechnology,and Biochem istry,1995,59(7):1190-1194.
[15]张宏福,徐秀容,卢庆萍,等.异麦芽低聚糖对早期断奶仔猪肠道主要菌群的影响[J].动物营养学报,2001,13(3):47 -51.
[16]刘雪兰,谢幼梅,韩绍忠,等.异麦芽低聚糖对断奶仔猪肠道菌群及腹泻的影响[J].中国畜牧杂志,2003,39(5):24 -26.
[17]高俊.酵母培养物对肉仔鸡的作用及其机理[D].博士学位论文.北京:中国农业科学院,2008.
[18]SCHROEDL W,JAEKEL L,KRUEGER M.C-reactive protein and antibacterial activity in blood plasma of colostrums-fed calves and the effectof lactulose[J].Journal of Dairy Science,2003,86(10):3313-3320.
*Corresponding author,professor,E-mail:guanghai.qi@gmail.com
(编辑 何丽霞)
Effect of Dietary Isom alto-oligosaccharide on Perform ance,Caecal Microflora and Immune Function of Laying Hens
WU Shugeng1GAO Chunqi1ZHANG Haijun1TIAN Fang2QIGuanghai1*
(1.Key Laboratory of Feed Biotechnology of Ministry of Agriculture,Feed Research Institute,The Chinese Academy of
Agricultural Sciences,Beijing100081,China;2.BAOLINGBAO Biology Co.,Ltd.,Yucheng251200,China)
The experiment was conducted to study the effect of dietary isomalto-oligosaccharide(IMO)on performance,caecalm icroflora,antioxidation and immune function of laying hens.Six hundred Hy-Line variety brown laying hens aged 200 days were random ly allotted into 5 groups,and each group was replicated 6 times,with 20 birds per replicate.Laying hens in the five groups were fed with the basal diet supplemented with 0,0.1%,0.2%,0.4%and 0.8%of IMO,respectively.The experiment lasted for 8 weeks.The results showed as follows:compared with the control group,average egg weight,laying rate,egg mass,feed/egg ratio,albumen height and Haugh unit of laying hens in 0.1%and 0.2%IMO groups were improved to a certain extent.The laying performance and egg quality of laying hens in 0.8%IMO group were lower than those in 0.1%and 0.2%IMO groups.Globulin/album in ratio(Glb/A lb)in plasma of laying hens in 0.2%and 0.4%IMO groupswas increased(P<0.05),while urea nitrogen contentwas reduced(P<0.05).The number ofLactobacillusandBifidobacteriumin caecum of laying hens in 0.2%IMO group was increased(P<0.05),while that ofE.coliwas decreased(P<0.05).Compared with the control group,the activities of superoxidedismutase(SOD),glutathione peroxidase(GSH-Px),and total antioxidative capacity(T-AOC)in serum of laying hens were significantly increased by 0.2%and 0.4%IMO supplementation in diets(P<0.05).When 0.2%to 0.8%IMO was added in diets,the contents of IgA,IgMand IgG and lysozyme activity in plasma of laying hens were all increased(P<0.05).In conclusion,dietary IMO can improve the performance,optim ize caecalm icroflora,and enhance the anti-oxidative ability and immunological function of laying hens.The appropriate supplemental level of IMO in the diet of laying henswas 0.2%.[Chinese Journal of Animal Nutrition,2011,23(9):1560-1568]
isomalto-oligosaccharide;laying hens;performance;caecalm icroflora;immune function
S816.7
A
1006-267X(2011)09-1560-09
10.3969/j.issn.1006-267x.2011.09.015
2011-04-02
现代农业产业技术体系(CARS-41-K13)、家禽产业技术体系北京市创新团队项目资助
武书庚(1972—),男,河北平乡人,博士,副研究员,主要从事动物营养调控研究。E-mail:wushugeng@mail.caas.net.cn
*通讯作者:齐广海,研究员,博士生导师,E-mail:guanghai.qi@gmail.com
——称蛋重

