抗DR5单抗CTB006联合5-FU对结直肠癌细胞系作用研究
高旭,周正,沈恩允,景晓娟,郭雷鸣,王仙斌,孙劲文,杜云峰
·论著·
抗DR5单抗CTB006联合5-FU对结直肠癌细胞系作用研究
高旭,周正,沈恩允,景晓娟,郭雷鸣,王仙斌,孙劲文,杜云峰
目的探讨肿瘤坏死因子相关诱导配体受体(DR5)激动型单抗 CTB006 对人结直肠癌细胞系 SW1116、SW480、SW620、Colo205 的影响。
结直肠肿瘤; 受体,TNF 相关凋亡诱导配体; 药物协同作用; 氟尿嘧啶
www.cmbp.net.cn 中国医药生物技术,2011,6(2):106-110
结直肠癌发病率和病死率在国内外有逐年上升的趋势,其中我国死亡率达到 7.42/10万[1]。尽管外科技术不断提高,但根治术后 5 年生存率仍徘徊在 50% 左右,故多数学者主张综合治疗[2]。在生物治疗领域,肿瘤坏死因子相关的凋亡诱导配体受体 TRAIL-R1(death receptor4,DR4)及TRAIL-R2(death receptor5,DR5)具有介导细胞凋亡的特性,TRAIL受体激动剂(包括 TRAIL 和激动型抗体)成为国际上研究新方向。本实验室利用人源化抗人 DR5 激动型单克隆抗体 CTB006,结合临床结直肠癌 Duke’s 临床分期,分别选用SW1116(Duke’s A 期)、SW480(Duke’s B 期)、SW620(Duke’s C 期)和 Colo205(Duke’s D 期)结直肠癌细胞,研究 CTB006 对之诱导凋亡作用,同时观察治疗效果和受体表达有无相关性,并与化疗药物 5-氟尿嘧啶(5-FU)联用,观察有无协同杀伤作用,为 CTB006 的临床肿瘤治疗提供实验依据。
1 材料与方法
1.1 材料
抗人 DR5 单克隆抗体 CTB006 由北京同为时代生物技术有限公司提供;不同分期结直肠癌细胞 SW1116、SW480、SW620、Colo205 和人胚肺成纤维细胞(HELF)购自美国模式菌种收藏中心(ATCC);细胞培养材料、胎牛血清(FBS)购自美国 GIBCO 公司;ATPlite 检测试剂盒购自美国PerkinElmer 公司(批号:0RD00694);羊抗人IgG-RPE(批号:1031-09)、羊抗人 RPE(批号:A0808-PB59)为美国 Southern Biotech 公司产品;5-FU 为上海旭东海普药业有限公司产品(批号:090807)。BHP9504-2 型微孔板发光分析仪为北京滨松光子技术有限公司产品;Cytomics™ FC500 型流式细胞仪为美国 Beckman Coulter 公司生产。
1.2 方法
1.2.1细胞培养 将 SW1116、SW480、SW620 和HELF 细胞培养于含 10% FBS、0.1% 青霉素 + 链霉素的 DMEM 培养液;Colo205 细胞培养于含 10 mmol/L HEPES缓冲液、1 mmol/L 丙酮酸钠、10% FBS、0.1% 青霉素 + 链霉素的 RPMI 1640 培养液。在 37 ℃,含 5% CO2的培养箱中培养 2 ~ 5 d,用 0.25% 胰酶消化,以 1∶1 ~ 1∶3传代,收集对数生长期、生长状态良好的细胞进行实验。
1.2.2ATPlite 法检测抗人 DR5 单抗 CTB006 与 5-FU 合用对结直肠癌细胞系增殖的影响
1.2.2.1实验分组及剂量 把 SW1116、SW480、SW620、Colo205 分别设 CTB006 组、CTB006 + 5-FU 合用组和 5-FU 组。CTB006 组给予剂量分别为 1.88、0.94、0.47、0.24、0.12 nmol/L,1 h 后 CTB006 组和联合用药组加羊抗人 RPE 二抗;5-FU 组剂量分别为 1600、800、400、200、100 μmol/L;CTB006 + 5-FU 合用组依照上述两药浓度梯度共同给药。另设 CTB006 和 5-FU 单用组用于评价CTB006对 HELF 细胞的靶向治疗作用。各组均设阴性对照[3]。
1.2.2.2ATPlite 法检测细胞存活率[4]用 0.25%胰蛋白酶消化细胞,用含相应 DMEM 或 RPMI1640培养液配成 6 × 104个/L 单个细胞悬液,按每孔50 μl 接种于 96 孔板,CO2孵箱(37 ℃,5% CO2)内培养 24 h 后加上述各组药物,每组 3 个复孔,每孔终体积为 100 μl。48 h 后依照 ATPlite 试剂盒说明每孔加入 50 μl 细胞裂解液,震荡 3 min。吸取裂解上清 50 μl 于酶标板中,再加入 25 μl 发光液,震荡 10 s 后,避光静置 3 min。将孵育好的酶标板放入发光仪,读取发光值。使用 BHP9504微孔板发光分析仪 4.3.32 软件进行数据处理。细胞存活率(survival rate)=(样品发光值平均值/对照组发光值平均值)× 100%。实验重复 3 次,取平均值。
评价联合用药对肿瘤细胞的抑制是否有协同作用,采用两种药物联合作用系数(combination index,CI),CI = AB/(A × B),根据活细胞数(发光度值)进行计算。AB 是两药联合组与对照组的比值;A 和 B 是各药单独使用组与对照组的比值。如 CI < 1,证明两药作用性质为协同;如 CI = 1,则两药无相互作用;如 CI > 1,则两药作用性质为拮抗[5]。
1.2.3流式细胞仪技术检测结直肠癌细胞系表面DR5 表达 将消化好的结直肠癌细胞,用含 2% FBS 的 PBS 洗液 524 ×g离心 4 min。细胞尽量要求为单个。计数后将细胞稀释为 2 × 106个/ml,加入 96 孔圆底板中,每孔 50 μl。将 CTB006 稀释为 15 nmol/L,取 50 μl 与细胞混合,使终浓度为 7.5 nmol/L。冰上孵育 1 h。洗液洗 2 次,524 ×g离心,每次 4 min。羊抗人 IgG-RPE 1∶250 稀释,取 20 μl 加入各孔中,混匀细胞。同时设只加二抗的阴性对照。冰上孵育 15 min。洗液 524 ×g洗 2 次,每次 4 min。每管加入 300 μl 洗液,4 ℃ 下放置,30 min 内上机检测。用 WinMID 2.9 软件分析结果,求出各株细胞表面DR5与抗体结合率Gated%。实验重复 3 次,取平均值。
1.3 统计学方法
2 结果
2.1 抗人 DR5 单抗 CTB006 的靶向治疗作用
四株结直肠癌细胞及 HELF 均生长状态良好。SW1116、SW480、SW620 为贴壁生长,Colo205为半悬浮生长。5-FU 对 HELF 细胞增殖抑制明显,且呈剂量依赖,浓度为 100 μmol/L 时细胞生存率为(89 ± 1)%,400 μmol/L 时细胞生存率为(60 ± 1.3)%,1600 μmol/L 时细胞生存率为(40 ± 2)%,;CTB006 对 HELF 细胞随浓度变化细胞生存率维持在(98 ± 5)%,无增殖抑制作用。
2.2 抗人 DR5 单抗 CTB006 与 5-FU 对结直肠癌细胞抑制增殖的影响
不同浓度 CTB006、5-FU 以及联合用药组对结直肠癌 4 株细胞系存活率的影响见图 1。CTB006 对早期结直肠癌细胞 SW1116 抑制增殖效果欠佳;对中晚期结直肠癌细胞 SW480、SW620 和 Colo205 有着良好的抑制增殖作用。对单一细胞取药物浓度为 CTB006 0.47 nmol/L 和 5-FU 400 μmol/L 时的细胞存活率,采用完全随机设计的方差分析对结果进行分析,分析其不同作用方式差异。SW1116(F= 12.38,F0.01(2,6)= 10.92,12.38 >F0.01(2,6),P< 0.01);SW480(F= 7.92,F0.05(2,6)= 5.14,7.92 >F0.05(2,6),P< 0.05);SW620(F= 54.46,F0.01(2,6)= 10.92,54.46 >F0.01(2,6),P< 0.01);Colo205 (F= 57.92,F0.01(2,6)= 10.92,57.92 >F0.01(2,6),P<0.01)。认为 CTB006、5-FU 和联合用药三种不同给药方式作用后,总体存活率均数不全相等,存在统计学差异,即不同给药方式的抑瘤效果有差别(P< 0.05)。采用随机区组设计分析 CTB006 不同浓度对四株结直肠细胞存活率差异(F= 20.21,F0.01(3,12)= 5.95,20.21 >F0.01(3,12),P< 0.01),认为相同浓度的 CTB006 对 4 种不同细胞的抑瘤效果有差别(P< 0.01)。当 CTB006 联合使用 5-FU后,对中晚期细胞 SW480、SW620 和 Colo205 杀伤效果明显提升,并呈剂量依赖关系,CI < 1 表现为协同作用(表 1)。对于早期结直肠细胞 SW1116,CI ≥ 1,两药作用表现为拮抗或相加。

图1 抗人 DR5 单抗 CTB006 与 5-FU 合用对结直肠癌细胞系增殖的影响(±s,n = 3)Figure 1 The inhibitory effect of anti-human DR5 monoclonal antibody CBT006 combined with 5-FU on the proliferation of colorectal cancer cell lines (±s,n = 3)
表1 CTB006 和 5-FU 联合作用系数(CI)(±s,n = 3)Table 1 Combination index of CBT006 and 5-FU (±s ,n = 3)
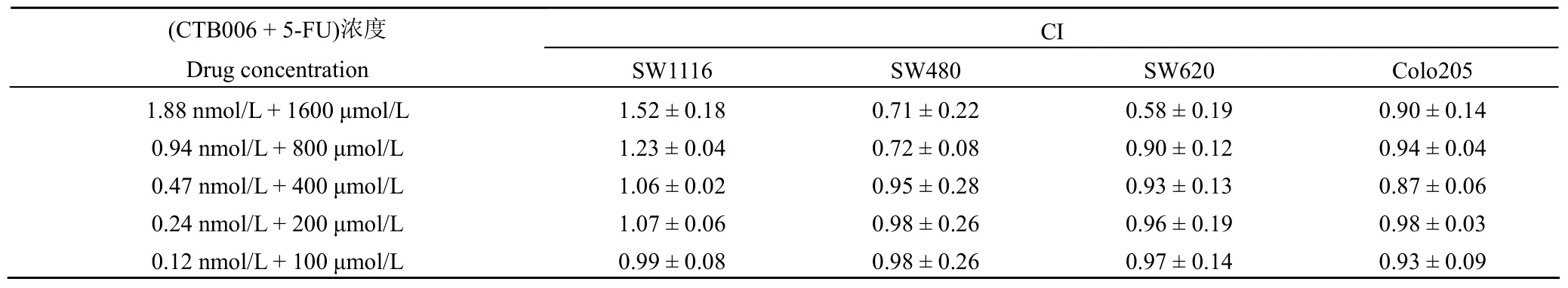
表1 CTB006 和 5-FU 联合作用系数(CI)(±s,n = 3)Table 1 Combination index of CBT006 and 5-FU (±s ,n = 3)
?
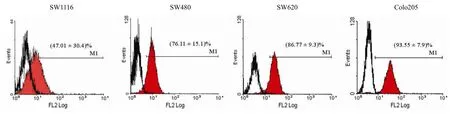
图2 结直肠癌细胞膜表面 DR5 表达水平Gated%(±s,n = 3)(空心黑色图形为阴性对照组 DR5 结合率,红色图形为该细胞表面 DR5 表达情况)Figure 2 The expression of colorectal cancer cell surface DR5 levels (±s,n = 3) (The hollow black graphics for DR5 binding negative control group,the red graphic expression of the cell surface DR5)
2.3 不同结直肠癌细胞表面 DR5 表达水平差异
不同分期结直肠癌肿瘤细胞表面 DR5 的表达水平有较大的差异。早期 SW1116 细胞 DR5 的表达水平较低,早中期 SW480 细胞呈中水平表达DR5,中晚期 SW620、Colo205 细胞呈中高水平表达 DR5(图 2)。采用 Gated% 指标利用区组方差分析统计,不同结直肠癌细胞表面的 DR5 表达水平有统计学差异(F = 5.17,F0.05(3,12)= 3.49,5.17 > F0.05(3,12),P < 0.05)。
3 讨论
3.1 抗 DR5 单克隆抗体的药理作用
肿瘤细胞对化疗药物的耐药是导致治疗失败的主要原因,且长期使用化疗药物存在大量毒副作用。肿瘤坏死因子相关的凋亡诱导配体(TRAIL)能诱导多种肿瘤细胞和转化细胞发生凋亡,降低毒副反应,而 TRAIL 是通过其受体 DR4 (TRAIL-R1)及 DR5(TRAIL-R2)结合介导肿瘤细胞凋亡的[6]。DR4、DR5 属于 TNFR(TNF receptor)基因超家族,均为 I 型跨膜蛋白,两者有 55% 同源。两者在细胞外区域都含有两段富含半胱氨酸的结构域(cysteine-rich domains,CRDs),细胞内区域有与TNFR、Fas 等同源的一段 70 个氨基酸的死亡结构域(death domain,DD)。由于都含有 DD,DR4 和 DR5 在与 TRAIL 结合后都可传导死亡信号而诱导细胞凋亡,所以被称作死亡受体,它们可在人体多种组织中表达[7]。
但一些研究发现,TRAIL 对正常肝细胞有毒性作用,限制了其临床应用[8]。Ichikawa等[9]实验表明抗 DR4、DR5 单克隆抗体能模拟 TRAIL 诱导肿瘤细胞凋亡,且对人正常肝细胞没有毒副作用。虽然 DR4 和 DR5 在 4 ℃ 与 TRAIL 具有相似的结合力,但在 37 ℃ DR5 与 TRAIL 的亲和力最强[10]。LaVallee 等[11]研究表明,TRAIL 与临床常用化疗药物对肿瘤细胞具有协同杀伤作用,提示TRAIL 死亡受体(DR4、DR5)的功能性单抗亦可能增强化疗药物杀伤肿瘤细胞作用。上述结果说明,DR5 在 TRAIL 诱导细胞凋亡方面十分重要。
3.2 抗 DR5 单克隆抗体的临床应用
近年来国内外报道文献多为鼠源性单抗[12–13],在临床治疗中主要存在的问题是产生人抗鼠抗体(HAMA)反应,而且尚未见针对其进行临床分期系统性研究,亦未见到应用人源化抗体协同 5-FU增效作用的报告。本实验采用的人源性抗人 DR5特异性单克隆抗体 CTB006,HAMA 反应率较鼠源性单抗低,且从美国 ATCC 引进了针对结直肠癌临床 Duke’s 分期的细胞系 SW1116(Duke’s A期)、SW480(Duke’s B 期)、SW620(Duke’s C 期)和Colo205(Duke’s D 期),结合 5-FU 进行协同作用研究。
本研究表明:相对于 5-FU,人源 DR5 单抗CTB006 并未见对正常细胞株 HELF 有抑制作用,符合目前低毒、高效的分子靶向药物治疗趋势。CTB006 对早期 SW1116 抑制增殖效果欠佳,联合应用 5-FU 主要表现为拮抗作用。我们认为可能是因为早期结直肠癌组织癌变只侵犯黏膜层,恶变程度低,细胞表面 DR5 表达量亦低,从而导致抗体效应较差。这也与目前临床应用指南中对于Duke’s A 期患者不推荐使用辅助性化疗不谋而合。CTB006 对中晚期结直肠癌细胞 SW480、SW620 和Colo205 有着良好的增殖抑制作用,抑制率可达到 40% ~ 90%,CTB006 联合应用 5-FU,存在显著的协同增效趋势,达到相同疗效时可以显著减少两者的用量,减少毒副作用的同时保证疗效。
结合流式细胞仪检测细胞 DR5 表达量分析可得出细胞抑制率和细胞膜表面 DR5 表达量呈正相关。我们认为随病程进展,结直肠癌细胞表面 DR5表达逐步升高,引发该效应靶点反应增加,从而使药效增强。虽然国际上普遍认为死亡受体膜表达与细胞杀伤存在联系可能性不大,但在目前尚未寻找到更好的高效指示剂的条件下检测膜表面受体表达量不失为一个弥补办法[14]。据报道多种化疗药物可上调 DR5 表达增强治疗效果[15],从另一方面提供了其作为指示剂的佐证。
由于我们选用细胞的局限性,目前我们针对Duke’s 临床分期结果观察到的研究结果还需扩展细胞系种类来验证。另外,还有待于进一步从分子机制深化实验研究,从而为今后动物实验和临床工作提供依据。
[1] Zhao P. Cancer deaths have been reported in China: Review of the third national sample survey of death cause. Beijing: People’s Medical Publishing House,2010:77. (in Chinese)赵平. 中国肿瘤死亡报告:全国第三次死因回顾抽样调查. 北京:人民卫生出版社,2010:77.
[2] Hao XS. Abdominal Oncology. Beijing: People’s Medical Publishing House,2003:523. (in Chinese)郝希山. 腹部肿瘤学. 北京: 人民卫生出版社,2003:523.
[3] Flis S,Gnyszka A,Misiewicz-Krzemińska I,et al. Decytabine enhances cytotoxicity induced by oxaliplatin and 5-fluorouracil in the colorectal cancer cell line Colo-205. Cancer Cell Int,2009,9:10.
[4] Cree IA,Andreotti PE. Measurement of cytotoxicity by ATP-based Iuminescence assay in primary cell cultures and cell lines. Toxicology in Vitro,11(5):553-556.
[5] Chou TC. Preclinical versus clinical drug combination studies. Leuk Lymphoma,2008,49(11):2059-2080.
[6] Wiley SR,Schooley K,Smolak PJ,et al. Identification and
characterization of a new member of the TNF family that inducesapoptosis. Immunity,1995,3(6):673-682.
[7] Pan G,O’Rourke K,Chinnaiyan AM,et al. The receptor for the cytotoxic ligand TRAIL. Science,1997,276(5309):111-113.
[8] Jo M,Kim TH,Seol DW,et al. Apoptosis induced in normal human hepatocytes by tumor necrosis factor-related apoptosis-inducing ligand. Nat Med,2000,6(5):564-567.
[9] Ichikawa K,Liu W,Zhao L,et al. Tumoricidal activity of a novel anti-human DR5 monoclonal antibody without hepatocyte cytotoxicity. Nat Med,2001,7(8):954-960.
[10] Truneh A,Sharma S,Sliverman C,et al. Temperature-sensitive differential affinity of TRAIL for its receptors. J Biol Chem,2000,275(30):23319-23325.
[11] LaVallee TM,Zhan XH,Johnson MS,et al. 2-methoxyestradiol up-regulates death receptor5 and induces apoptosis through activation of the extrinsic pathway. Cancer Res,2003,63(2):468-475.
[12] Li SL,Du JF,Zhang J,et al. Effects of anti-human DR5 monoclonalantibody (mDRA-6) on Jurkat cell. J Henan Univ (Med Sci),2007,26(1):28-31. (in Chinese)李淑莲,都景芳,张军,等. 抗人DR5单克隆抗体(mDRA-6)对Jurkat细胞作用研究. 河南大学学报(医学版),2007,26(1):28-31.
[13] Buchsbaum DJ,Zhou T,Grizzle WE,et al. Antitumor efficacy of TRA-8 anti-DR5 monoclonal antibody alone or in combination with chemotherapy and/or radiation therapy in a human breast cancer model. Clin Cancer Res,2003,9(10 Pt 1):3731-3741.
[14] Wiezorek J,Holland P,Graves J. Death receptor agonists as a targeted tTherapy for cancer. Clin Cancer Res,2010,16(6):1701-1708.
[15] Yang A,Wilson NS,Ashkenazi A. Proapoptotic DR4 and DR5 signaling in cancer cells: toward clinical translation. Curr Opin in Cell Biol,2010,22(6):837-844.
Effects of the combination of anti-human DR5 monoclonal antibody and 5-Fluorouracil on the proliferation of colorectal cancer cells in vitro
GAO Xu,ZHOU Zheng,SHEN En-yun,JING Xiao-juan,GUO Lei-ming,WANG Xian-bin,SUN Jin-wen,DU Yun-feng
ObjectiveTo approach the effects of the combination of tumor necrosis factor-related inducing ligand receptor (DR5) monoclonal antibody CBT006 and 5-Fluorouracil (5-FU) on the proliferation of human colorectal cancer cells.MethodsATPlite assay was used to detect the influences of CBT006 and 5-FU alone or in combination on the proliferation of human colorectal cancer cells including SW1116,SW480,SW620 and Colo205 in different pathological stages. The expression of cell surface DR5 levels were examined by using flow cytometry. In the end,we investigated the relationship between the influences and the expression level of DR5.ResultsCTB006 and 5-FU decreased the survival of the colorectal cancer SW1116,SW480,SW620 and Colo205 cells. There exited bad effect on the proliferation of SW1116 at an early pathological stage by CTB006,but it showed a good inhibitory effect of the growth of advanced colorectal cancer SW480,SW620 and Colo205 cells. There was a synergistic effect of the combination of CBT006 and 5-FU on the survial of advanced colorectal cancer cells. By flow cytometry,DR5 expression levels were (47.01 ± 30.4)%,(76.11 ± 15.1)%,(86.77 ± 9.3)%,(93.55 ± 7.9)% in SW1116 cells,SW480 cells,SW620 cells and Colo205,respectively.ConclusionsCBT006 showed strong inhibitory effect on the proliferation of advanced colorectal caner cells and exerted synergistic effects on these cancer cells when combined with 5-FU.
Colorectal neoplasms; Receptor,TNF-related apoptosis-inducing ligand; Drug synergism; Fluorouracil
s:ZHOU Zheng,Email: zhzh0386_cn@sina.com; SHEN En-yun,Email: eyshen@cotimesbiotech.com
10.3969/cmba.j.issn.1673-713X.2011.02.005
063000 唐山,华北煤炭医学院研究生部(高旭、王仙斌);100028 北京,煤炭总医院普外肿瘤科(周正、孙劲文、杜云峰);100176北京同为时代生物技术有限公司(沈恩允、郭雷鸣);100091 北京,中国人民解放军总参谋部总医院内分泌科(景晓娟)
周正,Email:zhzh0386_cn@sina.com;沈恩允,Email:eyshen@cotimesbiotech.com
2010-12-09
方法采用 ATPlite 法检测 CTB006 组、5-FU 组及两药物合用组作用后的细胞存活率,流式细胞仪技术检测细胞系表面 DR5 的表达水平,研究两者之间的关系。
结果CTB006 和 5-FU 对四种结直肠癌细胞增殖均表现出抑制作用。CTB006 对早期细胞 SW1116 增殖抑制效果欠佳,对中晚期细胞 SW480、SW620、Colo205 有着良好的增殖抑制作用(P < 0.05)。当联合使用 5-FU 后,对后三者有明显的协同作用。流式细胞仪检测 DR5 表达水平,SW1116 细胞表达(47.01 ± 30.4)%,SW480 细胞表达(76.11 ± 15.1)%,SW620 细胞表达(86.77 ± 9.3)%,Colo205 细胞表达(93.55 ± 7.9)%。
结论 CTB006 对中晚期结直肠癌杀伤作用较强,联用5-FU 具有显著的协同作用。
Author Affiliations:Graduate Department of North China Coal Medical University,Tangshan 063000,China (GAO Xu,WANG Xian-bin); Oncology and General Surgery Department,Coal General Hospital,Beijing 100028,China (ZHOU Zheng,SUN Jin-wen,DU Yun-feng); Beijing Cotimes Biotechnology Co.,Ltd,Beijing 100176,China (SHEN En-yun,GUO Lei-ming); Endocrinology Department of General Hospital of PLA General Staff Headquarters,Beijing 100091,China (JING Xiao-juan)
www.cmbp.net.cn Chin Med Biotechnol,2011,6(2):106-110

