暹罗鳄鱼鳞胶原蛋白多肽对小鼠免疫功能的影响
王凤林 万林春 李谨谨 张硕峰
1.武警总医院药剂科,北京 100039;2.江西省食品药品检验所,江西 南昌 330029;3.北京中医药大学,北京 100102
胶原蛋白多肽是胶原蛋白经蛋白酶酶解后的产物,其生物活性主要体现在提高免疫活性、降血压、调血脂、抗氧化、活化细胞机能和抑制肿瘤活性等方面[1]。另外,胶原蛋白多肽还具有改善皮肤的功效。津田友香等从鱼皮中得到水解胶原三肽,并证明具有促进人皮肤成纤维细胞胶原和透明质酸的生成、改善皮肤弹性的作用[2]。Koyama等[3]发现胶原蛋白多肽能提高皮肤真皮和表皮的功能。在美国、德国、日本等国家,许多高档化妆品中添加有胶原蛋白。美国CTFA化妆品原料手册录用的天然物质和《功能性化妆品原料》中,都有胶原蛋白或其水解产物[4-5]。文献报道中多为各种鱼鳞胶原蛋白的免疫增强作用。因此,本实验以小鼠为研究对象,探讨暹罗鳄鱼鳞胶原蛋白多肽对正常小鼠免疫功能的影响。
1 材料与方法
1.1 材料与试剂
鱼鳞胶原蛋白肽:购自山东省青州隆贝生物科技有限公司,暹罗鳄鱼鳞胶原蛋白多肽[鲁卫食证字(2008)第370781-005179号)]:鳄鱼皮购自养殖场,胶原蛋白自制;制法:用热水烫鳄鱼皮,使鱼鳞自皮上脱落,得到的鱼鳞剪成小块,加0.05 mol/L NaOH溶液(W∶V=l∶6)浸泡1 h,水洗至中性。再加0.2%硫酸溶液(W∶V=l∶6)浸泡1 h,水洗至中性,最后用热水抽提过夜,4000 r/min离心20 min,弃去沉淀不溶物,得到粗胶制品,浓缩后,45℃低温蒸干。称取制备的胶原蛋白,用100 mL pH 9.0的缓冲液(0.02 mol/L)溶解制成l%的胶原溶液。加中性蛋白酶(酶与底物比为l∶20)并在45℃水浴中水解5 h后,15 min沸水浴中灭活酶,离心(4000 r/min)15 min。用超滤膜对上清液进行超滤处理,得到多肽,于冷冻干燥机中冻干,备用;清洁级BALB/C小鼠,18~22 g,购自北京大学医学部实验动物中心,SCXK《京》2006-0009;刀豆蛋白A(ConA)购自 Sigma公司;MTT、Hanks液(pH 7.2~7.4)、RPMI1640完全培养液、碘硝基氯化四氮唑(INT)、吩嗪二甲酯硫酸盐(PMS)、环磷酰胺(CTX)、台盼兰等。
1.2 方法
1.2.1 分组与给药 将BALB/c小鼠,每组10只随机分为6个组:对照组、模型组、鱼鳞胶原蛋白多肽400 mg/kg组、暹罗鳄鱼鳞胶原蛋白多肽200、400、800 mg/kg组。造模同时开始灌胃给药,每天1次,连续15 d。对照组给予饮用水0.2 mL/10 g体重。
1.2.2 造模方法 除对照组外,其余各组小鼠腹腔注射环磷酰胺,0.6 mg/次,每日1次,共3次,对照组腹腔注射等量生理盐水0.2 mL/10 g体重。
1.2.3 小鼠脾淋巴细胞的制备 用750 mL/L酒精浸泡处死后的小鼠,无菌条件下获取其脾脏。脾脏置于100目网上轻轻碾碎,滤过后加入试管中,离心(1000 r/min)5 min,将细胞洗涤后弃去上清液,用1640培养液重悬细胞至4 mL,轻轻铺于小鼠淋巴细胞分离液(3 mL,比重 1.088)上,离心(2000 r/min)20 min。吸取单核淋巴细胞(PBL),1000 r/min离心,计数细胞,用1640(含10% FCS)调整PBL的密度至5×106/L待用。
1.2.4 ConA诱导小鼠T淋巴细胞转化实验 连续对小鼠灌胃15 d,将其颈椎脱臼处死,无菌条件下获取其脾脏,用镊子将脾在盛有适量无菌Hanks液的小平皿中轻轻撕碎,200目筛网过滤制成单细胞悬液,悬液分为2部分,用于转化实验备用。细胞悬液用Hanks液洗涤2次,每次进行10 min(1000 r/min)离心,然后将细胞悬浮于1 mL的完全培养液中,台盼兰染色计数活细胞数(在95%以上),将细胞浓度调整为3×106个/mL。每份细胞悬液分两孔加入24孔培养板中,每孔1 mL,一孔加75μL ConA液作为实验,另一孔作为对照,置培养箱中培养72 h。培养结束前4 h,每孔吸去上清液0.7 mL,加入0.7 mL不含血清的RPMI 1640培养液,同时加入MTT 50μL/孔,继续培养4 h。培养结束后,每孔加入1 mL酸性异丙醇,吹打混匀,使紫色结晶完全溶解。然后分装到96孔培养板,每孔做3个平行孔,用酶标仪以570 nm波长测定光密度值。以实验孔与对照孔OD的差值代表淋巴细胞增殖能力。
1.2.5 小鼠NK细胞杀伤功能实验 采用LDH释放法。将小鼠脾细胞悬液(5×106/L)加入96孔细胞培养板内,100μL/孔。将体外传代培养的YAC-1靶细胞离心,并调整细胞密度为1×108/L,加于 96孔培养板中,100μL/孔(1×104细胞/孔),置37℃、CO2培养箱中培养4 h。同时设自然释放和最大释放组。以1000 r/min离心5 min,吸取上清100μL,加入LDH底物液100μL,静置30 min显色。随后加入0.1 mol/L的HCl终止反应,于波长490 nm读取A值,参照马安伦等[6]计算NK细胞的杀伤率。
1.3 统计学处理
2 结果
2.1 胶原蛋白多肽对淋巴细胞增殖功能的影响
结果表明给药组小鼠T淋巴细胞的增殖功能较环磷酰胺组小鼠的功能有明显上升。特别是鳄鱼胶原肽中、高剂量组变化更为明显(与模型组比较,P<0.01)。见表1。
表1 鳄鱼胶原肽对环磷酰胺致免疫功能损伤小鼠脾淋巴细胞增殖功能的影响()
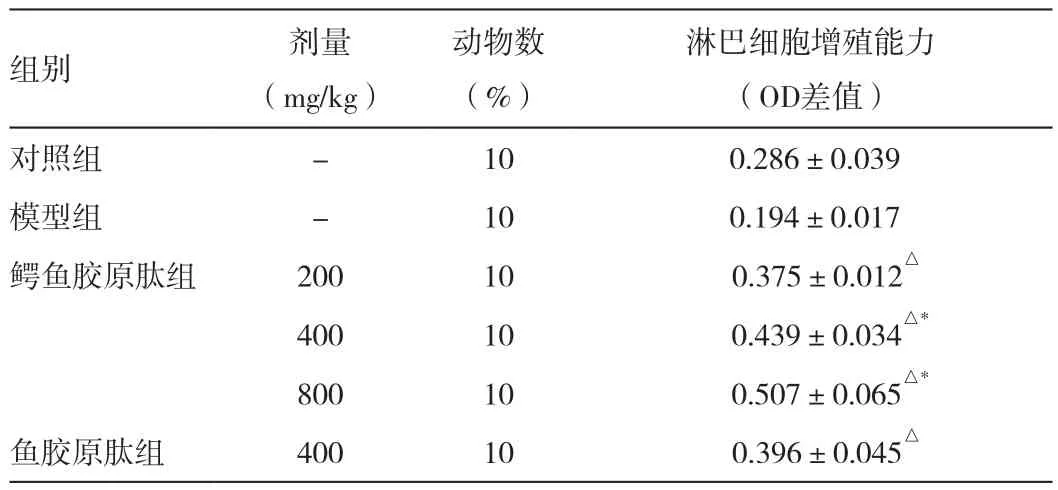
表1 鳄鱼胶原肽对环磷酰胺致免疫功能损伤小鼠脾淋巴细胞增殖功能的影响()
注:与对照组比较,△P<0.05;与模型组比较,*P<0.01
组别 剂量(mg/kg)淋巴细胞增殖能力(OD差值)对照组 - 10 0.286±0.039模型组 - 10 0.194±0.017鳄鱼胶原肽组 200 10 0.375±0.012△400 10 0.439±0.034△*800 10 0.507±0.065△*鱼胶原肽组 400 10 0.396±0.045△动物数(%)
2.2 胶原蛋白多肽对小鼠NK细胞杀伤活性的影响
不同组别的NK细胞杀伤结果显示,胶原蛋白肽不仅对环磷酰胺的免疫抑制效应具有拮抗作用,而且具有正向免疫调节作用,可提高小鼠的免疫功能,且呈一定的剂量依赖性。不同剂量的胶原蛋白多肽的NK细胞杀伤活性与环磷酰胺组相比,也有不同程度的提高。见表2。
表2 鳄鱼胶原肽对环磷酰胺致免疫功能损伤小鼠NK细胞杀伤活性的影响()

表2 鳄鱼胶原肽对环磷酰胺致免疫功能损伤小鼠NK细胞杀伤活性的影响()
注:与对照组比较,△P<0.05;与模型组比较,*P<0.01
组别 剂量(mg/kg)NK细胞活性转换数据对照组 - 10 72.81±10.52 0.594±0.078模型组 - 10 60.94±54.15 0.494±0.103鳄鱼胶原肽组 200 10 105.43±15.78 0.683±0.178△400 10 181.78±45.73 0.723±0.472△800 10 232.94±19.47 0.846±0.546△*鱼胶原肽组 400 10 163.17±63.39 0.717±0.329△动物数(只)NK细胞活性(%)
3 讨论
近年来,鳄鱼进入我国境内,形成一门新的特种动物养殖业,国内养殖以暹罗鳄、湾鳄、尼罗鳄为主。国家林业局在2003年公布可以商业开发的54种野生动物中,就包括暹罗鳄在内的多种鳄鱼品种,这些品种都为人工养殖的子二代。随着鳄鱼人工养殖的成功,其价值得到多方面的开发,包括旅游观赏、餐饮、时装皮具等。鳄鱼皮主要用于制作高档皮具,鱼鳞却成了工业垃圾。如何提取、利用鱼鳞的胶原蛋白多肽将会成为水产综合开发的新突破。
本研究所先前研究表明,采用环磷酰胺作为免疫抑制剂处理的小鼠,其T淋巴细胞增殖功能、NK细胞的杀伤功能明显低下。给予小鼠灌胃鳄鱼胶原蛋白多肽后,小鼠T淋巴细胞的增殖功能、NK细胞的杀伤活性,均具有免疫增强作用(P<0.05),并呈剂量依赖性。由此可知,暹罗鳄鱼鳞胶原蛋白多肽是可以开发成为增强免疫力保健食品的。
[1]郭瑶,曾名勇,崔文萱.水产胶原蛋白及胶原多肽的研究进展[J].水产科学,2006,25(2):101-102.
[2]贺玉琢.水解胶原在皮肤的应用[J].国外医学(中医中药分册),2005,27(4):246-248.
[3]Koyama Y,Sakashita A,Kuwaba K,et al.Effects of oral ingestionof collagen peptide on the skin[J].Fragrance Journal,2006,34(6):82-85.
[4]张铭让,林炜.皮胶原蛋在化妆品与蛋白饮料中的应用[J].北京皮革,2000,25(10):42.
[5]裘炳毅.化妆品化学与工艺技术大全[M].北京:中国轻工业出版社,1997:197.
[6]马安伦,葛海良,张冬青.抗CD94 mAb与NK细胞、γδ+T细胞及CTL功能的关联[J].细胞与分子免疫学杂志,2001,17(2):164-165.

