Bt对分月扇舟蛾体毒性及体内保护酶系影响1)
李燕利 胡春祥 高佳
(东北林业大学,哈尔滨,150040)
分月扇舟蛾(Clostera anastomosis L.)属鳞翅目,舟蛾科,是我国广大林区常发生的一种林木虫害。全国各地林区均有发生,在东北地区的阔叶次生林及人工林内较为常见。主要危害山杨及其它杨、柳类树木。近几年,分月扇舟蛾虫害屡有发生,且危害严重[1],常大面积爆发成灾,严重影响树木的生长和生态效益的发挥[2]。
Bt是一种对人畜安全、无环境污染的微生物杀虫剂,在农、林害虫的防治中发挥了重要作用[3]。关于Bt杀虫蛋白对昆虫的作用机制大多数研究主要集中在昆虫组织病理学观察和杀虫蛋白与中肠上皮细胞膜之间的结合作用上,对昆虫的保护酶活性影响的研究报道则相对较少。保护酶是昆虫体内最主要的三大酶系之一,已有报道证实Bt引起昆虫的保护酶系变化[4-5]。超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和过氧化物酶(POD)是生物体内普遍存在的3种防御氧化损伤的重要保护酶。SOD的作用是把O-2·歧化成H2O2,H2O2能与O-2·形成毒性更强的氢氧自由基(HO·),但细胞内的CAT可以将H2O2转化成水,生物体内的几种保护酶处于一种动态平衡状态,使自由基维持在一个低水平,起到保护生物机体的作用[6]。一旦保护酶系遭到破坏,导致机体内氧自由基浓度过高,自由基超强的氧化能力将破坏生物功能分子机制,使细胞功能受到威胁[7]。国内外关于Bt杀虫蛋白对昆虫的作用机制大多数研究主要集中在昆虫组织病理学观察和杀虫蛋白与中肠上皮细胞膜之间的结合作用上,对昆虫的保护酶活性影响的研究只见于转基因作物方面[8-10],而对鳞翅目的林业害虫保护酶系影响的研究还未见报道,因此,本研究从抗氧化防御角度研究Bt对分月扇舟蛾幼虫体内保护酶活性的影响,对于深入了解Bt对鳞翅目昆虫的作用机理具有重要意义。
1 材料与方法
1.1 供试昆虫
分月扇舟蛾采自黑龙江省大庆市杜尔伯特蒙古族自治县新店林场,采后在室内饲养1 d,用毛笔挑取龄期大小一致的幼虫进行毒力和酶活力测定。
1.2 毒力测定
采用叶片药膜法,将Bt粉剂用蒸馏水配成50.0、10.0、5.0、1.0、0.5、0.1 ng·L-1,以蒸馏水处理作对照。将未接触过药剂的杨树叶片在稀释药液中浸10 s,阴干,用蘸有充足水分的脱脂棉裹住叶柄,放入透气性良好的透明养虫瓶(直径9 cm、高14 cm)中。挑选分月扇舟蛾5龄幼虫接到杨树叶片上,每瓶放入15头,重复4次。置于温度为(28±0.5)℃,光周期12 h/d的恒温养虫室饲养。每隔1~2 d换1次叶片,换叶片时把幼虫的粪便清理干净,分别于12、24、36、48、72 h后检查死亡数。用毛笔轻触幼虫,对刺激物无反应者视为死亡。数据用POLO软件处理,计算LC30、LC50及其95%置信区间。
1.3 酶活性测定
酶液制备:根据室内毒力测定结果,选择48 h的LC30(9 ng·L-1)和LC50(17 ng·L-1)2个质量浓度剂量处理分月扇舟蛾5龄幼虫,在12、24、48、72 h后取健壮、活泼的幼虫5头,加入5 mL 0.05 mol·L-1,pH值7.0预冷的磷酸缓冲液(含1%PVP、0.04%苯基硫脲和0.01 mol·L-1EDTA),冰浴下充分匀浆后,于4℃,10 000 r/min下离心15 min,取上清液为待测酶液。
超氧化物歧化酶测定:参考Beauchamp等[11]方法。在试管中加入3 mL反应液(含50 mmol·L-1,pH=7.0磷酸缓冲液,13 mmol·L-1甲硫氨酸,10 mmol·L-1EDTA,75 mmol·L-1NBT)和0.01 mL酶液,最后加入0.4 mmol·L-1核黄素0.6 mL,以不加酶液管作为最大光还原管,4 000 lx下光照20 min后,立即避光,迅速测定A560值,以未光照的相同反应管为对照管,50%抑制率所需的酶量为一个酶活性单位(U),测定重复3次,计算SOD酶活性,酶活力单位以U·min-1·mg-1表示,每处理重复3次。
过氧化氢酶测定:取30%H2O20.5~0.6 mL,加水至50 mL,从中取出4 mL,加入0.05 mol·L-1磷酸缓冲液(pH值7.0)26 mL,测定240 nm处1 cm光路OD值,如其OD值在0.50~0.55,即作为过氧化氢酶的底物溶液,取已预温至25℃的底物溶液3 mL,在25℃条件下加入粗酶液30 μL,立即用紫外分光光度计在240 nm下每隔30 s测定一次,记录2 min。酶活力单位以U·min-1·mg-1表示,每处理重复3次。
过氧化物酶测定:参考Simon[12]方法。在试管中分别加入0.1 mol·L-1、pH值6.0的磷酸缓冲液1.8 mL,0.1%愈创木酚1 mL,酶液0.05 mL和0.08%H2O21 mL,混匀后,反应20 min,以蒸馏水为对照,于470 nm处测定OD值。酶活力单位为U·min-1·mg-1。
蛋白含量测定:参照Bradford[13]记述的考马斯亮兰蓝G-250染色法测定。
1.4 数据统计分析
采用POLO软件计算Bt对分月扇舟蛾5龄幼虫的LC30、LC50及95%置信区间。对同一质量浓度处理下不同时间对酶活性影响的差异采用SPSS16.0软件LSD方法进行方差分析。
2 结果与分析
2.1 Bt对分月扇舟蛾幼虫的毒力
Bt对分月扇舟蛾5龄幼虫的毒力测定结果如表1所示:LC30和LC50随着处理时间的增长而逐渐减小,其中36 h LC30是48 h的2.876倍,72 h LC30是48 h的1.526倍;36 h LC50是48 h的4.539倍,72 h LC50是48 h的1.469倍。说明随着处理时间的增加,Bt对分月扇舟蛾幼虫的毒力增强。

表1 Bt对分月扇舟蛾5龄幼虫的毒性
2.2 Bt对分月扇舟蛾SOD的影响
Bt对分月扇舟蛾5龄幼虫体内SOD的影响见表2。与对照相比,9 ng·L-1的Bt处理后,分月扇舟蛾体内的SOD活性呈平缓的趋势增加,分别增加了5.8%、10.0%、14.1%、19.9%,但均无显著差异。这说明较低质量浓度的Bt对分月扇舟蛾体内的SOD活性有激活作用,只是随着处理时间的增加,对SOD活性的激活作用不明显,这可能是较低质量浓度的Bt并没有对分月扇舟蛾幼虫造成很大的伤害。17 ng·L-1的Bt处理后,SOD活性呈现先升高后降低的趋势,在48 h时达到最大值,为对照的1.704倍,而后开始下降,但均高于对照,24、48、72 h表现为差异极显著(p<0.01)。说明在处理12~48 h分月扇舟蛾体内超氧自由基数量大增,使SOD活性增加,但是随着处理时间的增大,过量的超氧自由基使SOD活性受到抑制,以致在72 h时,SOD的活性有所降低。SOD酶活性:LC50>LC30>CK。Bt质量浓度越高,对SOD酶活性的激活作用越大。而2种处理都在48 h时达到最大值,72 h出现下降的趋势,说明随处理时间增长,分月扇舟蛾体内积累的Bt抑制了SOD清除体内产生的O-2·,因而导致其中毒。

表2 Bt对分月扇舟蛾5龄幼虫SOD活性的影响
2.3 Bt对分月扇舟蛾CAT的影响
由表3可见,9 ng·L-1的Bt处理后,CAT活性呈明显的上升趋势,并在72 h时达到最大值。在48、72 h的CAT活性升高显著,分别是对照的1.238、1.307倍,并表现出差异极显著(p<0.01)。17 ng·L-1的Bt处理后,各处理时间的CAT酶活性均略高于对照但变化平缓,分别比对照增加了8.4%、8.7%、3.0%、5.6%,只有在处理24 h后,达到差异显著(p<0.01)。

表3 Bt对分月扇舟蛾5龄幼虫CAT活性的影响
CAT活性高于对照组,这可能是清除由免疫反应产生的大量自由基的需要。9 ng·L-1处理组与17 ng·L-1处理组相比,CAT酶活性增加了,可能是低质量浓度的Bt能够激活CAT,提高了体内清除H2O2的能力,而当Bt的质量浓度过大时,超过了机体所能承受的阈值,不能激活CAT,酶活性变化水平不大,不能主动清除体内产生的H2O2,从而对分月扇舟蛾产生毒害作用。
2.4 Bt对分月扇舟蛾POD的影响
Bt对分月扇舟蛾POD的影响见表4。取食9 ng·L-1的Bt后,在处理72 h中,分月扇舟蛾体内POD活性呈显著上升的趋势,且各处理时间的POD活性与对照相比,差异均极显著(p<0.01),在各时间段的酶活性分别是对照的2.789、3.432、1.277、8.077倍,在72 h时达到最高值。取食17 ng·L-1的Bt后,POD活性不断升高,并均高于对照,在处理12、24 h时POD活性呈平缓的上升趋势,而在48、72 h时有显著升高,并表现出差异极显著(p<0.01),分别是对照的3.014、3.165倍。
POD主要作用是清除生物体内代谢后期的有害物质。由此可见,随着取食时间的推移,分月扇舟蛾体内的POD显著升高,说明其抵抗Bt胁迫的能力强,能够提高自身体内的POD活性以清除体内过量的H2O2,维持细胞内H2O2的平衡,从而适应外界环境。
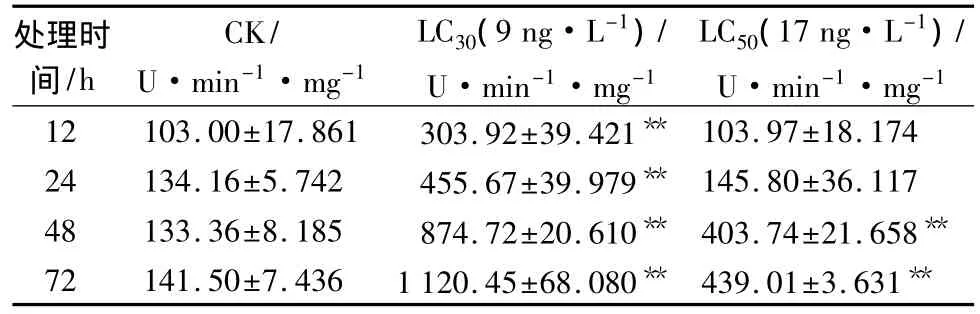
表4 Bt对分月扇舟蛾5龄幼虫POD活性的影响
3 结论与讨论
昆虫保护酶系活性与杀虫剂、昆虫病毒、微孢子虫等外界刺激物的强度及昆虫耐药性和抗逆性等相关[6,14-16]。研究表明,昆虫体内存在着超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和过氧化物酶(POD)等保护酶系统,在昆虫各种生理作用或生化反应过程中起着清除氧自由基、保护昆虫机体免受损伤的重要作用[17]。本研究中分月扇舟蛾幼虫取食不同质量浓度Bt处理的杨树叶片后,体内保护酶活性的增加,可以认为是一种保护性的反应,保护酶活性的增加意味着清除自由基的能力加强,即表现出一定的抗逆性能力。分月扇舟蛾幼虫取食不同质量浓度Bt后体内保护酶活性受到诱导增加和国内很多研究结果类似。郭建英等[10]研究甜菜夜蛾幼虫取食Bt棉后,体内总超氧化物酶活力显著高于取食常规棉相同时间的个体。申继忠等[18]报道大蜡螟(Galleria mellonella)幼虫取食苏云金杆菌后SOD的活性显著升高;Ding Shuangyang等[8]研究了转Bt基因欧洲黑杨(Populus nigra)和转CpTI基因毛白杨(P.tomentosa×P.bolleana)×P.tomentosa对美国白蛾(Hyphantria cunea)幼虫中肠保护酶(SOD、CAT和POD)活性的影响,结果表明害虫取食转基因杨树后,中肠SOD、CAT和POD在饲喂数小时内均逐渐增加,在某一时刻达到最高值后突然下降。郭同斌等[9]研究了转基因杨树对杨小舟蛾体内3种保护酶活力的影响,结果显示幼虫中肠SOD活力显著升高,而CAT和POD活力受到了显著抑制。
分月扇舟蛾幼虫体内保护酶活性增加是一种保护性的反应,但3种酶活在不同的剂量水平体现出的活性变化并不一致。9 ng·L-1的Bt处理后,分月扇舟蛾幼虫体内SOD活性无明显变化趋势,而CAT和POD活性呈显著上升趋势,可能是分月扇舟蛾幼虫体内SOD对低质量浓度Bt的胁迫不敏感,而CAT和POD较为敏感。CAT和POD活性的增大可以加速清除体内积累过多的自由基以减少对分月扇舟蛾的伤害。17 ng·L-1的Bt处理后,分月扇舟蛾幼虫体内在短时间内积累大量的超氧阴离子自由基(O-2),诱导SOD活性在12~48h明显升高,将过多的超氧阴离子自由基(O-2)转化成H2O2,进而诱导了CAT和POD的活性增大来清除体内过多的H2O2,而在72 h时,SOD的活性受到抑制,这可能是由于H2O2在体内的大量积累,导致H2O2与O-2·形成毒性更强的氢氧自由基(HO·),破坏了细胞功能与结构,使分月扇舟蛾中毒。
药剂处理对昆虫活性氧代谢系统造成的影响是很复杂的,采用不同剂量可能会得到不同的结果。在正常状况下分月扇舟蛾体内SOD、CAT和POD协调一致、处于动态平衡状态,使得自由基处于一个低水平。当分月扇舟蛾受到低质量浓度的Bt胁迫时,SOD活性变化不显著,可能此阶段尚未产生过多的活性氧来激活SOD,而CAT和POD活性的增大可以清除体内积累的自由基,以减少对分月扇舟蛾的伤害,这说明低质量浓度Bt处理时,分月扇舟蛾体内3种保护酶处于一种动态平衡状态,使自由基维持在一个低水平[6];高质量浓度Bt的胁迫,SOD活性显著升高但在48 h达到最大值后下降,说明高质量浓度的Bt处理在短时间内激活了SOD活性,将过多的超氧阴离子自由基(O-2)转化成H2O2,而CAT活性增加趋势不明显,POD也只在48、72 h时有显著升高,不能及时清除大量的H2O2,而导致过高浓度的H2O2在48 h达到最大值后开始抑制SOD的活性,说明高质量浓度Bt处理使得分月扇舟蛾体内3种保护酶表现出不同的增降趋势,破坏了3种酶的平衡关系,导致细胞内自由基水平过高对虫体产生了不可恢复的毒害作用[7]。
[1]苏元吉,高玉梅.分月扇舟蛾发生特点及防治探析[J].林业科技情报,2009,41(3):8-9.
[2]王福维,牛延章,侯丽伟,等.分月扇舟蛾生物学特性及其防治研究[J].林业科学研究,1998,11(3):325-329.
[3]谭声江,陈晓峰,李典谟.昆虫对Bt毒素的抗性机理研究进展[J].昆虫知识,2001,38(1):12-17.
[4]徐艳聆,王振营,何康来,等.转Bt基因抗虫玉米对亚洲玉米螟幼虫几种主要酶系活性的影响[J].昆虫学报,2006,49(4):562-567.
[5]张巍,张志罡,付秀芹,等.转Bt基因水稻对稻纵卷叶螟幼虫体内三种保护酶活性的影响[J].昆虫学报,2008,51(10):1022-1027.
[6]李周直,沈惠娟,蒋巧根,等.几种昆虫体内保护酶系统活力的研究[J].昆虫学报,1994,37(4):399-403.
[7]张慧,王晓容,匡石滋,等.斜纹夜蛾核型多角体病毒与两种亚致死剂量的农药混用对斜纹夜蛾体内三种抗氧化酶活性的影响[J].昆虫学报,2006,49(5):775-779.
[8]Ding Shuangyang,Li Huaiye,Li Xuefeng,et al.Effects of two kinds of transgenic poplar on protective enzymes system in the midgut of larvae of American white moth[J].Journal of Forestry Research,2001,12(2):119-122.
[9]郭同斌,嵇保中,蒋继宏,等.转基因杨树对杨小舟蛾体内三种保护酶活力的影响[J].昆虫学报,2006,49(3):381-386.
[10]郭建英,吴刚,万方浩.甜菜夜蛾体内代谢耐受性对转Bt基因棉响应的时间动态[J].中国科学C辑:生命科学,2009,39(10):940-947.
[11]Beauchamp C,Fridovich I.Superoxide dismutase:improved assays and an assay applicable to acrylamide gels[J].Analytical Biochemistry,1971,44(1):276-287.
[12]Simon L M,Fatrai Z,Jonas D E,et al.Study of peroxide metabolism enzymes during the development of phaseolus vulgris[J].Biochemistry Physiology,1974,166:387-392.
[13]Bradford M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Anal Biochem,1976,72(1/2):248-254.
[14]蒋志胜,尚稚珍,万树青,等.光活化杀虫剂α-三噻吩的电子自旋共振分析及其对库蚊保护酶系统活性的影响[J].昆虫学报,2003,46(1):22-26.
[15]Wang Ying,Oberley L W,Murhammer D W.Evidence of oxidative stress following the viral infection of two Lepidopteran insect cell lines[J].Free Radical Biology and Medicine,2001,31(11):1448-1455.
[16]Lozinskaya Y L,Slepneva I A,KhramtsovV V,et al.Changes of the antioxidant status and system of generation of free radicals in hemolymph of Galleria mellonella larvae at microsporidiosis[J].Journal of Evolutionary Biochemistry and Physiology,2004,40(2):119-125.
[17]王满囷,李周直.滞育期间鞭角华扁叶蜂保护酶系统活力[J].林业科学,2002.38(4):100-104.
[18]申继忠,钱传范.亚致死剂量苏云金杆菌蜡螟亚种对大蜡螟幼虫SOD和POX活性的影响[J].生物防治通报,1994,10(3):118-122.

