电针治疗抑郁模型大鼠快速起效海马区BDNF-TrkB机制研究*
卢金花,姜劲峰,王玲玲,陈丽智
(南京中医药大学,江苏南京 210029)
抑郁症的发生与神经元再生障碍密切相关[1],脑源性神经营养因子(brain-derived neuro-trophic factor,BDNF)及其酪氨酸激酶受体 B(TrkB)因其在神经元功能和可塑性调节中的重要作用,被认为是抗抑郁治疗的重要靶点之一。临床研究[2]表明:针灸抗抑郁具有快速起效的优势。为探讨电针治疗快速起效是否是通过对海马神经元保护和发生机制的影响而产生作用,笔者观察了治疗早期电针对慢性应激抑郁症大鼠海马神经元 BDNF、Trk B表达的影响,并与氟西汀进行对照。现报道如下。
1 材料与方法
1.1 动物及分组 Sprague-Dawley大鼠,雌性,体重180~220 g,南京中医药大学实验动物中心提供,首先用 Open-Field法作行为学评分,选择得分相近的 32只大鼠进行实验分组,随机分为正常组(8只)与造模组 (24只)。
1.2 模型制备 参考文献[3]复制抑郁症大鼠模型。正常组以群养方法饲养(8只)。模型组以孤养方法饲养(24只),并接受 21天各种不同的应激,包括冰水游泳 (4℃,5 min)、热水游泳(45℃,5 min)、禁水(24 h)、夹尾(1 min)、电击足底(电压 50 mV,每隔 15 s刺激 1次 ,每次持续 10 s,共 15次 )、摇晃 (1次 /s,5 min)、禁食(24 h)和昼夜颠倒,平均每种刺激各 3次。造模过程完成后,以 25%比例将造模组中行为学得分高的大鼠淘汰。余下 18只随机分组为模型组、电针组、药物组,每组各 6只。
1.3 治疗方法
1.3.1 药物治疗 实验第 22天起,药物组按照 1.8 mg/kg给予氟西汀(常州四药制药有限公司生产,批号KC8247。),将药物溶解于生理盐水中灌胃。每日治疗1次 ,连续 7天 。
1.3.2 针刺方法 实验第 22天起,电针组根据《实验针灸学》[4]大鼠穴位定位方法,选择百会穴,并参照人和动物的穴位解剖结构特点,以华兴邦研制的大鼠针灸穴位图谱为基础,在大鼠前正中线上,额顶骨缝交界线前方处定位印堂穴。选用苏州医疗用品厂生产的“华佗”牌 30号 0.5寸针灸针进行治疗。百会穴向前斜刺,印堂穴向上斜刺,进针深度约为 2 mm,接 Hans电针仪,连续波型,频率 2 Hz,留针 10 min。每日治疗1次 ,连续 7天 。
1.4 免疫组化测定 BDNF、TrkB表达
1.4.1 灌注固定 第 28天将所有大鼠以 10%水合氯醛行腹腔注射麻醉(4 mL/kg)开胸,常规经心脏左心室、升主动脉先灌注无菌生理盐水 200 mL,继灌 4%多聚甲醛 150~200 mL。取脑,4%多聚甲醛后固定2周。
1.4.2 免疫组化 石蜡包埋,连续切片(片厚6μm),行免疫组化染色(采用非生物素二步法,试剂由北京中杉提供)。①石蜡切片脱蜡,水化;②柠檬酸钠高压修复抗原;③切片入溶液(3%H2O2),室温下孵育10 min;④一抗兔抗鼠(IgG)滴加于标本上,工作浓度BDNF(1∶200),TrkB(1∶200),在湿盒内 (37℃)孵育1~2 h;⑤滴加二抗 PV-6001(羊抗兔 IgG抗体 -HRP多聚体),室温孵育 30 min;⑥DAB显色液常温显色 5~10 min;⑦苏木素复染;⑧用梯度酒精脱水,二甲苯透明,中性树胶封片;⑨上述各步均用 0.01 MPBS冲洗(2 min×3次)。
1.5 数据处理 各组选取 3张海马矢状切面切片,每张取 CA1、CA3、DG区的 3个视野,置 400倍显微镜下观察,用 CMIAS98A真彩色病理图像分析仪统计,数据分析用 SPSS12.0统计软件处理。以均数 ±标准差(±s)表示。单因素方差分析(one way-ANOVA),组间差异性比较用 t检验。
2 结果
结果见表 1~2。
表1 各组大鼠海马 CA 1、CA 3、DG区表达 BDNF神经元平均灰度值与目标总面积 (±s,n=6)
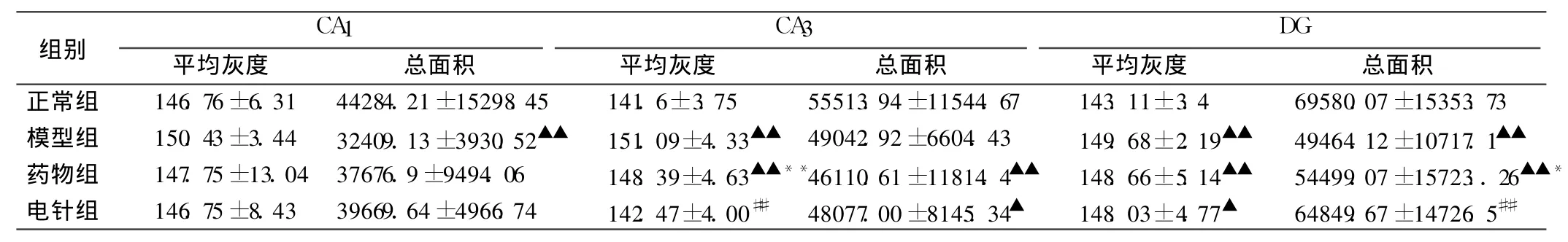
表1 各组大鼠海马 CA 1、CA 3、DG区表达 BDNF神经元平均灰度值与目标总面积 (±s,n=6)
注:与正常组比较,▲P<0.05,▲▲P<0.01;与模型组比较,#P<0.05,##P<0.01;与电针组比较,*P<0.05,**P<0.01。
?
表2 各组大鼠海马 CA1、CA3、DG区表达 TrkB神经元平均灰度值与目标总面积 (±s,n=6)

表2 各组大鼠海马 CA1、CA3、DG区表达 TrkB神经元平均灰度值与目标总面积 (±s,n=6)
注:与正常组比较,▲P<0.05,▲▲P<0.01;与模型组比较,#P<0.05,##P<0.01;与电针组比较,*P<0.05,**P<0.01。
CA1 CA3组别DG平均灰度 总面积 平均灰度 总面积 平均灰度 总面积正常组 132.87±24.16 771.42±359.48 132.29±13.15 890.49±500.45 137.87±20.77 643.87±522.72模型组 175.46±7.26▲▲ 421.8±331.08▲▲ 182.8±6.53▲▲ 413.46±156.84▲▲ 177.76±5.41▲▲ 307.87±148.05▲▲药物组 185.67±9.48▲▲#**467.78±341.39▲▲ 186.32±8.36▲▲**529.89±510.33▲▲ 178.73±6.16▲▲** 395.25±271.57▲▲*电针组 152.05±16.87▲▲##580.34±363.42▲▲##149.82±20.55▲▲##674.15±498.69▲▲##141.97±19.01## 503.37±298.66▲#
抑郁症模型大鼠存在海马区 BDNF、TrkB表达下降,表现为阳性神经元平均灰度值上升、目标总面积下降。
从表 1可见,治疗第 7天,对 BDNF阳性神经元表达的影响:①平均灰度值:与模型组相比较,电针组海马 CA3区平均灰度值下降,与正常组相比差异无显著性(P>0.05);与药物组比较,电针组下降显著(P<0.01)。②目标总面积:与模型组相比较,在海马 DG区电针组阳性神经元总面积明显升高,与正常组无差异(P>0.05);与药物组比较,电针组升高明显(P<0.05)。
从表 2可见,治疗第 7天,对 TrkB阳性神经元表达的影响:①平均灰度值:与模型组相比较,海马 CA1、CA3、DG区电针组平均灰度值均明显下降,其中在 DG区与正常组无差异(P>0.05);与药物组比较,以上各区电针组下降均显著(P<0.01)。②目标总面积:与模型组相比较,在海马 CA1、CA3、DG各区电针组阳性神经元总面积均明显升高;与药物组比较,以上各区电针组升高均明显(P<0.05)。
3 讨论
3.1 慢性应激抑郁症时海马 BDNF/TrkB表达下调
3.1.1 海马在抑郁症发病的作用与地位 海马是与学习记忆行为和情绪密切相关的脑区,主要由海马回和齿状回(DG)组成,前者包括 CA1、CA2、CA3、CA4等部分,主要由锥体细胞组成,后者基本上由颗粒细胞组成,能够终生产生新的神经元。长期慢性应激能持续激活 HPA轴,导致糖皮质激素(GCs)水平升高。海马是调节 HPA轴的高位中枢,由于富含糖皮质激素(GCs)受体 GR,是 GCs作用的主要靶器官,应激时极易受到高浓度的 GCs选择性攻击,导致海马突触可塑性降低,神经元萎缩、丢失,并进一步影响到学习记忆等高级功能。因此,可推测海马神经元结构和功能的损伤可能是抑郁症发病的主要原因[4]。
3.1.2 抑郁症海马 BDNF/TrkB表达下调 BDNF是神经营养素家族的重要一员,在脑内广泛分布,尤以海马和皮层含量最高,与受体 Trk B结合介导其生物学效应,对发育过程中神经元的存活、分化以及成年神经元的存活和功能发挥重要作用。大量研究表明,BDNF表达下调可能参与慢性应激抑郁症时海马结构和功能的改变。心理以及物理应激能下降海马 BDNFmRNA,提示与应激相关的抑郁症与海马 BDNF有密切联系[5]。本实验结果显示抑郁症模型大鼠存在海马区BDNF、Trk B表达下降,与以往研究结果相互支持,如李丽萍、陶文剑等[6,7]报道的慢性应激可致抑郁症大鼠海马神经元明显受损,BDNF阳性神经元数量显著减少。
3.2 电针治疗迅速上调海马 BDNF/TrkB表达 本研究显示,在治疗早期(治疗第 7天)电针组有效地增加模型大鼠海马 BDNF、TrkB表达,而氟西汀治疗早期增加不明显,表明电针治疗增加 BDNF、TrkB表达较氟西汀迅速,这与本课题组前期在临床发现结果一致[2];这也提示了针灸治疗与药物明显不同的效应特征:电针治疗抗抑郁效应起效早,电针治疗迅速增加与 BDNF、TrkB表达有关。
3.3 电针抗抑郁快速起效的可能机制
3.3.1 调节 cAMP-CREB通路 抑郁症与 cAMPCREB(cAMP反应性元件结合蛋白)通路功能及其介导的 BDNF表达低下密切相关。最新的研究[5]显示抑郁症可能存在着某些信号转导通路功能异常,抗抑郁治疗可以通过激活细胞内的信号传导通路(即第一、二信使的传递过程),将信号由胞膜传至细胞核内,经级联反应集中到 CREB的磷酸化,磷酸化后的 CREB激活相关基因的转录,调节 BDNF等蛋白质的表达,达到抗抑郁的作用。电针治疗上调 cAMP-CREB通路发挥抗抑郁效应,有关研究本课题组将另文报道。
3.3.2 保护神经元,促进神经元存活与再生 应激和抑郁症与海马体积的减少、细胞重建及神经可塑性密切相关,BDNF及其受体 Trk B在神经可塑性和生存中起关键性的调节作用。
抑郁症的病因与海马区域神经细胞的萎缩和坏死有关。Duman(1997)等认为尤其是与应激有关的抑郁症可能是海马 CA3锥体神经细胞萎缩或坏死所致,并且部分与某些神经元获取 BDNF能力下降有关[8]。本研究结果初步发现电针治疗第 7天,大鼠海马神经元的 BDNF及受体 TrkB表达增加,平均灰度值明显低于药物组,尤以 CA3区为甚,与上述报道结果一致,提示增加 BDNF/TrkB表达、提高海马锥体神经细胞的生存可能是电针抗抑郁作用的机制之一。
神经可塑性和细胞生存紧密相连。新的理论[9]认为,成年哺乳动物(包括人)海马等脑区神经元是可以由其先祖细胞分裂进行再生的。海马神经元祖细胞位于齿状回颗粒细胞层下区,可分裂、分化为新神经元。本研究结果初步发现在 DG区颗粒细胞层,电针组大鼠海马神经元的 BDNF及受体 TrkB阳性表达面积明显高于药物组,即电针后此区神经元再生能力强于药物组,提示促进海马神经元再生是介导电针抗抑郁作用的关键环节之一。
综上所述,慢性应激可以导致海马 BDNF/TrkB表达下调,电针治疗能迅速上调海马 BDNF/TrkB表达,其快速起效可能通过上调 BDNF/TrkB表达从而促进神经元存活与再生而实现。但是,针灸作用是多靶点多途径的,其快速起效机制必然也存在其他途径。目前,针灸抗抑郁快速起效的机制尚待进一步研究证实,但在治疗早期,针灸的介入对于减轻病人症状和功能损害、降低病人自杀的危险性以及减轻社会经济负担都具有重要意义。因此,相信针灸治疗本病必定有广阔的应用前景。
[1] Zhang LM,Li YF,Gong ZH.Neurogenesis:a novel strategy for the treatment of depression[J].Sheng Li Ke Xue Jin Zhan,2005,36(2):109-112
[2] 姜劲峰,刘兰英,王俊,等.针药并用对抑郁症患者 HAMD量表因子的影响[J].上海针灸杂志,2007,26(6):3-5
[3] Katz RJ,Roth KA,Carroll BJ.Acute and chronic stress effects on open field activity in the rat implications for a model of depression[J].Neuroscience Biobehaviorl Reviews,1981,5:247-251
[4] 邹艳萍,季颖,王德山.抑郁症海马神经元损伤的机制[J].锦州医学院报,2005,26(6):57-58
[5] 彭桂军.脑源性神经营养因子与抑郁症的研究进展[J].国外医学◦精神病学分册,2004,31(3):152-154
[6] 李丽萍,毕颖.针灸对慢性应激抑郁模型大鼠脑源性神经营养因子的影响[J].中华中医药学刊,2008,26(10):2287-2290
[7] 陶文剑,文绍敦,王玲玲.电针结合药物治疗对慢性应激抑郁模型大鼠海马CA1、CA3区BDNF的影响[J].青海医学院学报,2007,28(2):100-102
[8] Duman RS,Heninger GR,Nestler EJ.A molecular and cellular theory of depression[J].Arch Gen Psychiatry,1997,54:597-606
[9] 李云峰,罗质璞.抑郁症:神经元损伤与神经元再生障碍[J].药学学报,2004,39(11):949-953
