人脐血MSCs向神经元样细胞分化过程中neurogenin 1的表达变化*
朱登纳, 贾延劼, 王 军, 张博爱, 范亚珍
(郑州大学1第三附属医院河南省小儿脑瘫康复治疗中心,2第一附属医院神经内科,河南郑州450052)
近年来,干细胞移植可替代损伤的神经细胞,促进细胞结构功能重建,是治疗神经系统病变新的理念和途径[1]。间质干细胞(mesenchymal stem cells,MSCs)具有多向分化、高度增殖及自我更新能力,被认为是细胞治疗中最具发展潜力的细胞来源之一,具有很大的应用价值[2],在一定条件下可增殖分化为神经元、星形胶质细胞和少突胶质细胞等[3,4]。神经元素1(neurogenin 1)属于一种早表达的碱性螺旋-环-螺旋(basic helix-loop-helix,bHLH)蛋白,可以在神经前体细胞中表达,是控制神经前体细胞发育成神经细胞的重要转录因子之一[5]。但是,neurogenin 1是否在其它类型的干/前体细胞向神经细胞分化过程中也存在类似的作用呢?相关研究不多。本研究采用表皮生长因子(epidermal growth factor,EGF)和碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)联合诱导人脐血MSCs向神经元样细胞分化,观察neurogenin 1的表达变化,并初步探讨其机制。
材料和方法
1 材料
1.1 主要试剂 Neurobasal液体培养基、B27和胎牛血清购自Gibco;淋巴细胞分离液(天津灏洋公司);hEGF、bFGF购自PeproTech Ec;小鼠抗人neurogenin 1(sc-100332)、神经微丝亚蛋白M(neurofilament protein M,NF-M,sc-20013)、神经元特异性烯醇化酶(neuron-specific enolase,NSE,sc-51880)和胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP,sc-58766)单克隆抗体购自Santa Cruz;CY3标记山羊抗小鼠IgG(H+L)购自上海碧云天公司;RNeasy Mini试剂盒和OneStep RT-PCR试剂盒均为Qiagen公司产品;引物由上海生工生物公司合成。
2 方法
2.1 脐血采集和MSCs分离 人脐血标本2007年10月-2009年12月取自郑州大学第三附属医院,经郑州大学伦理委员会批准,书面获产妇同意,足月妊娠,剖腹产,排除传染性疾病及各种家族遗传疾病。无菌状态下从新生儿胎盘收集脐血70 mL 30份于含14 mL CPD-A抗凝剂的100 mL采血袋内,混匀后分装于离心管中,3 000 r/min离心10 min,弃上层血浆,加入等量生理盐水混匀,缓慢加入到含Ficoll-Hypaque淋巴细胞分离液的离心管中,2 500 r/min离心15 min,细胞分为4层,取中间富含单个核细胞的白膜层,Hanks液洗涤离心2次,弃上清,加入1 mL红细胞裂解液作用30 s,Hank's液洗涤离心1次,弃上清,制成单个核细胞悬液。
2.2 体外诱导人脐血MSCs分化为神经元样细胞 参照文献[6]的方法,调整细胞密度为1×109cells/L,接种于含EGF (10 μg/L)、bFGF(10 μg/L)和B27(2%)的neurobasal培养基的塑料培养瓶内,培养24 h后倾去全部液体以去除未贴壁细胞,以后每3 d全量换液1次,分别收集培养0 d、1 d、4 d、7 d、14 d的贴壁细胞。
2.3 免疫细胞化学法 取各时点的细胞,4%多聚甲醛溶液固定20 min,PBS洗涤后加入3%H2O2去离子水孵育5 min,消除内源性过氧化物酶活性。山羊血清孵育30 min,封闭非特异性结合位点,分别加入neurogenin 1抗体(2.0 mg/L)、NF -M抗体(1.0 mg/L)、NSE抗体(1.0 mg/L)、GFAP抗体(1.0 mg/L)4℃孵育,PBS洗涤后用CY3标记山羊抗兔IgG (1∶500)在室温下进行染色标记、观察。镜下观察细胞形态及阳性细胞表达情况。细胞图像通过显微镜用100倍或200倍摄取,图像均采用300 dpi分辨率。每组独立的实验都会采集超过20个区域的细胞。而且,采用双人双盲随机记数阳性细胞,计算阳性细胞百分比例。
2.4 Western blotting法 收集培养0 d、7 d、14 d的细胞,在细胞裂解液(50 mmol/L Tris-HCl,pH 6.8,10 mmol/L EDTA,2%SDS,5 mmol/L DTT,0.5 mmol/L PMSF)100 μL中裂解、变性、离心,收集上清蛋白质样本,蛋白质定量。取50 μg蛋白在12%的SDS-PAGE胶中电泳,并转移至硝酸纤维素膜。取出膜后用正常山羊血清室温下封闭3.5 h,然后置于杂交袋中,加入小鼠抗人neurogenin 1(1∶500),4℃孵育过夜,羊抗小鼠-AP(1∶1 000),37℃孵育60-120 min,NBT/BCIP显色,照相记录结果。
2.5 RT-PCR Neurogenin 1引物参考Megiorni等[7],上游引物5'-CCGACGACACCAAGCTCA-3',下游引物5'-GAATGAAACAGGGCGTT-3',产物334 bp;β-actin上游引物5'-TCATACTCCTGCTTGCTG-3',下游引物5'-GGACCTGACTGACTACCTC-3',产物540 bp;均由上海生工生物公司合成,终浓度为100 μmol/L。
采用RNeasy Mini试剂盒分离纯化各组细胞的总RNA,分光光度法测定计算提取的总RNA含量及浓度。参照QIAGEN® OneStep RT-PCR试剂盒实验操作说明进行RTPCR,总反应体积50.0 μL。扩增条件为:50℃逆转录30 min,95℃初始化15 min,94℃变性1 min,55℃退火1 min,72℃延伸1 min,30-35个循环,72℃最后延伸10 min。然后,取RT-PCR产物5.0 μL,加样至含溴化乙啶的1.5%琼脂糖凝胶上,70 V电泳25 min,紫外透视仪下观察结果并用凝胶扫描成像系统照相,PCR定量分析软件分析各样本的PCR吸光度,除以各内对照β-actin的PCR吸光度值作为各目的mRNA的表达量。
3 统计学处理
全部数据用SPSS 12.0统计软件包处理,实验数据以均数±标准差(±s)表示,各组数据差异显著性检验采用方差分析和卡方检验,检验水准α=0.05,P<0.05为差异有统计学意义。
结果
1 人脐血MSCs体外分离和诱导分化
刚分离的MSCs呈体积均一的小圆形,折光性强,悬浮状态,少量聚集成细胞簇;诱导1 d后,细胞开始增殖分化,出现贴壁生长,胞体变大,边缘有细的突起,形状变得不规则。部分细胞呈破骨样,胞体较大,多个核,类圆形(图1A);4 d后可见球形细胞克隆团,细胞清亮,折光性好。梭形细胞增多,胞突进一步伸长,细胞呈梭形、三角形、不规则锥形,甚至多个突起。破骨样细胞减少,细胞视野逐渐清亮;7 d时贴壁细胞突起逐渐延长,分支逐渐增多,球形细胞克隆团体积变大,贴壁生长,随后单个细胞呈放射状从细胞球周围迁出来,细胞逐渐纯化;14 d后相邻细胞突起逐渐连成网状,类似神经元样细胞。中间散在大的克隆球,周围放射状伸出许多细长突起并进一步延长(图1B)。
2 诱导前后NF-M、NSE和GFAP蛋白表达
诱导前人脐血MSCs NF-M、NSE和GFAP的表达均非常低(<1.0%)诱导4d,NF-M和NSE阳性细胞数较诱导1 d显著增多(P<0.01),GFAP阳性细胞数也同样增多(P<0.01)。诱导7 d后NSE阳性细胞率达高峰;诱导14 d,NSE阳性细胞率略有下降,但是无统计学差异(P>0.05)。NF-M和GFAP阳性细胞数则继续增多,所占比例不断增高,见表1。
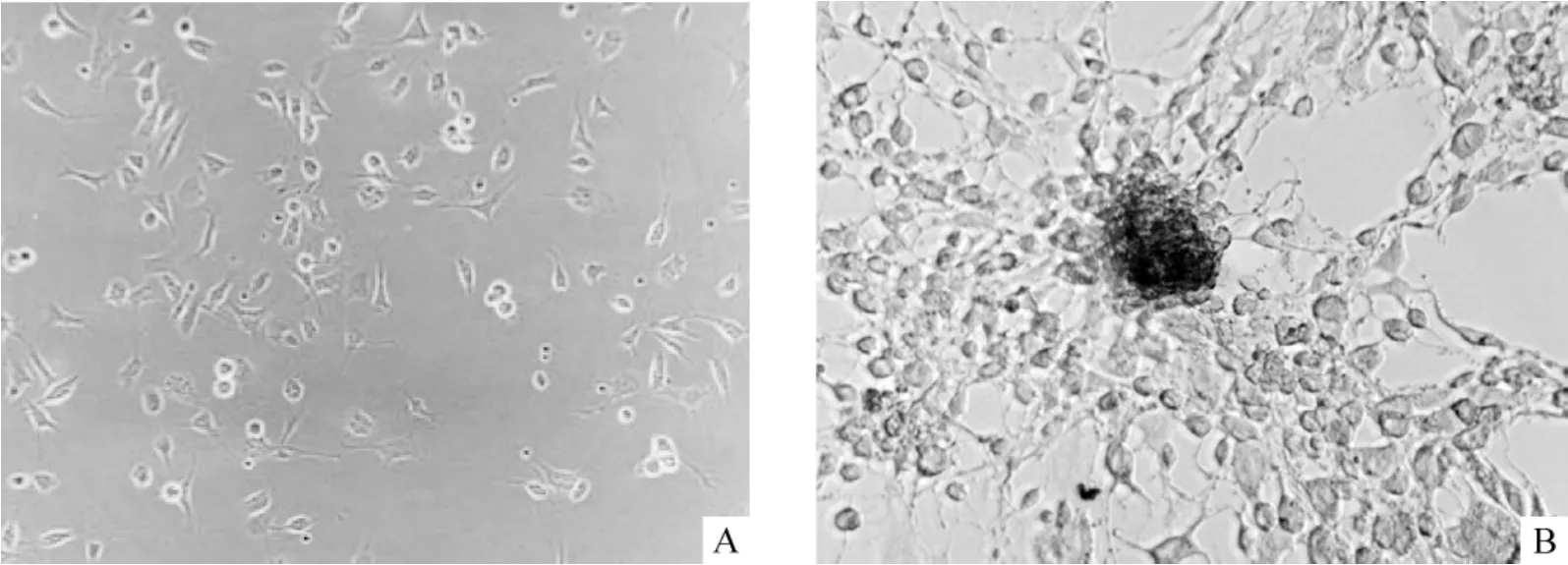
Figure 1.Morphological changes of MSCs after induction(×200).A:after 1-day induction,the cells began to proliferate and differentiate,and adherent growth,large soma,thin processes and irregular shape were observed.Some were osteoclast-like cells,with comparatively large soma,round-like shape and multiple nuclei.B:after 14-day induction,it was observed that large cell colonies scattered in the network connected by cell processes,similar to the neuron-like cells.图1 诱导后MSCs的形态变化
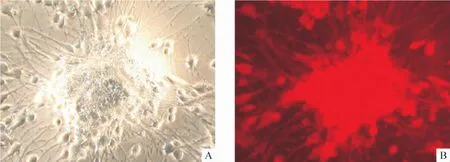
Figure 2.The expression of neurogenin 1 reached to its peak after 14-day induction(×200).A:under light microscope;B:the same field under fluorescence microscope(×200).图2 诱导14后neurogenin 1的表达
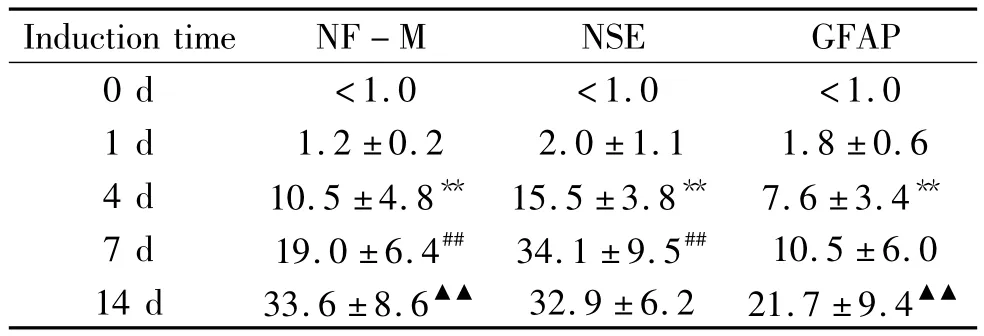
表1 诱导不同时点后MSCs免疫细胞化学染色结果Table 1 .Results of immunocytochemical staining in MSCs at different time points after induction(%.n=20)
3 Neurogenin 1的表达变化
免疫细胞化学结果提示,诱导前(0 d)人脐血MSCs不表达neurogenin 1;诱导1 d,MSCs开始少量表达 neurogenin 1 (1.7% ±0.5%);诱导4 d,部分 MSCs表达 neurogenin 1 (16.8%±4.6%);而且随时间延长表达持续增加,峰值出现在诱导14 d(42.5% ±6.0%),与诱导4 d、7 d(30.8% ± 9.4%)相比,有显著差异(P<0.01),见图2。Western blotting法也有类似的结果,见图3。
RT-PCR结果提示,neurogenin 1 mRNA在诱导前的MSCs中不表达,诱导后表达逐渐升高,随着诱导时间延长,neurogenin 1 mRNA表达明显增强,见图4。
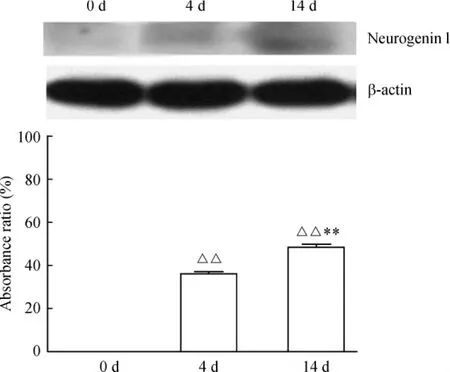
Figure 3.Neurogenin 1 expression detected by Western blotting. The human umbilical cord blood MSCs did not express neurogenin 1 before induction(0 d);After inducted 1 day,MSCs began to express a small amount of neurogenin 1;and the expression continued to increase after induced 4 days,14 days with time prolonged.±s.n= 10.△△P<0.01 vs 0 d group;**P<0.01 vs 4 d group.图3 Western blotting检测neurogenin 1蛋白表达
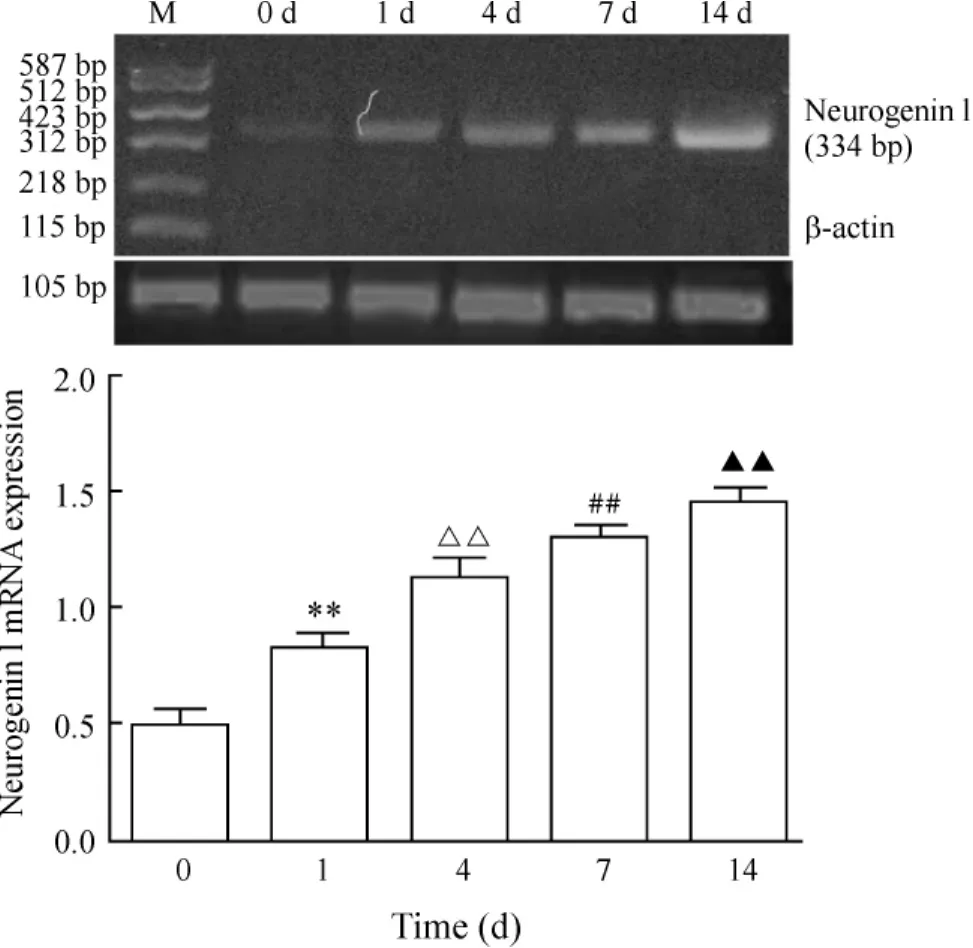
Figure 4.The expresssion of neurogenin 1 mRNA in MSCs detected by RT-PCR was low before induction,gradually increased after induction,and significantly increased with the induction prolonged.±s.n=10.**P<0.01 vs 0 d group;△△P<0.01 vs 1 d group; ##P<0.01 vs 4 d group;▲▲P<0.01 vs 7 d group.图4 RT-PCR检测neurogenin 1 mRNA表达结果
讨论
研究发现,脐血和骨髓都含有间质干细胞,且人脐血间充质干细胞更原始,增殖分化能力更强。因此,为细胞治疗的来源提供了一个的选择[8]。本研究建立了用含EGF、bFGF和B27的神经细胞Neurobasal培养基,体外诱导人脐血MSCs分化为神经元样细胞的方法。bFGF在胚胎发育早期对能分化成神经元和胶质细胞的神经干细胞具有促增殖作用,并能保持神经干细胞的未分化状态[9,10]。而EGF仅在胚胎发育晚期对胶质前体细胞的增殖具有促进作用。将二者联合用于神经干细胞的培养,不仅可以促进细胞的存活和增殖,也可以选择性地促进神经干细胞向神经元方向分化[11]。B27具有维持神经细胞活性的作用。结果提示诱导4d,NF-M、NSE阳性细胞数开始显著增多,GFAP阳性细胞数也同样增多。诱导14d,NF-M、GFAP阳性细胞数继续增多,所占比例不断增高。推测在体外微环境中EGF、bFGF、B27与细胞基质、细胞分泌因子一起通过复杂的受体相互作用,影响人脐血MSCs增殖分化的基因转录,调节人脐血MSCs向神经细胞方向分化。
Neurogenin 1是一类在神经细胞前体中表达、控制神经细胞前体发育成神经细胞的转录因子,属于早表达的bHLH蛋白中的一种。根据bHLH转录调控因子在神经分化过程中作用的先后,可将其分为决定因子和分化因子。决定因子参与了决定NSCs向神经元谱系分化的调节过程,比分化因子较早作用于神经细胞分化过程;分化因子作用于神经前体细胞向多种不同类型神经元分化的调节过程,使之产生各种完全分化的神经元[12]。采用维甲酸处理 P19细胞可以诱导neurogenin 1与另外一种bHLH蛋白NeuroD在P19细胞神经分化早期阶段表达,在缺乏维甲酸的情况下,neurogenin 1也可以诱导P19细胞的神经分化[13]。而且,neurogenin 1在控制神经元发育和胶质细胞发生中有双重作用:一方面neurogenin 1作为转录因子诱导NeuroD的表达,而NeuroD对神经发育有重要作用;另一方面,neurogenin 1通过阻断复合物p300/CBP与GFAP启动子之间的作用,抑制胶质细胞的发生[14,15]。本研究表明,诱导前人脐血MSCs不表达neurogenin 1。在EGF和bFGF联合诱导下,neurogenin 1表达逐渐增强,诱导14 d达到峰值。与此同时,NF-M和GFAP阳性细胞数也逐渐增多,提示人脐血MSCs在向神经细胞分化的过程中,随着神经分化的进行,neurogenin 1表达平行升高,可能在人脐血MSCs神经细胞分化中起到一定的作用。
研究发现,采用表达neurogenin 1的骨髓MSCs移植到脑缺血动物脑组织,可以促进MSCs横向分化为神经细胞,修复受损组织,重建细胞功能,改善神经功能缺损症状[16]。因此,进一步研究neurogenin 1在人脐血MSCs神经细胞分化中的机制,调控其表达,为今后人脐血MSCs治疗中枢神经系统退行性及损伤性疾病提供一定的基础。
[1] Low CB,Liou YC,Tang BL.Neural differentiation and potential use of stem cells from the human umbilical cord for central nervous system transplantation therapy[J].J Neurosci Res,2008,86(8):1670-1679.
[2] 唐晓琼,赵智刚,王红祥,等.人脐静脉来源的间质干细胞体外分离扩增及多向分化的研究[J].中国病理生理杂志,2006,22(10):1960-1964.
[3] Domanska JK,Buzanska L,Lukomska B.A novel,neural potential of non-hematopoietic human umbilical cord blood stem cells[J].Int J Dev Biol,2008,52(2-3): 237-248.
[4] 刘建坤,孙志明,闫嶂松,等.脐血干细胞移植对大鼠脊髓损伤后神经再生和后肢运动功能的影响[J].中国现代医学杂志,2009,19(16):2433-2437.
[5] Blader P,Lam CS,Rastegar S,et al.Conserved and acquired features of neurogenin1 regulation[J].Development,2004,131(22):5627-5637.
[6] Yan WH,Cao MD,Liu JR,et al.Effects of EGF and bFGF on expression of microtubule-associated protein tau and MAP-2 mRNA in human umbilical cord mononuclear cells[J].Cell Biol Int,2005,29(2):153-157.
[7] Megiorni F,Mora B,Indovina P,et al.Expression of neuronal markers during NTera2/cloneD1 differentiation by cell aggregation method[J].Neurosci Lett,2005,373 (2):105–109.
[8] Jäger M,Zilkens C,Bittersohl B,et al.Cord blood-an alternative source for bone regeneration[J].Stem Cell Rev,2009,5(3):266-277.
[9] Tamama K,Fan VH,Griffith LG.Epidermal growth factor as a candidate for ex vivo expansion of bone marrow-derived mesenchymal stem cells[J].Stem Cells,2006,24 (3):686-695.
[10] Rider DA,Dombrowski C,Sawyer AA.Autocrine fibroblast growth factor 2 increases the multipotentiality of human adipose-derived mesenchymal stem cells[J].Stem Cells,2008,26(6):1598-1608.
[11] Hebert TL,Wu X,Yu G.Culture effects of epidermal growth factor(EGF)and basic fibroblast growth factor (bFGF)on cryopreserved human adipose-derived stromal/stem cell proliferation and adipogenesis[J].J Tissue Eng Regen Med,2009,3(7):553-561.
[12] 王若冰,杨 雪,金玫萍,等.神经干细胞分化调节机制与应用前景[J].中国病理生理杂志,2007,23(2): 403-407.
[13] Kim S,Yoon YS,Kim JW,et al.neurogenin 1 is sufficient to induce neuronal differentiation of embryonal carcinoma P19 cells in the absence of retinoic acid[J].Cell Mol Neurobiol,2004,24(3):343-356.
[14] Wu M,Zhang Y,Wu NH,et al.Histone marks and chromatin remodelers on the regulation of neurogenin 1 gene in RA induced neuronal differentiation of P19 cells[J].J Cell Biochem,2009,107(2):264-271.
[15] Sun Y,Nadal-Vicens M,Misono S,et al.Neurogenin promotes neurogenesis and inhibits glial differentiation by independent mechanisms[J].Cell,2001,104(3):365-376.
[16] Kim SS,Yoo SW,Park TS,et al.Neural induction with neurogenin 1 increases the therapeutic effects of mesenchymal stem cells in the ischemic brain[J].Stem Cells,2008,26(9):2217-2228.

