非共生固氮菌株BC2接种冰草的研究
郑红丽,樊明寿,庞保平
(内蒙古农业大学农学院,内蒙古 呼和浩特 010019)
早在1888年,Berthelot发现未消毒土壤会有氮素的赢余,而消毒土壤却没有,他推断是土壤中自由生长的微生物起了作用,而且这种作用可以弥补土壤的氮素损失[1]。之后100多年中,人类不仅认识了当年Berthelot描述的自生固氮的原理, 而且做了大量菌种分离和接种试验。1926年,Kostychev等[2]报道了接种固氮菌对烟草生长以及土壤氮素积累的正面效应后,俄罗斯对这个菌种进行了几十年的大量推广。但Mishustin[3]认为俄罗斯的田间试验只有1/3有效。其他类似研究结果也不完全一致,如在水稻(Oryzasativa)上接种固氮菌可以使单季稻固定20~100 kg/hm2氮素,而有的却无效果[4-7]。尽管目前国内不同研究小组在玉米(Zeamays)、水稻和小麦(Triticumaestivum)等不同作物上的接种试验都得到了正面效应[8-10],但非共生固氮菌接菌剂没有广泛推广的现实说明非共生固氮菌的接种应用还存在一些困难。究其原因,土著菌的竞争、碳源不足等环境因素是影响固氮菌固氮潜力发挥的重要因子。冰草(Aqropyromcristatum)是内蒙古天然草原及栽培草地的主要草种,本研究选择从内蒙古天然草原上冰草根际分离获得的固氮活性较高的菌株BC2进行室内接种试验,以观察其对冰草生长的氮素营养贡献及其受土著菌和碳源的影响,为进一步开发应用奠定基础。
1 材料与方法
1.1材料 菌株BC2于2006年从内蒙古锡林郭勒天然草原上冰草根际土壤分离获得,通过乙炔还原测定,其固定乙烯量为3.38×10-7μmol/cfu,适宜生长pH值7~9,可耐2%的盐浓度,在LB液体培养基培养18 h后进入生长对数期;经16S rDNA和Biolog鉴定,BC2 为少动鞘氨醇假单胞菌(Sphingomonassangulinis)[11]。
土壤取自内蒙古锡林郭勒天然草原,全氮含量0.42 g/kg,速效磷16.4 mg/kg,速效钾含量104 mg/kg,有机质含量1.5%,土壤pH值8.1,土壤为栗沙土,质地以中细沙为主,属于典型草原土壤[12]。
1.2方法
1.2.1土著菌对BC2接种效果的影响 将20粒冰草种子用0.15%的升汞溶液消毒后,用无菌水冲洗,然后种植于装有1.0 kg 土壤(干质量)的花盆内,共12盆,其中6盆土壤经170 ℃、4 h高温灭菌。待出苗15 d,取6盆植株(其中3盆土壤经过灭菌, 3盆未灭菌),将50 mL生长处于对数期的菌悬液(108~109cfu/mL)接种于冰草根际,另外6盆加入等量灭活的培养液作为对照,形成具有3次重复的处理组合。室内培养80 d,收获冰草,植株和土壤烘干后,测定植株含氮量和土壤的全氮量,然后计算整个体系的固氮量(ΔN1)。
ΔN1=(收获时接种植株总氮量-收获时未接种植株总氮量)+(收获时接种土壤总氮量-收获时未接种土壤总氮量)。
1.2.2碳源对BC2接种效果的影响 取6盆(3盆土壤灭菌,3盆未灭菌)土壤分别加入10 g蔗糖,另外6盆(3盆土壤灭菌,3盆未灭菌)不加蔗糖作为相应对照。植物栽培、管理方式同1.2.1。待出苗15 d,12盆植株中分别接入50 mL处于生长对数期的菌悬液(108~109cfu/mL),形成具有3次重复的处理组合。室内培养80 d,收获冰草,测定植株含氮量和土壤的全氮量,然后计算整个体系的氮素盈亏ΔN2[13]。
ΔN2=(收获时加蔗糖植株总氮量-收获时未加蔗糖植株总氮量)+(收获时加蔗糖土壤总氮量-收获时未加蔗糖土壤总氮量)。
1.2.3全氮含量 土壤全氮采用半微量凯氏定氮法[14],植株全氮采用H2SO4-H2O2消煮-奈氏比色法[13]。
1.3数据分析 统计分析采用SAS软件进行独立样本的t测验。
2 结果与分析
2.1土著菌对BC2固氮效果的影响 各个处理条件下,土壤含氮量均有所下降,土壤灭菌后接种BC2处理组合在收获时土壤含氮量最高,为0.41 g/kg,也低于试验开始前的水平(表1),这主要是冰草生长消耗导致的。在土壤不灭菌的情况下,接种固氮菌的植株干质量比未接种的处理高5.8%,土壤灭菌后,接种处理的植株干质量比未接种的高6.8%, 说明接种对促进冰草生长有一定作用。无论土壤灭菌与否,接种BC2后植物吸收的总氮量、土壤总氮量和体系总氮量均显著高于未接种处理(P<0.05)(表1)。如果仅从植株生物量的增加幅度来比较,土壤灭菌条件下的接种效应与土壤不灭菌的无显著差异(P>0.05)。但在土壤不灭菌的情况下,接种固氮菌的植株总氮量比未接种的处理高8.7%,而土壤灭菌后,接种处理的植株总氮量比未接种的高12.5%。若比较土壤和植物的总氮量相加得到的体系总氮量,土壤灭菌的效果更加明显。在土壤不灭菌的情况下,接种固氮菌使体系总氮量增加42.55 mg/kg,而在土壤灭菌后,接种处理使体系总氮量增加80.95 mg/kg,是未灭菌处理的近2倍。
2.2增加碳源对BC2固氮效果的影响 在土壤不灭菌的前提下接种固氮菌,加蔗糖与不加蔗糖处理间的联合体系总氮量、植株吸收的总氮量及土壤总氮量均无显著差异(P>0.05)(表2)。若供试土壤经过灭菌,情况则不同,在加蔗糖与不加蔗糖处理间土壤总氮量以及植物吸收的总氮量均存在显著差异(P<0.05)。加蔗糖处理整个植株和土壤体系的总氮量比不加蔗糖处理高31.03 mg/kg。
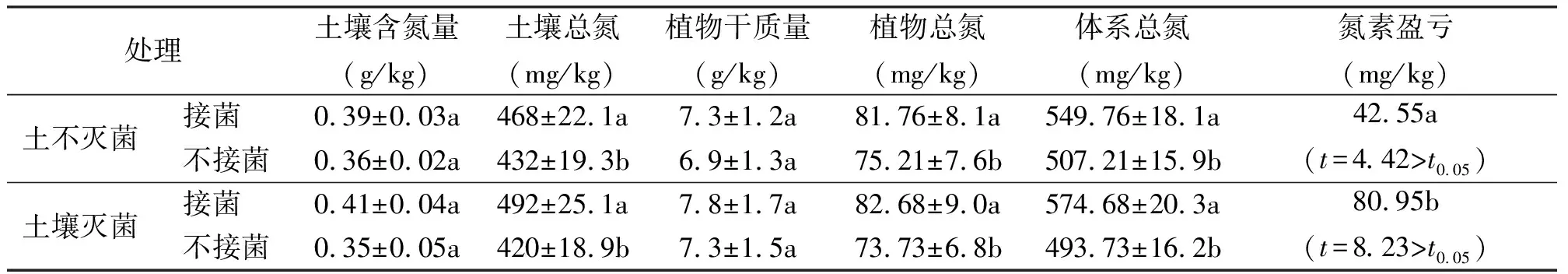
表1 土壤灭菌对固氮菌BC2接种效果的影响
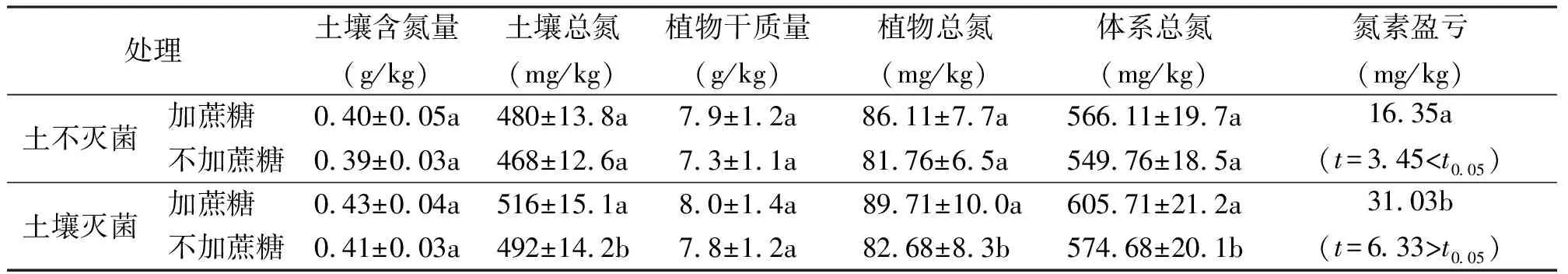
表2 增加碳源对固氮菌接种效果的影响
3 讨论
土壤是一个动态、有生命的自然体,是微生物良好的培养基,同时微生物也是土壤的重要组成部分,在草原生态系统的物质和能量转化中占有重要地位,是维持草原生态平衡的参与者[15-16]。在土壤中,很多种微生物杂居在一起。土壤中存在大量种类和数量不同的土著菌,它们能有效地利用有限的碳源在竞争中处于优势地位。即使对于共生固氮作用的根瘤菌而言,虽不直接在土壤中与其他微生物争夺营养而是侵入植物体获得能量,但大量研究表明根瘤菌的接种也受土著菌的影响[17]。因此,非共生固氮菌的接种必然存在土著菌的竞争和影响。在这种情况下,明确固氮菌的竞争能力非常必要。本研究充分表明,在内蒙古锡林郭勒草原土壤中存在着与BC2 菌株即少动鞘氨醇假单胞菌竞争的土著菌,因为经土壤灭菌处理后接种,其效果明显好于未灭菌处理。但是,未经灭菌处理的土壤接种固氮菌BC2 也使整个体系的总氮量显著增加, 意味着菌株BC2也具有一定的竞争能力;研究还表明,增加碳源于土壤对提高BC2的固氮效率有显著作用。本研究供试土壤的有机质含量为1.5%,属于瘠薄土壤,许多草地的土壤有机质含量低于该值,意味着碳源更加缺乏。因此,增加土壤有机质的措施必将会直接和间接地增加土壤含氮量。
内蒙古锡林林郭勒草原土壤中广泛分布有非共生固氮菌,它们是草地氮素的重要来源。因此,挖掘草地非共生固氮菌的潜力,摸清影响固氮菌固氮能力的环境因子亦是草地氮素营养的重要研究内容,对指导生产实践具有重要理论意义。
[1]窦新田.生物固氮[M].北京:农业出版社,1989.
[2]Kostychev S,Sheloumova A,Shul’gina O.Nitrogen content of soils of the southern coast of Crimea (Russian) [J].Sovetskii Agronomy,1926,1:1-2.
[3]Mishustin E N.The importance of non-symbiotic nitrogen fixing microorganisms in agriculture[J].Plant and Soil,1970,32:545-554.
[4]Dart P J.Nitrogen fixation associated with non-legumes in agriculture[J].Plant and Soil,1986,90:303-304.
[5]Rubenchik L.Azotobacter and its use in agriculture[J].Israel Program for Translation,Jerusalem,Bulletin,1963,179:12-14.
[6]Ladha J K,Reddy P M.Nitrogen fixation in rice systems:State of knowledge and future prospects [J].Plant and Soil,2003,252:151-167.
[7]Peoples M B,Herridge D F,Ladha J K.Biological nitrogen fixation:An efficient source of nitrogen for sustainable agricultural production[J].Plant and Soil,1995,174:3-28.
[8]许建平,倪礼斌,时燕.水稻应用耐铵型联合固氮菌的效果[J].上海农业科学,2002,17(3):52-56.
[9]方萍,张丽梅,贾小明,等.固氮螺菌(Azospirillumbr-asilense)NO 40在红壤性水稻上的接种效应[J].浙江大学学报,2001,27(1):33-36.
[10]张丽梅,方萍,朱日清.禾本科植物联合固氮研究及应用现状展望[J].应用生态学报,2004,15(9):1650-1654.
[11]郑红丽,樊明寿,靳润岁,等.内蒙古锡林郭勒天然草原禾本科牧草根际18株固氮细菌的初步分类鉴定[J].干旱区资源与环境,2011,25(9):106-109.
[12]刘楠,张英俊.放牧对典型草原土壤有机碳及全氮的影响[J].草业科学,2010,27(4):11-14.
[13]Keeling A A,Cook J A.Estimate of N2-fixation in waste-drived compost after treatment with glucose[J].European Journal of Soil Biology,1998,34(4):151-155.
[14]鲍士旦.土壤农化分析 [M].第三版.北京:中国农业出版社,2005:42-49.
[15]张成霞,南志标.放牧对草地土壤微生物影响的研究述评[J].草业科学,2010,27(1):65-70.
[16]文都日乐,李刚,张静妮,等.呼伦贝尔不同草地类型土壤微生物量及土壤酶活性研究[J].草业学报,2010,19(5):94-102.
[17]丁武.影响根瘤菌竞争结瘤的生态学因素分析[J].生态学杂志,1992,11(4):50-54.
——固氮微生物

