雷帕霉素对糖尿病肾病大鼠的保护作用
冯 欣 李 垚 王雪鹰
糖尿病肾病(DN)是糖尿病(DM)最常见的严重微血管并发症,一旦肾脏受累出现持续性蛋白尿,往往不可逆转,并在较短时间内进入终末期肾功能衰竭。因此,如何更有效地延缓或阻止DN的进展,具有重要的临床意义。雷帕霉素(RAPA)是一种大环内酯类抗生素,也是安全、有效、低毒的新型免疫抑制剂。近年来动物实验发现RAPA不仅有免疫抑制作用,而且能抑制血管平滑肌增生和移行,减轻纤维化反应[1],但是对DN的作用机制及疗效观察尚少见报道。本实验探讨了RAPA对糖尿病大鼠肾脏早期病变的影响及其作用机制。
1 材料与方法
1.1 动物与分组 成年清洁级SD大鼠36只,体质量250~300 g,购自辽宁医学院实验动物中心。将36只大鼠用随机数字表法分为对照组、糖尿病模型组(糖尿病组)、糖尿病雷帕霉素治疗组(雷帕霉素组),每组12只。在造模成功后,雷帕霉素组每天予雷帕霉素1 mg/kg灌胃,对照组和糖尿病组每天予等量生理盐水灌胃,饲养至4周后处死。
1.2 方法
1.2.1 糖尿病动物模型的建立 拟造模大鼠腹腔注射链脲佐菌素(streptozotocin,STZ),溶于0.1 mol/L枸橼酸盐缓冲液中,pH 4.5,65 mg/kg,对照组只注射相当体积的枸橼酸盐缓冲液,48 h后尾尖取血,血糖仪测定血糖,尿糖试纸测定尿糖,血糖≥16.7 mmol/L,尿糖+++~++++者确定为糖尿病模型。实验期间动物自由进食、饮水,不使用胰岛素及其他降糖药物。
1.2.2 实验试剂 小鼠抗大鼠细胞增殖核抗原(PCNA)抗体(Santa Cruz公司);小鼠抗大鼠Ⅳ型胶原(COL-Ⅳ)多克隆抗体(SantaCruz公司);雷帕霉素口服液,1mg/mL(华北制药集团)。
1.2.3 大鼠血、尿生化指标的测定 每个样本取20 μL血清和20 μL尿液用日立7170A全自动生化分析仪测定血糖(Glu)、血肌酐(Cr)、尿素氮(BUN)和尿蛋白(UPro)。
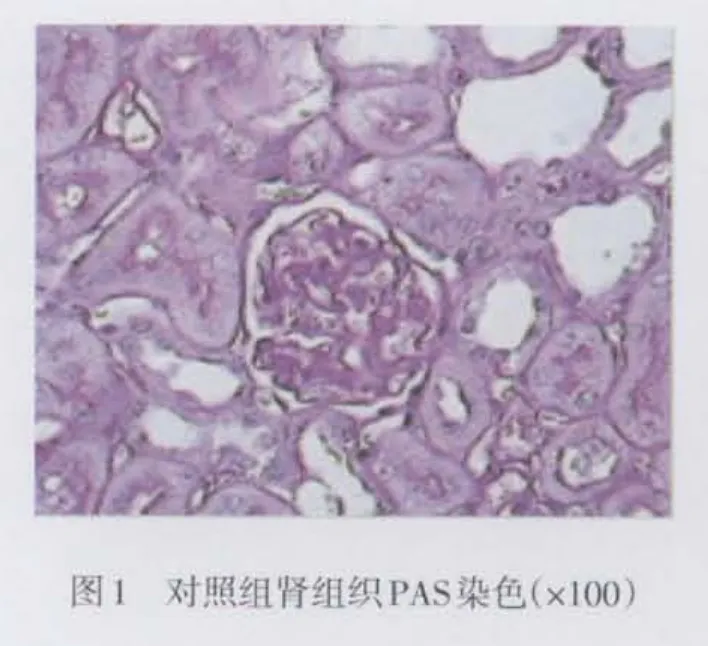
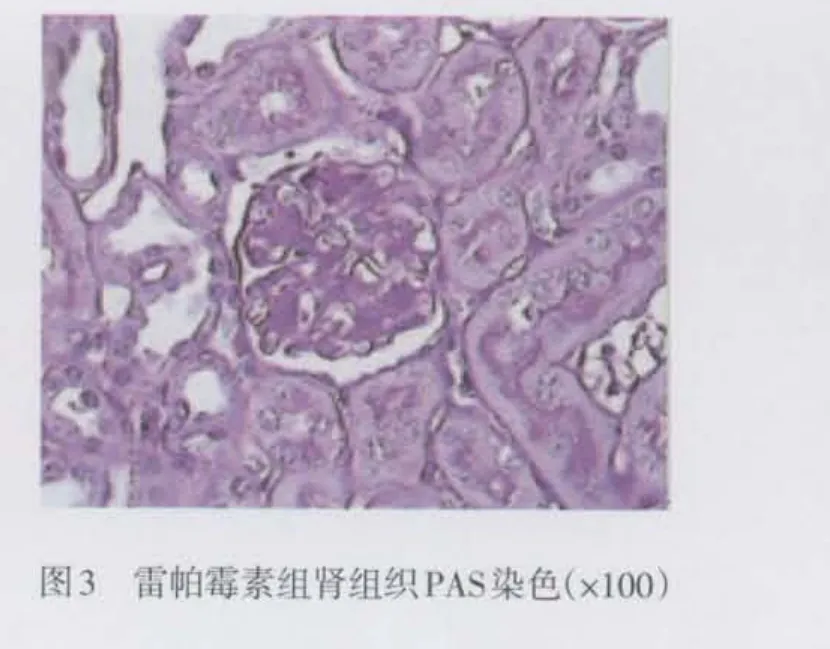
1.2.4 组织学检查 肾组织常规脱水、透明、浸蜡、包埋。4 μm石蜡切片用于苏木素伊红(HE)、过碘酸雪夫(PAS)染色,光镜下观察。
1.2.5 PCNA、COL-Ⅳ蛋白的表达 采用Western blotting法。处死各组大鼠,冰上分离肾皮质,剪碎组织,放入80目不锈钢筛网研磨,不断用生理盐水冲洗,然后经140目不锈钢筛网过滤,再经200目不锈钢筛网过滤,最后收集筛网上物质,冷盐水清洗,4℃、2 000 r/min离心5 min,所得沉淀物经光镜观察确定95%以上为肾小球。RIPA裂解液裂解细胞,冰浴静置1 h,然后4℃、14 000 r/min离心25 min,取上清液,BCA法测定蛋白浓度后,制成蛋白浓度相等的样品。8%SDS-聚丙烯酰胺凝胶上垂直电泳(80 V,1 h)。电转印至硝酸纤维素膜上(电压60 V,3 h)。5%的脱脂奶粉封闭2 h,分别加入PCNA、COL-Ⅳ抗体,孵育过夜,二抗室温孵育2 h。用显色液行碱性磷酸酶法显色。Scinn Corporation分析软件进行灰度值半定量分析。实验重复3次。
1.3 统计学处理 用SPSS 11.0统计软件分析,实验数据以均数±标准差(±s)表示,各组间进行组间单因素方差分析,组间两两比较行LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 大鼠的一般情况 与对照组相比,糖尿病组大鼠腹腔注射STZ 48 h后,表现为多食、多饮、多尿,毛色晦暗,逐渐出现消瘦及体质量减轻。尿糖+++~++++,血糖持续≥16.7 mmol/L,DM模型成立。给药4周后,雷帕霉素组大鼠与糖尿病组相比,血糖无明显减低,而肾质量/体质量显著降低,见表1。
2.2 生化指标的变化 各组大鼠给药4周后,糖尿病组大鼠与对照组相比BUN、Cr及UPro明显增高(P<0.05或P<0.01),而雷帕霉素组上述指标较糖尿病组明显减轻(均P<0.05),见表1。
2.3 大鼠肾组织标本病理改变 光镜下观察,与对照组相比糖尿病组大鼠肾小球体积增大,系膜基质轻度增多,肾小管上皮细胞出现空泡变性,小灶状萎缩,小动脉管壁轻度增厚,而雷帕霉素组上述改变明显减轻,见图1~3。
表1 各组大鼠生化指标和肾质量/体质量比较(n=12,±s)

表1 各组大鼠生化指标和肾质量/体质量比较(n=12,±s)
*P<0.05,**P<0.01
组别对照组(1)糖尿病组(2)雷帕霉素组(3)F P(1)∶(2)(1)∶(3)(2)∶(3)Glu(mmol/L)4.12±1.43 28.71±2.38 25.82±2.15 34.77**<0.001<0.001 0.413肾质量/体质量(×10-3)4.22±0.31 9.11±0.52 6.19±0.24 28.43*0.035 0.046 0.023 BUN(mmol/L)5.24±0.74 14.34±1.85 8.26±0.82 62.56*0.004 0.056 0.036 Cr(μmol/L)33.32±9.25 103.16±6.28 78.34±5.62 123.12*<0.001 0.035 0.019 UPro(g/24 h)6.33±1.84 15.63±2.32 7.31±1.54 50.65*0.019 0.289 0.028

2.4 Western印迹结果 与对照组相比,糖尿病组大鼠肾小球PCNA和COL-Ⅳ蛋白表达水平均增高(P<0.01)。与糖尿病组相比,雷帕霉素治疗组大鼠肾小球PCNA和COL-Ⅳ蛋白表达明显下调(P<0.01),而雷帕霉素组与对照组比较,PCNA和COL-IV蛋白表达水平差异无统计学意义(P>0.05),见图4、表2。

图4 各组大鼠PCNA、COL-Ⅳ的蛋白表达
表2 各组大鼠PCNA、COL-Ⅳ的蛋白表达(n=3,±s)

表2 各组大鼠PCNA、COL-Ⅳ的蛋白表达(n=3,±s)
**P<0.01
组别对照组(1)糖尿病组(2)雷帕霉素组(3)F P(1)∶(2)(1)∶(3)(2)∶(3)PCNA 101.36±0.14 311.34±0.32 133.09±0.56 232.98**<0.001 0.067<0.001 COL-Ⅳ223.67±0.17 381.21±0.34 260.68±0.32 487.45**<0.001 0.125<0.001
3 讨论
DN的发病机制复杂,遗传背景、血流动力学改变、代谢紊乱、免疫因素均参与发病过程。越来越多的研究者认为磷脂酰肌醇3激酶(PI3-K)/蛋白激酶B(AKT)/哺乳动物雷帕霉素靶(mammalian target of rapamycin,mTOR)途径可能是影响DN病程的重要因素[2]。RAPA是从吸水性链霉菌发酵液中提取出来的一种低毒性大环内酯类抗生素[3],具有抗自身免疫性疾病和抗细胞增殖、预防移植物血管病变的作用,临床已用于血管支架涂层和器官移植术后,以减少排斥反应。RAPA进入细胞浆后,首先与FK结合蛋白(FK binding proteins,FKBP-12)结合,形成RAPA-FKBP复合体,该复合体通过与mTOR氨基酸残基结合导致mTOR失活,阻碍其下游的信号转导通路[4]。mTOR稳定状态下主要存在于细胞胞质内,激活后进入胞核,调控下游靶分子真核细胞翻译起始因子4E结合蛋白l(4E-BP1)和核糖体40S小亚基S6蛋白激酶,调控蛋白质的合成和细胞周期的演变,参与细胞因子和相应受体之间的作用及转导跨膜信号。
RAPA有强大的抗炎、抗增殖、抗纤维化效应,在防治肾病中也发挥重要的作用。Lloberas等[5]研究发现糖尿病大鼠组织中磷酸化蛋白激酶B(P-AKT)和mTOR高表达,接受RAPA治疗后,上述2个指标表达显著降低,肾组织纤维连接蛋白水平和肌动蛋白表达也显著下降,RAPA可以显著抑制肾脏内mTOR通路下游基因表达,延缓糖尿病肾病的进展。另外,动物实验证实RAPA能缓解膜性肾病中小管间质炎症细胞浸润和抑制纤维化进程;局灶节段性肾小球硬化病变早期给予RAPA治疗能减弱肾小球硬化,缓解病情进展;RAPA可抑制肾切除后代偿性的肾肥大及单侧输尿管梗阻大鼠肾间质纤维化进程[6]。RAPA在体外可抑制生长因子诱导的内皮细胞和平滑肌细胞增生,干扰细胞因子介导的信号传导[7]。体外实验证实低剂量RAPA可抑制系膜细胞增殖[8]。Pallet等[9]观察到RAPA可以明显抑制肾小管上皮细胞的增殖。
本研究结果显示,光镜下糖尿病组肾小球系膜基质增多,基底膜增厚,而雷帕霉素治疗组上述病变大大减轻,说明RAPA可以抑制早期糖尿病肾小球的病变。细胞外基质的积聚是DN发生的主要原因,COL-Ⅳ是肾小管基底膜的主要成分,参与构成细胞外基质。本实验也发现RAPA治疗组肾脏COL-Ⅳ的表达较糖尿病组减少,说明RAPA可以减少糖尿病大鼠肾脏胶原的合成,进一步阻止细胞外基质的积聚,减少间质纤维化的发生。PCNA是一种细胞周期调节蛋白,其表达在G1期早期开始上升,S期达最高峰,G2期和M期持续下降,G0期维持在极低水平,因此可作为肾小管上皮细胞增殖的标志物。本研究显示糖尿病组大鼠组织中高表达PC⁃NA,而经RAPA治疗后PCNA表达显著降低,可见予RAPA治疗后肾小管上皮细胞的增殖明显被抑制。
RAPA是一种疗效好、低毒、无肾毒性的新型免疫抑制剂,本研究提示RAPA可以抑制糖尿病肾病大鼠的细胞增殖,减轻肾硬化,为临床应用RAPA治疗糖尿病肾病患者提供了实验依据。
[1]Parthasarathi K,Ichimura H,Monma E,et al.Connexin 43 mediates spread of Ca2+dependent proinflammatory responses in lung capillar⁃ies[J].J Clin Invest,2006,116(8):2193-2200.
[2]Sataranatarajan K,Mariappan MM,Lee MJ,et al.Regulation of elon⁃gation phase of mRNA translation in diabetic nephropathy:amelio⁃ration by rapamycin[J].Am J Pathol,2007,171(6):1733-1742.
[3]Liu L,Li F,Cardelli JA,et al.Rapamycin inhibits cellmotility by sup⁃pression of mTOR-mediated S6K1 and 4E-BP1pathways[J].Onco⁃gene,2006,25(53):7029-7040.
[4]孙彬,王宁宁,何伟春.雷帕霉素对肾间质成纤维细Notch1/Jag⁃ged1信号通路及FN表达的影响[J].南京医科大学学报(自然科学版),2006,26(9):829-833.
[5]Lloberas N,Cruzado JM,Franquesa M,et al.Mammalian target of ra⁃pamycin pathway blockade slows progression of diabetic in rats[J].J Am Soc Nephrol,2006,17(5):1395-1404.
[6]Wu MJ,Wen MC,Chiu YT,et al.Rapamycin attenuates unilateral ure⁃teral obstruction-induced renal fibrosis[J].Kidney Int,2006,69(11): 2029-2036.
[7]戎赞华,段惠军,郝军.雷帕霉素抑制IgA肾病大鼠肾小球信号蛋白STAT3的活化[J].基础医学与临床,2008,28(5):460-464.
[8]Fingar DC,Blenis J.Target of rapamycin(TOR):an integrator of nutri⁃ent and growth factor signals and coordinator of cell growth and cell cycle progression[J].Oncogene,2004,23(4):3151-3171.
[9]Pallet N,Thervet E,Le Corre D,et al.Rapamycin inhibits human re⁃nal epithelial cell proliferation:effect on cyclinD3 mRNA expres⁃sion and stability[J].Kidney Int,2005,67(6):2422-2433.
——雷帕霉素

