1H NMR化学位移的正确理解和规范表述
陈 静侯文华
(1南京工业大学理学院应化系 江苏 南京 210009;2南京大学化学化工学院 江苏 南京 210093)
核磁共振(NMR)是有机化合物表征和结构鉴定中最常用的波谱分析手段之一。其中,核磁共振氢谱(1H NMR)是应用最普遍的结构分析方法。1H NMR主要是根据谱图中每一个峰组的化学位移、峰强度、峰组数和峰裂分情况等来推断出对应的结构单元的,进一步还可以通过相邻质子的偶合常数J来确定化合物的构型和相邻质子相互偶合情况。但是,在1H NMR的教学和应用中,时常会出现对化学位移值的不正确理解及表述上的疑惑和不规范。此外,对于偶合常数J在解析中的运用也不是很清楚。究其原因,主要是对核磁共振中的化学位移和相关知识理解不到位。本文结合一些典型的例子,从1H NMR的基本原理出发,就化学位移的产生、化学位移值的定义、相邻质子的偶合与裂分、偶合常数以及如何解谱和规范表述等作一简要的说明。
一、核磁共振原理和1H NMR中的化学位移
核磁共振的研究对象是具有磁矩的原子核。凡是自旋量子数不等于零的原子核 (如1H、13C),都可以发生核磁共振。其产生的条件是:带有磁性的核在外磁场的作用下发生自旋能级分裂,当吸收外来电磁辐射时,将发生核自旋能级的跃迁,从而产生所谓的核磁共振现象。
在有机化合物中,处在不同结构和位置上的各种氢核周围的电子云密度不同,导致共振频率有差异,即产生共振吸收峰的位移,这种现象被称为化学位移。核周围的电子屏蔽效应是化学位移产生的主要原因(核周围电子产生的感应磁场对外加磁场的抵消作用称为屏蔽效应,见图1)。通常氢核周围的电子云密度越大,屏蔽效应也越大,从而需要在更高的磁场强度中才能发生核磁共振和出现吸收峰。
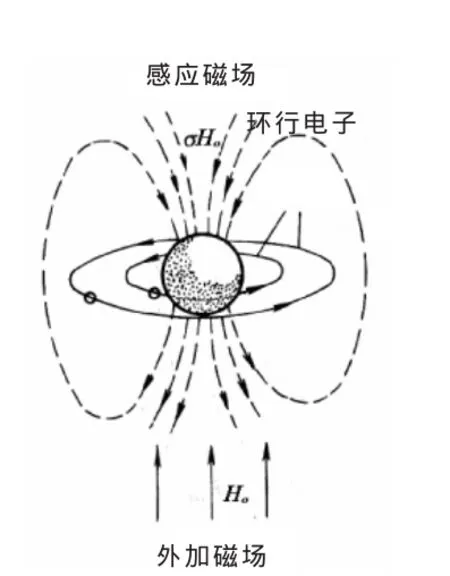
图1 核的抗磁屏蔽(H。为外加磁场,σ为屏蔽常数)
目前,文献资料中的化学位移值普遍采用无量纲的δ值表示,其定义为:

乘以106是为了使数值便于读取,上式中的δ实际上是一量纲为一的量,习惯上用的所谓单位为ppm其实是指百万分之一,不是严格意义上的物理量单位;另外,根据定义,用ppm其实是多余的,国外教科书和期刊中已逐渐不再出现 ppm[1~3]。 四甲基硅烷(tetramethylsilane,TMS)为标准化合物,并设其δ值为0。用标准化合物作对比是由于有机化合物中各种类型氢核的化学位移差异极小,难以精确测得数值。用δ表示的化学位移与外磁场强度无关。因此,样品中某一磁核在不同磁场强度的核磁共振仪上所得到的δ值都相同。由表1可知,多数有机化合物中的质子化学位移δ在0~12之间。
根据化学位移值可以很方便地描述各种不同磁核的相互位置关系。例如,某质子的δ为10,意味着相对于δ为5的质子,其处于低场或去屏蔽区。相反,δ为5的质子较δ为10的质子来说,其处于高场或屏蔽区。
影响化学位移的因素很多,其中电负性和各向异性效应影响最大。由于电负性大的取代基降低了氢核外围电子云的密度,其共振吸收峰移向低场,化学位移会变大;如与氧相连的碳上的质子(O-CH),其δ大于3。各向异性效应是由于成键电子的电子云分布不均匀导致在外磁场中所产生的感应磁场的不均匀所引起的,如苯环上质子的化学位移移向低场,δ在7左右。因此,常见氢核的化学位移值通常有一定的变化范围(见表1),并籍此可进行相应质子类型的推断。
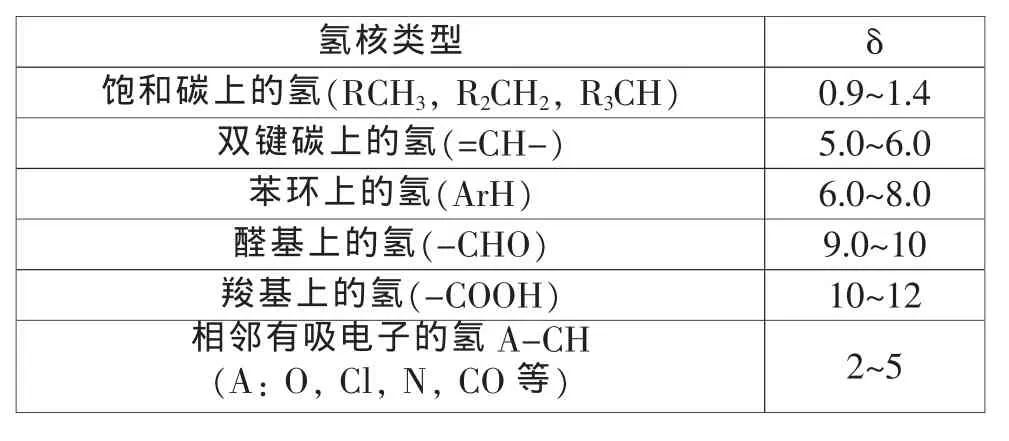
表1 常见氢核的典型化学位移[1]
二、自旋偶合、自旋裂分和偶合常数
自旋核与自旋核之间的相互作用(自旋干扰)称为自旋-自旋偶合,简称自旋偶合;由自旋偶合引起的谱峰分裂和谱线增多的现象称为自旋裂分(峰裂分)。由裂分所产生的裂距称为偶合常数,用符号J表示,单位为赫兹(Hz),它与外磁场强度无关,其大小反映了核与核之间偶合作用的强弱。相互偶合的两个核,其偶合常数相等。
下面,我们以-CHa-CHb-为例,具体说明氢核的偶合、裂分、化学位移及偶合常数。
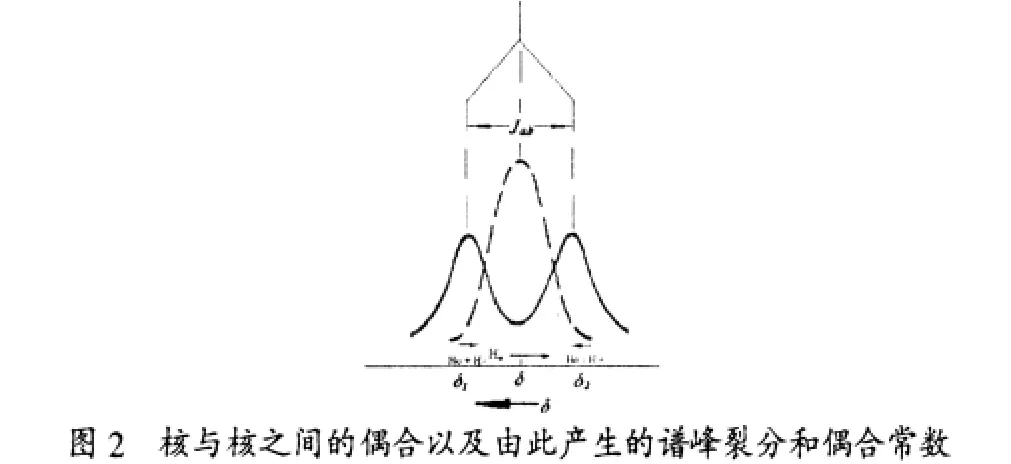
当Ha和Hb无偶合作用时,Ha只出现一个单峰 (见图2中的虚线峰),其对应的化学位移是δ。当Ha和Hb存在偶合作用时,由于Hb在外磁场H0中产生两种不同的取向,一种与外磁场相同,另一种则与外磁场相反;这两种不同取向在Ha周围分别起到了加强和削弱磁场的效果,从而使得Ha的核磁共振吸收峰在谱图上由一个峰裂分为强度相等的双峰(见图2中的实线峰),对应的化学位移分别是 δ1和 δ2,峰间距为偶合常数 Jab(Hz),其计算公式为 Jab=(δ1-δ2)×v仪器。 值得注意的是, 此时 Ha的化学位移取值仍为两条谱线的中心值,即裂分峰组的中心位置(即δ处)是Ha的化学位移值。
当相邻质子的化学位移之差Dn(如上例中,相邻质子 Ha和 Hb的 Dnab=(δa-δb)×v仪器,单位 Hz)与偶合常数J之比大于6时(即所谓的一级图谱),裂分峰数可用n+1规则来计算(n是邻近全同核个数)。但当Dn接近或小于J时,则出现复杂的多重峰,使谱图成为高级谱。
相邻质子数与裂分峰数和峰强度的关系还可用图3所示的帕斯卡三角规律来表示:

三、1H NMR谱解析

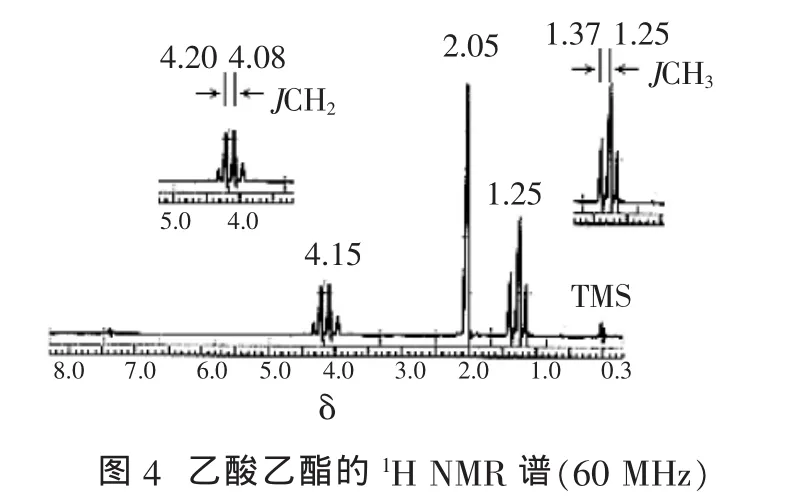
由图4可知,该化合物在1H NMR谱中出现三组峰。 其中,d4.15,峰强为 2,四重峰(峰强 1∶3∶3∶1),对应于乙基中的亚甲基;d2.05,峰强为 3,单峰,对应于乙酰基中的甲基;d1.25,峰强为 3,三重峰(峰强 1∶2∶1),对应于乙基中的甲基。由于乙基上甲基和亚甲基质子的相互偶合出现了峰的裂分,由偶合常数公式J=Δd×v仪器可计算获得相应质子的偶合常数。 其中,J(CH2)=(4.20-4.08)×60=7.2 Hz,J(CH3)=(1.37–1.25)×60 =7.2 Hz。 由偶合常数相等即可推断出它们的相邻偶合关系。此外,乙基上甲基和亚甲基的质子相互偶合的化学位移之差Dn=(4.15-1.25)×60=174 Hz,与偶合常数 J 之比为 24.2,大于6。故为一级谱,裂分峰数符合n+1规则。
该化合物的1H NMR规范表述为1H NMR(CDCl3,60 MHz):d4.15(q,J=7.2 Hz,2H,OCH2);d2.05(s,3H,CH3CO);d1.25(t,J=7.2 Hz,3H,CH2CH3)。
四、常见的错误
[1] Wade L G,Jr原著;王梅,姜文凤.改编.Organic Chemistry.第6版.北京:高等教育出版社,2009
[2] Wu Z M, Guo X Q, Wang Q L, et al.J Am Chem Soc.2010, 132 (5), 1567–1571
[3] Joon Soo Han, Takahiro Sasamori,Yoshiuki Mizuhata , et al.J Am Chem Soc.2010, 132 (8), 2546–2547
[4] 施耀曾,孙祥祯等.有机化合物光谱和化学鉴定 [M].南京:江苏科技出版社,1995
[5] 林晨,李英,林天舒等.介绍一个基础有机化学实验——用水做溶剂合成内消旋3,3’-二吡咯戊烷的方法 [J].大学化学,2009,24(3):49
