H3N8亚型马流感病毒单克隆抗体的制备及鉴定*
肖成蕊,宋战昀,杨立英,王伟利*,孟庆峰,孟日增
(1.吉林出入境检验检疫局,吉林长春130062;2.吉林省磐石市动物检疫站,吉林磐石132300)
马流行性感冒(Equine influenza,EI)是由正黏病毒科流感病毒属马A型流感病毒(Equine influenza virus,EIV)引起马属动物的一种急性暴发性流行的传染病,在马属动物中极易传播[1]。世界动物卫生组织(OIE)将其列为法定报告动物疫病[2],我国将其列为三类动物疫病。H3N8亚型马流感病毒于1963年在美国迈阿密马群中首次分离到[3],此后在多个国家暴发和流行。2007年,澳大利亚、日本、蒙古等国在已免疫的赛马中也相继暴发了H3N8亚型马流感[4-5]。我国历史上多个省份曾发生过马流感疫情,1989年我国东北地区发生H3N8亚型马流感[6],1993年华北地区暴发H3N8亚型马流感[7]。2007年10月,在华北地区某赛马场的赛马也发生了H3N8亚型马流感[8]。
马流感的实验室血清学诊断方法有血凝抑制试验(HI)、单向辐射溶血试验(SRH)等[9-10],其检测结果确切,但是操作复杂,检测周期长,需要测定被检马匹急性期和恢复期的双份血清,间隔期为14 d~20 d,如抗体升高4倍以上,即诊断为EIV感染[11]。由单克隆抗体介导的血清学方法是最有效的检测方法之一[12],具有操作简单、特异性强等特点。本研究旨在获得分泌抗H3N8亚型马流感病毒单克隆抗体的杂交瘤细胞,为进一步建立H3N8亚型马流感病毒快速简便的检测方法奠定基础。
1 材料与方法
1.1 材料
马流感病毒A/Equine/Jilin/1/1989(H3N8)为1989年吉林分离株,马流感病毒A/Equine/Beijing/1/1974(H7N7)由吉林出入境检验检疫局技术中心生物室保存,马动脉炎病毒(EAV)、马传染性贫血病毒(EIAV)、马日本脑炎病毒(JEV)抗原均由哈尔滨兽医研究所惠赠;Balb/c小鼠购自吉林大学实验动物中心;SP2/0骨髓瘤细胞系由吉林出入境检验检疫局技术中心生物室保存;单克隆抗体亚型鉴定试剂盒等为Sigma公司产品;HRP-羊抗鼠Ig购自中国惠世生化试剂有限公司;PageRulerTMPrestained Protein Marker购自Fermentas公司,低分子蛋白质量Maker购自上海生物化学研究所,预染蛋白质Marker购自宝生物工程(大连)有限公司。
1.2 方法
1.2.1 病毒抗原制备 将A/Equine/Jilin/1/1989(H3N8)种毒经11日龄SPF鸡胚尿囊腔接种扩增,72 h收集感染鸡胚的尿囊液,蔗糖密度梯度离心纯化病毒。
1.2.2 mAb的制备
1.2.2.1 动物免疫 稀释纯化病毒至200 μ g/mL,2 mL/L甲醛灭活后与弗氏完全佐剂等体积乳化混匀,腹腔和皮下分别注射雌性8周龄Balb/c小鼠,0.2 mL/只。以后每间隔两周用等量弗氏不完全佐剂乳化,加强免疫2次,剂量同首免。融合前3 d加强免疫,剂量加倍。
1.2.2.2 间接ELISA检测方法的建立 参照文献[13]方法建立间接ELISA,在酶标板上进行方阵滴定,确定检测抗原全病毒的最佳包被浓度及阳性、阴性对照血清的最佳稀释浓度。
1.2.2.3 血凝抑制试验检测方法的建立 小鼠血清前处理方法:用PBS将血清做1∶5倍稀释,加入等体积的白陶土悬液混匀,4℃孵育20 min(期间混匀2次~3次),4℃、1 000 r/min离心15 min,收集上层血清,得到原血清1∶10的稀释液,此稀释血清用于血凝抑制试验,检测抗体滴度,血凝抑制试验方法按照文献[11]进行,并将HI结果与建立的间接ELISA方法获得的结果与进行比较。
1.2.2.4 细胞融合、筛选及克隆 参照文献[14]的方法,SP2/0细胞及免疫鼠脾细胞用洗液做适当稀释后计数,两种细胞按1∶5的比例混合,离心去上清,缓慢加入PEG 4000(pH 8.0),再加入洗液20 mL~30 mL,离心弃上清,加入HAT营养液混匀。在铺有饲养细胞的96孔板上每孔加入100 μ L融合细胞悬液,最后将融合细胞培养板于37℃、体积分数为5%的CO2培养箱中培养。用间接ELISA筛选分泌阳性抗体的杂交瘤细胞,所用的包被抗原是纯化的已灭活的A/Equine/Jilin/1/1989(H3N8)株病毒。将筛选的阳性杂交瘤细胞进行克隆,检出的阳性孔再次克隆和亚克隆,最后选择OD450nm值高、细胞活力好、单一细胞株的孔扩大培养。
1.2.2.5 单克隆抗体腹水的制备 采用体内诱生腹水法制备单克隆抗体腹水。选6周龄雌性Balb/c小鼠,腹腔注射灭菌液体石蜡,0.5 mL/只,7 d~10 d后腹腔注射5×105个杂交瘤细胞,待小鼠腹部膨大后收集腹水,腹水4℃静置过夜。次日3 000 r/min离心10 min收集上清,分装保存于—70℃备用。
1.2.3 mAb的生物学特性鉴定
1.2.3.1 抗体效价的测定 用已经建立的间接ELISA法和血凝抑制试验测定所制备的mAb腹水抗体效价。
1.2.3.2 抗体亚类的鉴定 采用SBA ClonotypingTMSystem/HRP抗体亚类鉴定试剂盒测定,方法按试剂盒说明进行。
1.2.3.3 抗体特异性鉴定 使用Western blot方法进行mAb特异性和所识别的靶位进行鉴定,按文献[15]方法进行。具体为,将纯化的H3N8 EIV、H7N7 EIV病毒以及纯化的EAV、EIAV、JEV全病毒进行SDS-PAGE,并转移到硝酸纤维素(NC)膜上。用含1 g/L牛血清白蛋白的PBS在4℃条件下封闭过夜,用PBST洗涤3次,每次5 min;再以制备的mAb为一抗,37℃孵育1 h,洗涤同上;羊抗鼠IgG-H RP(1∶10 000)为二抗,37℃孵育1 h,洗涤同上;最后用DAB显色15 min,用去离子水洗涤中止反应,观察结果并照相。
2 结果
2.1 mAb的筛选与杂交瘤细胞株的建立
经过细胞融合、间接ELISA法和HI方法筛选,获得3株能稳定分泌A/Equine/Jilin/1/1989(H3N8)株病毒特异性mAb的杂交瘤细胞株,分别命名为3C2、5G10和5A10。
2.2 mAb的效价测定
间接ELISA法测定3株mAb的腹水效价,3C2和5G10为1∶64 000,5A10为1∶32 000。HI方法测定3株mAb的腹水HI效价,3C2为1×213,5G10为1×211,5A10为1×28。
2.3 抗体亚类鉴定
利用SBA ClonotypingTMSystem/H RP抗体亚类鉴定试剂盒对3株mAb亚类鉴定的结果显示,3C2和5G10为IgG2a亚型,5A10为IgM亚型,轻链均为κ链。
2.4 mAb的特异性鉴定
Western blot结果显示,3株mAb不与EAV、EIAV、JEV病毒发生反应(图1);也不与H7N7亚型EIV发生血凝抑制反应,表明3株mAb具有良好的病毒特异性和亚型特异性。
纯化的A/Equine/Jilin/1/1989(H3N8)亚型EIV全病毒经10%SDS-PAGE后,转印至NC膜上,与3C2株mAb进行Western blot表明,在分子质量约为47 ku处的一蛋白条带能被mAb特异性识别,该蛋白条带的大小与H3N8亚型EIV的HA基因编码的血凝素糖蛋白HA1大小相一致[16],表明筛选到的单克隆抗体是特异性识别H3N8亚型EIV HA1蛋白的(图2和图3)。
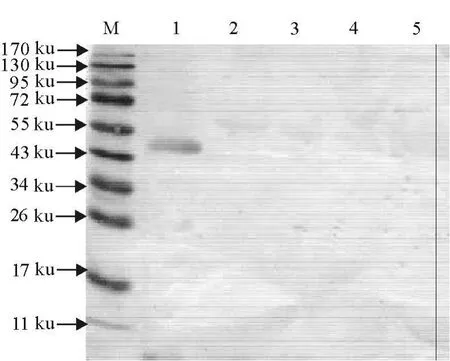
图1 3C2株单克隆抗体特异性的Western blot分析Fig.1 Analysis of specificity of mAb 3C2 by Western blot
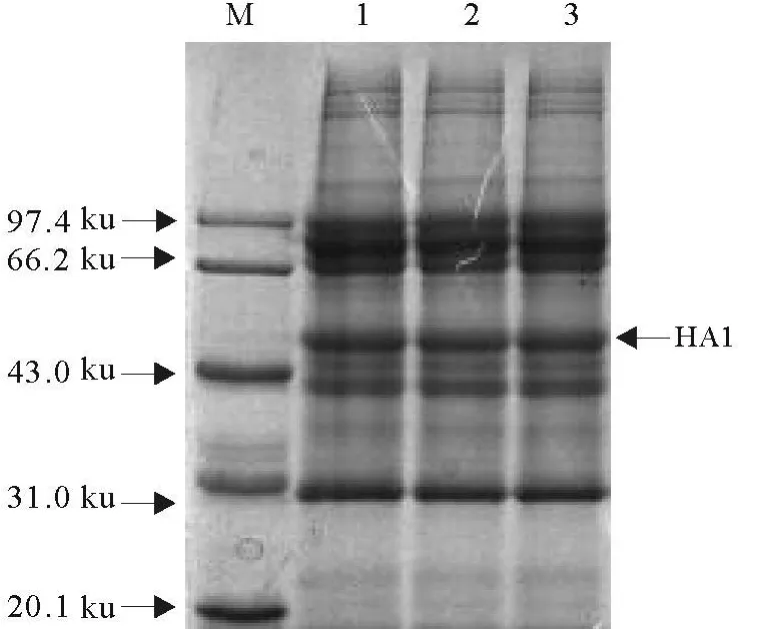
图2 H3N8亚型EIV全病毒SDS-PAGE分析Fig.2 SDS-PAGE analysis of H3N8 subtype equine influenza virus

图3 H3N8亚型EIV全病毒与3C2株单克隆抗体的Western blot分析Fig.3 Western blot analysis of H3N8 subtype equine influenza virus with 3C2 mAb
3 讨论
目前检测EIV的方法有很多,但各有弊端,病毒分离、血清学试验至今仍是针对马流感诊断和对EIV进行定型普遍采用的方法,但这些方法操作比较复杂,不能对病毒进行快速诊断,不利于马流感的及时有效防控[17]。同时,引起马流感的EIV包括抗原完全不同的两个亚型,且不能交叉保护,两个亚型的EIV发病临床表现相似,控制流行最有效的方法是对流行毒株的及时定型及针对性免疫预防;血凝抑制试验可以应用标准病毒液测定血清中的相应抗体或应用特异性抗体鉴定新分离的病毒,是马流感检测最常用的方法,也是OIE推荐的血清学检查方法之一[2,18]。但是,血凝抑制试验测定病马急性期和恢复期的双份血清,一般间隔14 d~20 d,如抗体升高4倍以上,即诊断为流感病毒感染。近年来,在马流感快速诊断方面取得了较大的突破,Denyer H等[20]建立的马流感H7N7和H3N8两个亚型的ELISA的精确度高于HI和SRH试验[19]。Ozaki H等[20]建立的马流感非结构蛋白(NS1)抗体的ELISA检测方法,又可鉴别自然感染马匹和灭活苗免疫马匹。朱来华等[21]是国内首次利用基因芯片技术同时检测了马疱疹病毒1型(EHV1)、马动脉炎病毒(EAV)、马流感病毒(EIV)、马传染性贫血病毒(EIAV)和东部马脑脊髓炎病毒(EEEV),其结果显示,可同时鉴别上述5种病毒,可检测到阳性杂交信号的最高稀释度为10—6的病毒液,约25个病毒DNA拷贝。郭巍等[13]首次在我国建立了检测H3N8亚型马流感抗体的间接ELISA诊断方法,并成功应用于EI的防治。尽管检测EIV的新方法不断涌现,病毒的分离鉴定仍是检测病原的“黄金标准”,新方法的建立均需要用该方法验证[22]。
本研究以纯化的A/Equine/Jilin/1/1989(H3N8)全病毒作为免疫原,经细胞融合、筛选及克隆化,获得3株分泌特异性mAb的杂交瘤细胞。特异性试验表明,所获3株mAb均只与H3N8亚型EIV的血凝素蛋白产生特异性反应。Western blot分析显示,3C2株mAb H3N8亚型EIV全病毒在分子质量为47 ku处出现明显的反应条带,与EIV血凝素蛋白HA1的分子量相一致。将3株mAb与A/Equine/Jilin/1/1989(H3N8)进行HI试验的结果表明,3株mAb均具有较高的血凝抑制效价,进一步说明3株mAb特异性识别H3N8亚型EIV的血凝素蛋白。本研究制备了针对H3N8亚型EIV的单克隆抗体,特异性试验结果显示,不与H7N7亚型EIV发生交叉反应,可以有效的区分两种亚型的病毒。因此,为马流感的快速诊断和病毒的抗原性分析等奠定了基础。同时,本研究制备出的杂交瘤细胞株能稳定分泌特异性单克隆抗体,为研制一种方便、快捷、特异的金标试纸诊断方法奠定了坚实的基础。
[1] Murcia P R,Baillie G J,Daly J.Intra-andinter host evolutionary dynamics of equine influenza virus[J].J Virol,2010,84(14):6943-6954.
[2] OIE,2009.Equine influenza.In:Manual of diagnostic tests and vaccines for terrestrial animals,Chapter 2.5.7,http://www.oie.int/eng/en_index.htm.
[3] Waddel G H,T eighland M B,Siegel M M,et al.A new influenza virus associated with equine respiratory disease[J].J Am Vet M ed Assoc,1963,143:587-590.
[4] Yamanaka T,Niwa H,Tsujimura K,et al.Epidemic of equine influenza among vaccinated race horses in Japan in 2007[J].J Vet Med Sci,2008,70:623-625.
[5] Bryant N,Rash A,Lewis N,et al.Australian equine influenza:vaccine protection in the UK[J].Vet Rec,2008,162:491-492.
[6] Guo Y,Wang M,Kawaoka Y,et al.Characterization of a new avain-like influenza virus from horses in China[J].Virology,1992,188:245-255.
[7] 褚桂芳,相文华,曲连东,等.马流感病毒的分离及其亚型的初步鉴定[J].中国畜禽传染病,1995(6):20-22.
[8] 蒋桃珍,刘月焕,林 健,等.2007年华北地区H3N8亚型马流感病毒的分离与鉴定[J].中国兽医学报,2010,30(5):607-611.
[9] 杨建德,相文华.我国马流感的研究现状[J].黑龙江畜牧兽医,2002(3):42-44.
[10] Morley P S,Hanson L K,Bogdan J R,et al.The relationship between single radial hemolysis,hemagglutination inhibition,and virus neutralization assay s used to detect antibodies specific for equine influenza viruses[J].Vet Microbiol,1995,45(1):81-92.
[11] SN/T 1687-2005,马流感血凝抑制试验操作规程[S].
[12] Klinguer-Hamour C,Caussanel V,Beck A.Monoclonal antibodies for treating infectious diseases[J].Med Sci(Paris),2009,25(12):1116-1120.
[13] 郭 巍,王英原,王 宇,等.H3N8亚型马流感病毒间接ELISA抗体检测方法建立及应用[J].中国预防兽医学报,2010,32(3):190-193.
[14] 张 辉,崔焕忠,王兴龙.单核细胞增生李斯特菌ActA单克隆抗体的制备[J].动物医学进展,2010,31(5):82-85.
[15] 萨姆布鲁克J,弗里奇E F,曼尼阿蒂斯T.分子克隆实验指南[M].金冬雁,黎孟枫,侯云德,译.北京:科学出版社,2002:362-392.
[16] Qi T,Guo W,Huang W,et al.Isolation and genetic characterization of H3N8 equine influenza virus from donkeys in China[J].Vet Microbiol,2010,144(3-4):455-460.
[17] 郭 巍,戴伶俐,相文华,等.马流感病毒多重RT-PCR检测方法的建立[J].动物医学进展,2008,29(11):28-31.
[18] Mika I,Makoto N,Yuji H,et al.Genetic analyses of an H3N8 influenza virus isolate,causative strain of the outbreak of equine influenza at the Kanazawa Race horse in Japan in 2007[J].J Vet Med Sci,2008,70(9):899-906.
[19] Denyer S,Crowther R,Wardley C,et al.Development of an enzyme-linked immuno-sorbent assay(ELISA)for the detection of specific antibodies against an H7N7 and an H3N8 equine influenza virus[J].J Hyg,1984,93(3):9-20.
[20] Ozaki H,Sugita T,Sugita S,et al.Detection of antibody to the nonstructural protein(NS1)of influenza A virus allows distinction between vaccinated and infected horses[J].Vet Microbiol,2001,82:111-119.
[21] 朱来华,梁成珠,陆承平,等.基因芯片技术检测5种马病毒[J].农业生物技术学报,2006,14(2):203-207.
[22] 戴伶俐,李雪峰,相文华.马流感诊断方法研究进展与应用概况[J].中国预防兽医学报,2010,32(2):157-160.
