新辅助化疗联合同步放化疗治疗局部晚期鼻咽癌的临床研究
何爱军
在我国鼻咽癌是常见的头颈部恶性肿瘤,中晚期(Ⅲ~Ⅳ)占鼻咽癌约总数的70%[1]。治疗晚期鼻咽癌需放化疗综合治疗,才能减少局部复发、残留及远处转移[2]。本文笔者采用新辅助化疗联合同步放化疗治疗我院2008年12月至2010年10月100例晚期鼻咽癌患者,获得了满意的近期结果,报告如下。
1 资料与方法
1.1 一般资料 本研究鼻咽癌患者共100例,其中男69例,女31例;年龄20~66岁,平均年龄(48±11)岁。入组条件:经鼻咽镜检查并取活检病理证实为低分化鳞癌或未分化癌患者或鼻咽占位性病变,伴颈淋巴结转移,淋巴结活检为转移性低分化鳞癌或未分化癌患者;为无远处转移的局部晚期患者(AJCCⅢ期及无远处转移的Ⅳ期鼻咽癌);PS评分0~1,心电图、血常规、肝肾功能在正常范围内;治疗前有完整的影像学资料(鼻咽部+颈部CT或MRI)。患者随机分为试验组与对照组,每组50例,其中试验组采用新辅助化疗+同期放化疗,对照组采用同期放化疗。2组一般资料具有可比性。
1.2 方法 新辅助化疗方案:多西紫杉醇(Docetaxel)+顺铂(DDP)+氟尿嘧啶(5-Fu)。新辅助化疗持续3个疗程,如果从第1疗程起肿瘤能持续缩小,评价部分缓解(PR)甚至完全缓解(CR),则完成3个周期的化疗;如果疗程中评价为稳定(SD)或进展(PD)则就此终止新辅助化疗,开始放疗。新辅助化疗各药物的剂量强度为:Docetaxel 75 mg/m2,第1天,静脉滴注;DDP 25 mg/m2,第1至3天,静脉滴注,5-Fu 800 mg·m2·d-1持续静脉泵入96 h,每21天为1个周期。
同期放化疗方案:放疗的中位总剂量为70 Gy,以DDP同步化疗,90 mg/m2分别于第1、22、43天完成,放疗结束后复查鼻咽部及颈项部的CT或MRI,以根据肿瘤退缩情况及患者耐受性考虑是否放疗加量。
1.3 统计学分析 应用SPSS 13.0统计软件,计数资料采用χ2检验,生存差异运用Log-ramk检验,生存分析运用Kaplan-Meier统计生存曲线,P<0.05为差异有统计学意义。
2 结果
2.1 2组治疗后及3个月后CR比较 试验组经治疗后鼻咽部肿瘤CR(90.0%)与对照组CR(86.0%)比较,差异无统计学意义(P>0.05);治疗后试验组颈淋巴结CR(84.0%)与对照组CR(50.0%)比较,差异有统计学意义(P<0.05)。治疗结束3个月后,试验组与对照组鼻咽部、颈淋巴结CR比较,差异无统计学意义(P>0.05)。见表1。
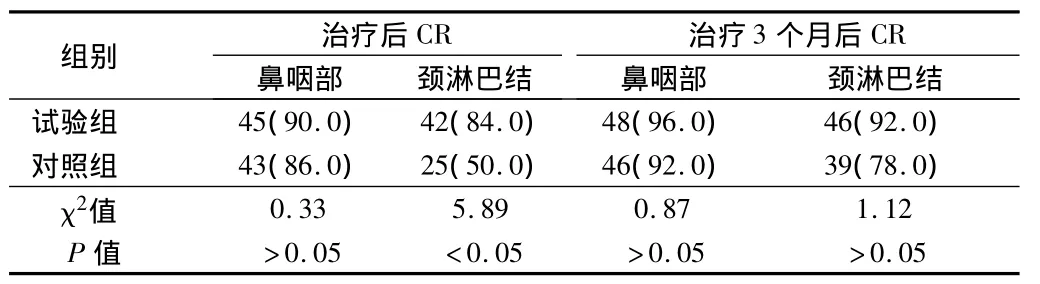
表1 2组治疗后及3个月后CR比较 n=50,例(%)
2.2 2组2年DFS及OS比较 2组2年DFS差异有统计学意义(P<0.05);而2组2年OS差异无统计学意义(P>0.05)。见表2。

表2 2组2年DFS及OS比较 n=50,例(%)
2.3 2组不良反应比较 试验组的不良反应发生率均高于对照组,2组口腔黏膜炎差异有统计学意义(P<0.05),其余各项2组差异均无统计学意义(P>0.05)。见表3。
3 讨论
新辅助化疗又称诱导化疗,因其在放射治疗前应用,肿瘤局部未造成纤维化,血供良好,利于化疗药物在鼻咽癌原发灶和淋巴结转移病灶的分布与利用,同时,患者营养状态良好,加强了患者对化疗的耐受性。放射治疗是鼻咽癌的主要治疗方法,但多数患者就诊时已属中晚期,单纯使用放射治疗难以达到满意的疗效[3,4]。本研究结果显示,治疗后及治疗结束3个月后试验组鼻咽部肿瘤CR、颈淋巴结CR均高于对照组,其中治疗后两组颈淋巴结CR具有统计学意义(P<0.05)。试验组2年DFS及OS均高于对照组,其中2组2年DFS差异具有统计学意义(P<0.05)。试验组患者的急性不良反应均高于对照组,其中2组口腔黏膜炎差异具有统计学意义(P<0.05),经积极外理后,症状多可缓解,不影响治疗的正常进程。
综上所述,采用新辅助化疗联合同步放化疗治疗局部晚期鼻咽癌疗效佳,值得今后进一步深入研究。
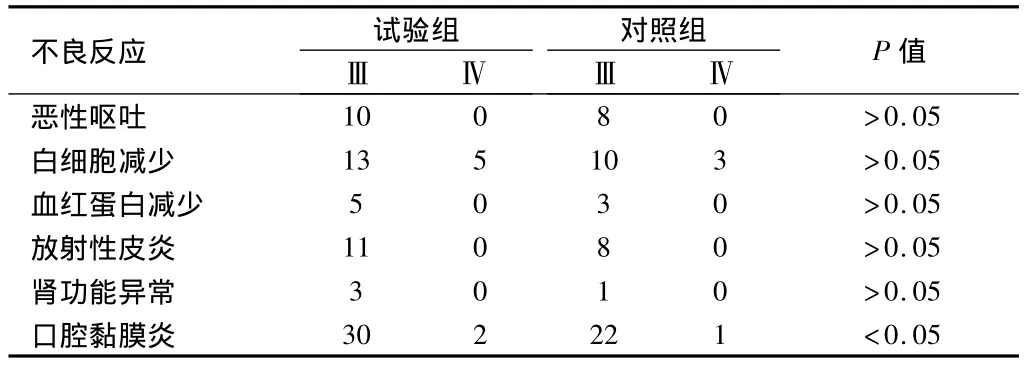
表3 2组不良反应比较 n=50,例(%)
1 徐正阳,陶庆松,郭建新,等.新辅助化疗联合同步放化疗治疗中晚期鼻咽癌85例.肿瘤学杂志,2008,14:791-793.
2 凌华海,陈焕伟,林文.新辅助化疗联合同期放化疗治疗中青年局部晚期鼻咽癌的临床观察.中华肿瘤防治杂志,2008,15:921-923.
3 贺秋冬,杨立,聂跃华,等.新辅助化疗加同步放化疗治疗局部晚期鼻咽癌Ⅱ期临床研究.临床肿瘤学杂志,2009,14:1011-1014.
4 胡福军,陈晓钟,姜峰,等.局部晚期鼻咽癌新辅助化疗加同期调强放化疗的初步结果.肿瘤学杂志,2009,15:384-387.

